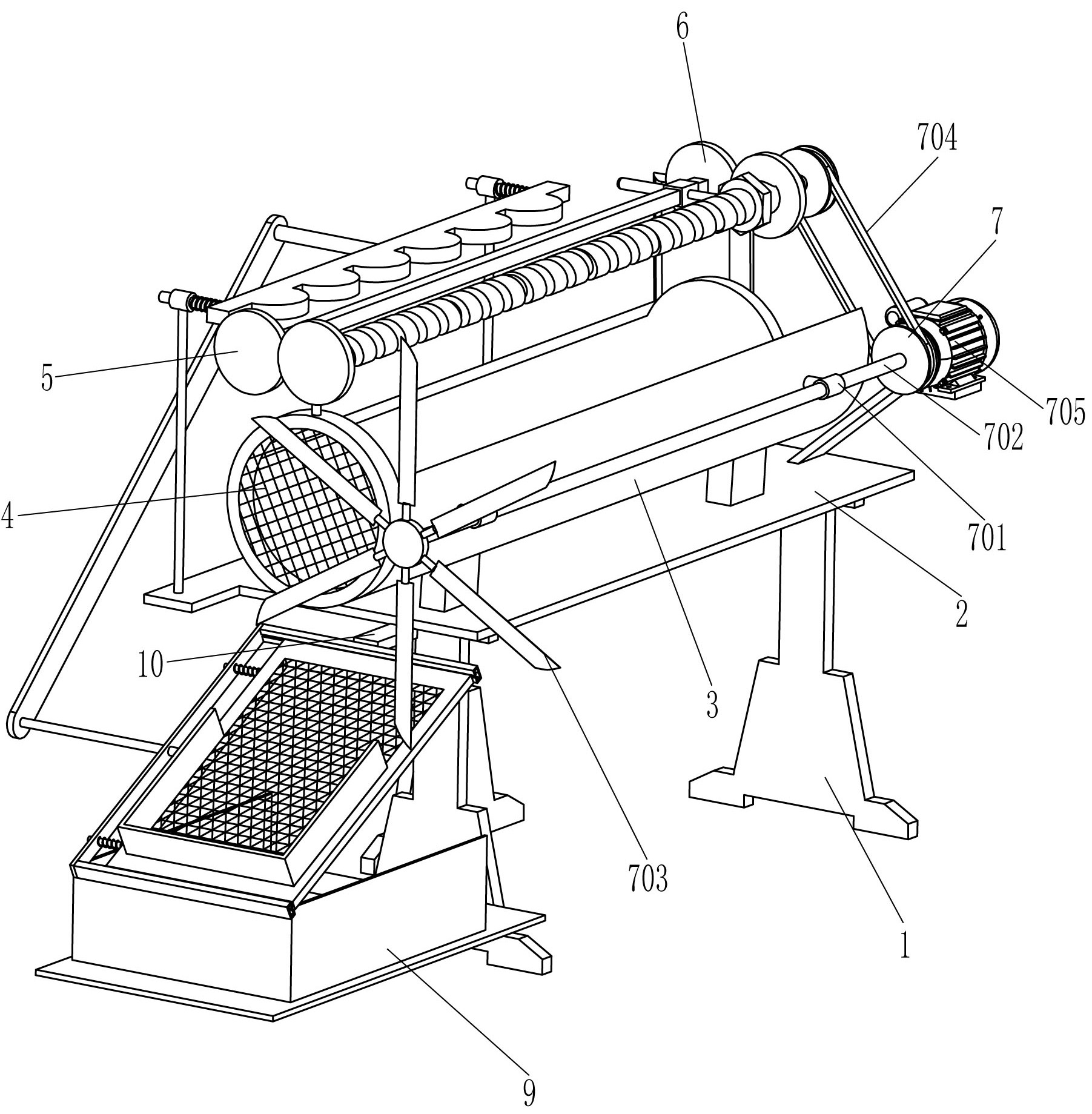
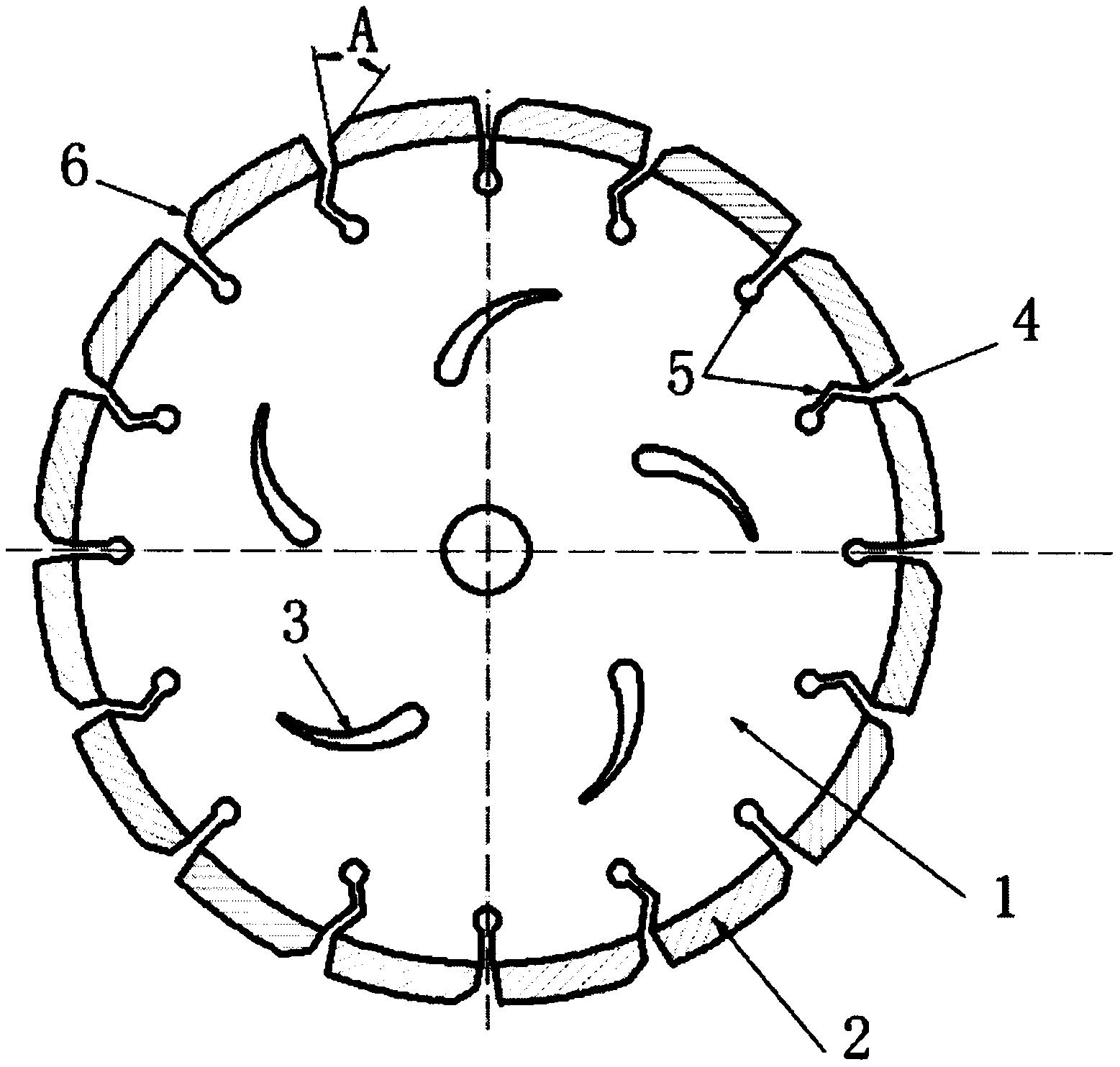
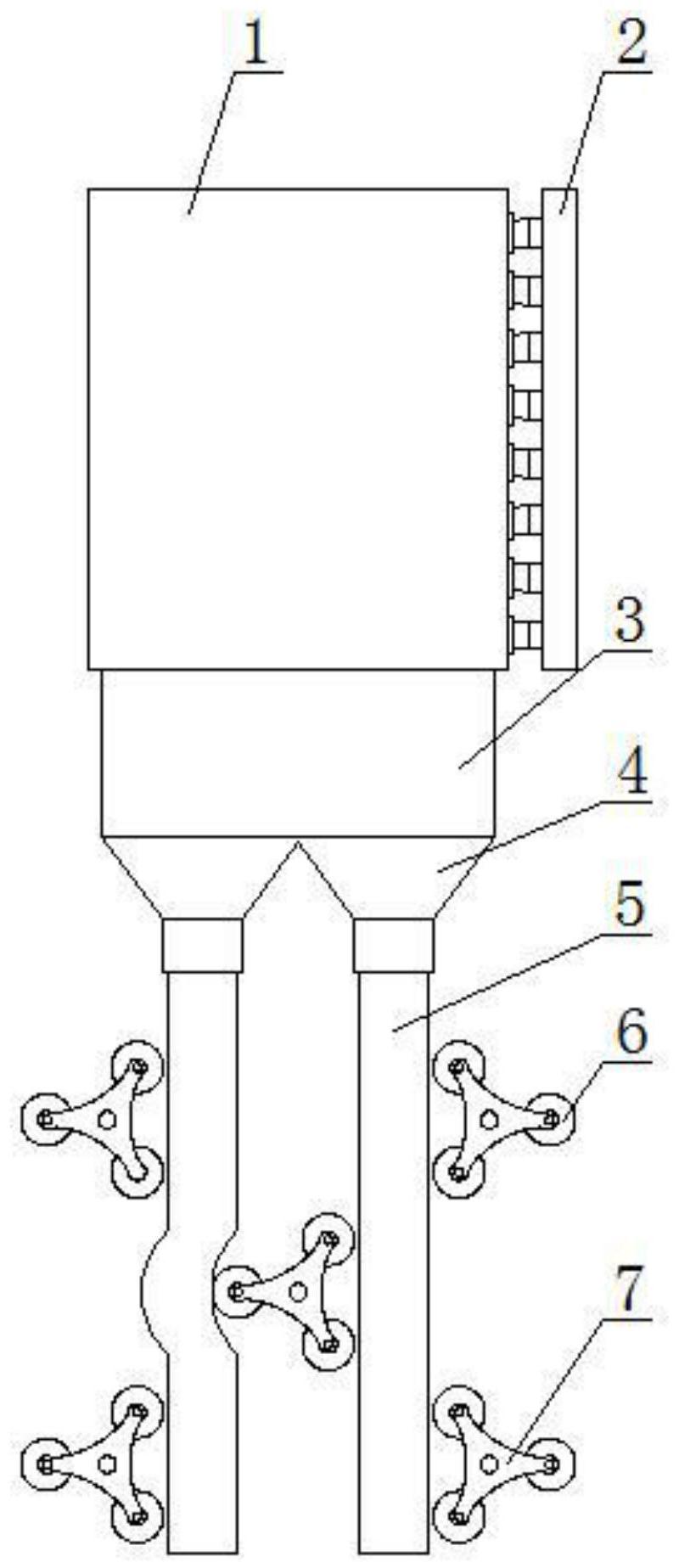
技术摘要:
本发明涉及了与噪声性听力下降(Noise induced hearing loss,NIHL)患病风险相关的易感基因区域7q36.3的SNP位点rs10081191的检测方法、试剂盒及其应用。所述方法为Sequenom分型,本发明进一步涉及检测上述易感位点的试剂盒及其应用。另外,本发明将7q36.3区域的SNP位点rs 全部
背景技术:
噪声是生活环境中最普遍的环境污染之一。经常接触噪声可能导致噪声性听力损 失(NIHL)。由于数以百万计的人每天都暴露在有害水平的噪音中,全世界大约有5%的人口 遭受工业、军事或娱乐性噪声危害。因此,NIHL严重影响个人的生活质量,给社会造成巨大 的经济损失。NIHL被认为是一个具有环境和遗传成分的多因素和多基因事件。已知的环境 因素包括噪音、吸烟、有机溶剂接触、高血压、胆固醇。动物研究也证实遗传因素与NIHL有 关。表现出年龄相关听力损失的小鼠比其他小鼠更容易受到噪声的影响。此外,敲除小鼠的 基因,如Pmca2-/-、Cdh23-/-、Sod1-/-和Gpx1-/-比野生型鼠更容易受到噪声的影响。对人 类的双胞胎研究表明,遗传成分在NIHL的发育过程中起着重要作用。基于候选基因的关联 研究发现,一些单核苷酸多态性与NIHL的风险显著相关。这些SNPs标记的基因主要分为以 下四个基因组:(i)氧化应激基因,如CAT、SOD1和SOD2;(ii)内耳钾循环途径基因,如KCNQ4 和KCNE1;(iii)HSP基因,如HSP70;(iv)单基因耳聋基因,如PCDH15和MYH14。最近,在一个由 25个病例和23个对照组成的欧洲人群中进行的全基因组关联研究显示,核仁蛋白(NCL)基 因中的一个SNP(rs7598759)与NIHL的风险显著相关。然而,这些发现不足以解释NIHL的总 遗传力。 此外,现有的NIHL的GWAS样本量有限,在中国人群中从未进行过NIHL的全基因组 关联研究。
技术实现要素:
本发明旨在至少解决现有技术中存在的技术问题之一。 为了在中国人群中发现与NIHL易感性相关的新基因,发明人进行了一项全基因组 关联研究,由89例NIHL患者(例)和209例听力正常的受试者(对照组)组成,接着在一个由53 例NIHL病例和360例对照者组成的独立样本集中进行验证。发明人发现7q36 .3(指数 rs10081191)是导致NIHL易感性的新位点。这些发现扩展了人们对NIHL遗传基础的理解。 为此,本发明的一个目的在于提出一种与噪声性听力损失疾病相关,能够有效用 于确定噪声性听力损失疾病易感个体的SNP。 其中,需要说明的是,SNP(single nucleotide polymorphism,SNP,即单核苷酸多 态性)是1996年由美国麻省理工学院的人类基因组研究中心学者Lander提出的一类分子遗 3 CN 111593108 A 说 明 书 2/16 页 传标记,主要是指基因组水平上由单个核苷酸的变异所引起的DNA序列多态性。SNP表现出 的多态性仅涉及到单个碱基的变异,表现是有转换、颠换、插入和缺失等。 根据本发明的一个方面,本发明提供了一种噪声性听力损失疾病相关的SNP。根据 本发明的实施例,所述SNP为人类7号染色体158322806(hg19)位置上的碱基A或C。本发明首 次将7q36.3区域的多态性位点rs10081191(位于人类基因组7号染色体158322806(hg19)位 置)与NIHL的患病风险联系起来。其中,该SNP为人类基因组区域7q36 .3上的多态性位点 rs10081191,确定了7q36.3是NIHL的一个新的易感基因区域,能够有效用于筛选噪声性听 力损失疾病易感群体和确定噪声性听力损失疾病易感个体。 根据本发明的实施例,所述SNP标记位于SEQ ID NO:1所示核苷酸序列的方框标记 处: TGAGATCCATTCCTAGGACAGGCTGACCCCACAATAAGTAGAATTACGTCAGATATTTAGAA(SEQ ID NO:1)。 根据本发明的实施例,所述SNP标记位于SEQ ID NO:1所示核苷酸序列的方框标记 处,SEQ ID NO:1所示核苷酸序列的方框标记处的碱基是A或C。根据本发明的实施例,该SNP 位点的AA基因型个体相比CC、AC基因型个体易感噪声性听力损失疾病。由此,该SNP位点的 AA基因型可以作为确定噪声性听力损失疾病易感个体的重要标准。 即发明人发现,该SNP位点的AA基因型个体的噪声性听力损失疾病的易感性显著 高于CC、AC基因型个体。进而,表明该SNP位点的AA基因型可以作为判断个体易感噪声性听 力损失疾病的重要标准。进而,根据本发明的实施例,通过检测个体的上述SNP,能够有效地 预测个体是否易感噪声性听力损失,具体地,如前所述,该SNP位点的AA基因型个体中易感 噪声性听力损失疾病的比重显著高于CC、AC基因型个体中的比重。从而,例如所述SNP位点 的基因型为AA时,则能够预测待测个体很大可能为易感噪声性听力损失疾病易感个体。由 此,发明人确定,本发明的SNP位点与人类个体的噪声性听力损失疾病的易感性紧密相关, 能够有效用于确定个体是否易感噪声性听力损失疾病。进而能够根据实际情况对个体进行 早期选择和预防,进一步能够有效降低噪声性听力损失疾病的发生率。此外,根据本发明的 一些实施例,利用本发明的SNP标记进行筛选噪声性听力损失疾病易感群体,具有早期筛 选、节省时间、成本低廉、准确性高的优点。 根据本发明的另一方面,本发明还提供了一种用于检测前面所述的本发明的一种 SNP标记的引物组。根据本发明的实施例,所述引物组包含:具有SEQ ID NO:2-4所示的核苷 酸序列,用于检测所述SNP标记。 具体地,引物组的序列如下所示(F为正向引物,R为反向引物,E为延伸引物): F:ACGTTGGATGGAGATCCATTCCTAGGACAG(SEQ ID NO:2)。 R:ACGTTGGATGTAGCCAGGGAACCAAATCAC(SEQ ID NO:3)。 E:GACAGGCTGACCCCA(SEQ ID NO:4)。 根据本发明的实施例,利用本发明的引物组能够有效地对待测个体的上述与噪声 性听力损失疾病相关的SNP标记所在的片段进行PCR扩增,进而通过测序能够有效实现对这 种SNP标记的检测,确定待测个体该种SNP标记位点的基因型,进而能够有效预测待测个体 是否易感噪声性听力损失疾病。具体地,该SNP位点的AA基因型个体中患噪声性听力损失疾 病的比重显著高于CC、AC基因型个体中患噪声性听力损失疾病的比重。从而,例如所述SNP 4 CN 111593108 A 说 明 书 3/16 页 标记位点的基因型为AA时,则能够预测待测个体易感噪声性听力损失疾病。由此,用于检测 前面所述的本发明的SNP标记的引物组,能够有效用于筛选噪声性听力损失疾病易感群体, 进而能够辅助早期实现短时间、低成本、高准确性地确定噪声性听力损失疾病易感个体。 根据本发明的又一方面,本发明还提供了一种用于检测前面所述的SNP标记的试 剂盒。根据本发明的实施例,该试剂盒包含:前面所述的用于检测本发明的SNP标记的引物 组。即本发明的试剂盒中包含具有SEQ ID NO:2-4所示的核苷酸序列的引物组。根据本发明 的实施例,利用本发明的试剂盒中所包含的引物组,能够有效实现对待测个体的上述与噪 声性听力损失疾病相关的SNP标记的多态性检测,确定待测个体该SNP标记位点的基因型, 进而能够有效预测待测个体是否易感噪声性听力损失疾病。具体地,该SNP位点的AA基因型 个体中患噪声性听力损失疾病的比重显著高于CC、AC基因型中患噪声性听力损失疾病的比 重。从而,例如所述SNP标记位点的基因型为AA基因型时,则能够预测待测个体很大可能为 易感噪声性听力损失疾病个体。由此,本发明的用于检测前面所述的本发明的SNP标记的试 剂盒,能够有效用于筛选易感噪声性听力损失疾病群体,进而能够辅助早期实现短时间、低 成本、高准确性地确定易感噪声性听力损失疾病个体。 根据本发明的再一方面,本发明还提供了前面所述的本发明的SNP标记、引物组或 试剂盒,在确定噪声性听力损失疾病易感个体中的用途。如前所述,通过能够用于检测本发 明的与噪声性听力损失疾病相关的SNP标记的试剂例如前述的引物组或包含该引物组的试 剂盒等,能够有效地检测确定待测个体的上述SNP标记的基因型,进而基于获得的基因型能 够有效预测待测个体是否易感噪声性听力损失疾。 进而,根据本发明的另一方面,本发明还提供了一种确定噪声性听力损失疾病易 感个体的方法。根据本发明的实施例,该方法通过对待测个体进行前面所述的SNP标记的检 测,预测所述待测个体是否易感噪声性听力损失疾病。具体地,可以通过能够用于检测本发 明的与噪声性听力损失疾病相关的SNP标记的试剂例如前述的引物组或包含该引物组的试 剂盒等,对待测个体进行PCR扩增、测序,以便检测确定待测个体的上述SNP标记的基因型, 进而基于获得的基因型能够有效预测待测个体是否易感噪声性听力损失疾病。其中,如前 所述,该SNP位点的AA基因型个体中患噪声性听力损失疾病的比重显著高于CC、AC基因型中 患噪声性听力损失疾病的比重。从而,例如所述SNP标记位点的基因型为AA时,则能够预测 待测个体极可能为易患噪声性听力损失疾病个体。由此,本发明的确定噪声性听力损失疾 病易感个体的方法,能够快速、高效、准确地确定噪声性听力损失疾病易感个体。 另外,根据本发明上述实施例的确定噪声性听力损失疾病易感个体的方法还可以 具有如下附加的技术特征: 根据本发明的实施例,对待测个体进行SNP标记检测的方法不受特别限制。测序、 单链构象多态性聚合酶链式反应(PCR single strand conformation polymorphism,PCR- SSCP)、限制性片段长度多态性聚合酶链式反应(PCR-restriction fragment length polymorphism,PCR-RFLP)及飞行时间质谱等技术均可以实现SNP的检测。其中,测序是一种 准确性最高、灵活性强,通量大、检测周期短的检测技术。只需在SNP位点的两侧设计一对引 物,扩增400-700bp的产物,再通过测序即可直接检测SNP位点的基因型。因而,本发明采用 测序的方法进行SNP标记检测。根据本发明的一些具体示例,通过对待测个体进行前面所述 SNP标记的检测,预测所述待测个体是否易感噪声性听力损失疾病,进一步包括:提取待测 5 CN 111593108 A 说 明 书 4/16 页 个体的基因组DNA;利用前面所述的引物组,将所述待测个体的基因组DNA进行PCR扩增,以 便获得PCR扩增产物;对所述PCR扩增产物进行测序,以便获得测序结果;基于所述测序结 果,确定所述待测个体的所述SNP标记的基因型;以及基于所述待测个体的所述SNP标记的 基因型,预测所述待测个体是否易感噪声性听力损失疾病。由此,能够有效提高确定噪声性 听力损失疾病易感个体的效率。 根据本发明的实施例,提取待测个体的基因组DNA的方法不受特别限制,可以采用 任何已知的基因组DNA提取方法或试剂盒进行。根据本发明的一些具体示例,采用常规酚- 氯仿方法抽提待测个体的基因组DNA。由此,能够有效获得质量好、纯度高的基因组DNA,便 于后续步骤进行。 根据本发明的实施例,将所述待测个体的基因组DNA进行PCR扩增的条件不受特别 限制。根据本发明的一些具体示例,PCR扩增:5μl反应体系为:10ng/μl基因组DNA 1μl,20μM 的上下游引物各0.25μl,10μM的探针各0.125μl,以及2.5μl 2×预混缓冲液(Applied Biosystems Sequenom Genotyping Master Mix;包括dNTP及Taq DNA聚合酶)。PCR条件为: 50℃ 2分钟;95℃ 10分钟;95℃ 15秒和60℃ 1分钟,共计40循环。由此,能够快速、高效、准 确地扩增本发明的SNP标记所在的片段,获得目标扩增产物,便于后续步骤的进行。根据本 发明的实施例,对所述PCR扩增产物进行测序的方法不受特别限制,只要能够有效获得PCR 扩增产物即SNP标记所在的片段的序列即可。根据本发明的一些具体示例,可以采用选自 HISEQ2000、SOLiD、454和单分子测序方法的至少一种对所述PCR扩增产物进行测序。由此, 能够高通量、快速、高效、准确地获得测序结果。 根据本发明的实施例,基于测序结果,通过比对人类参考基因组序列,能够有效确 定待测个体的SNP标记为AA、CC还是AC。 根据本发明的实施例,该SNP位点的AA基因型个体中患噪声性听力损失疾病的比 重极显著高于CC、AC基因型的个体中患噪声性听力损失疾病的比重。由此,基于确定的待测 个体的该SNP标记的基因型,能够准确有效地预测待测个体是否易感噪声性听力损失疾病。 具体地,例如所述SNP标记位点的基因型为AA时,则能够预测待测个体很大可能为易感噪声 性听力损失疾病个体。进而本发明的方法能够有效用于确定噪声性听力损失疾病易感个 体。 需要说明的是,本发明的与噪声性听力损失疾病相关的SNP标记及其应用具有如 下优点: (1)本发明提供的SNP标记不受个体的年龄、性别等限制,可用于筛选噪声性听力 损失疾病易感人群; (2)检测本发明的个体SNP位点的方法,准确可靠,操作方便; (3)本发明的个体SNP位点的检出,为筛选噪声性听力损失疾病易感人群提供了科 学依据。 本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变 得明显,或通过本发明的实践了解到。 附图说明 本发明的上述和附加的方面和优点从结合下面附图对实施例的描述中将变得明 6 CN 111593108 A 说 明 书 5/16 页 显和容易理解,其中: 图1显示了根据本发明实施例的研究工作流程概述; 其中,数字指的是病例和对照以及基因型或插补出来的SNP数量,利用1000人基因 组计划的数据进行插补,并在发掘阶段生成3830431个SNPs的基因型,在发掘阶段,29个显 著相关的SNP(P≤1.0×10-4)在验证阶段被分型。在验证阶段我们验证了rs10081191。最后, 结合两个阶段的研究结果对rs10081191进行meta分析; 图2显示了根据本发明实施例的主成分分析结果。(A-C)病例对照主成分图。圆圈 实点:病例;三角实点:对照。(D)病例-对照和千人基因组计划基因型数据主成分图。圆圈: 本研究中的病例和对照个体;倒三角:日本个体;正三角:中国北京个体;菱形:中国南方个 体; 图3显示了根据本发明实施例的发掘阶段全基因组P值的曼哈顿图和分位数图; (A)曼哈顿图显示利用logistic回归加性模型计算病例/对照人群在发现阶段通 过基因分型和推算出来的SNP的全基因组P值。x轴代表基因组位置,y轴显示-log10(P)。红 线表示P值为1.0×10-4。选择P≤1.0×10-4的SNPs进行验证; (B)分位数图,红线表示没有真正关联的零假设,具有梯度λ(膨胀系数)的黑线拟 合到观测试验统计分布的90%以下,该图是基于通过质量控制的SNPs,这些SNPs都是来源 于基因分型和基因插补,膨胀系数的值是0.996; 图4显示了根据本发明实施例的rs10081191在发掘和验证阶段森林图; 图5显示了根据本发明实施例的发掘阶段rs10081191周围相关位置的区域图,其 中, 基因组位置基于NCBI Build 37。在meta分析中,紫色菱形代表rs10081191的 meta-P值,其在发掘阶段的初始P值用紫色圆点表示。其他SNP与rs10081191的连锁不平衡 值用不同颜色表示。红色表示r2>0.8,橙色表示0.6
本发明涉及了与噪声性听力下降(Noise induced hearing loss,NIHL)患病风险相关的易感基因区域7q36.3的SNP位点rs10081191的检测方法、试剂盒及其应用。所述方法为Sequenom分型,本发明进一步涉及检测上述易感位点的试剂盒及其应用。另外,本发明将7q36.3区域的SNP位点rs 全部
背景技术:
噪声是生活环境中最普遍的环境污染之一。经常接触噪声可能导致噪声性听力损 失(NIHL)。由于数以百万计的人每天都暴露在有害水平的噪音中,全世界大约有5%的人口 遭受工业、军事或娱乐性噪声危害。因此,NIHL严重影响个人的生活质量,给社会造成巨大 的经济损失。NIHL被认为是一个具有环境和遗传成分的多因素和多基因事件。已知的环境 因素包括噪音、吸烟、有机溶剂接触、高血压、胆固醇。动物研究也证实遗传因素与NIHL有 关。表现出年龄相关听力损失的小鼠比其他小鼠更容易受到噪声的影响。此外,敲除小鼠的 基因,如Pmca2-/-、Cdh23-/-、Sod1-/-和Gpx1-/-比野生型鼠更容易受到噪声的影响。对人 类的双胞胎研究表明,遗传成分在NIHL的发育过程中起着重要作用。基于候选基因的关联 研究发现,一些单核苷酸多态性与NIHL的风险显著相关。这些SNPs标记的基因主要分为以 下四个基因组:(i)氧化应激基因,如CAT、SOD1和SOD2;(ii)内耳钾循环途径基因,如KCNQ4 和KCNE1;(iii)HSP基因,如HSP70;(iv)单基因耳聋基因,如PCDH15和MYH14。最近,在一个由 25个病例和23个对照组成的欧洲人群中进行的全基因组关联研究显示,核仁蛋白(NCL)基 因中的一个SNP(rs7598759)与NIHL的风险显著相关。然而,这些发现不足以解释NIHL的总 遗传力。 此外,现有的NIHL的GWAS样本量有限,在中国人群中从未进行过NIHL的全基因组 关联研究。
技术实现要素:
本发明旨在至少解决现有技术中存在的技术问题之一。 为了在中国人群中发现与NIHL易感性相关的新基因,发明人进行了一项全基因组 关联研究,由89例NIHL患者(例)和209例听力正常的受试者(对照组)组成,接着在一个由53 例NIHL病例和360例对照者组成的独立样本集中进行验证。发明人发现7q36 .3(指数 rs10081191)是导致NIHL易感性的新位点。这些发现扩展了人们对NIHL遗传基础的理解。 为此,本发明的一个目的在于提出一种与噪声性听力损失疾病相关,能够有效用 于确定噪声性听力损失疾病易感个体的SNP。 其中,需要说明的是,SNP(single nucleotide polymorphism,SNP,即单核苷酸多 态性)是1996年由美国麻省理工学院的人类基因组研究中心学者Lander提出的一类分子遗 3 CN 111593108 A 说 明 书 2/16 页 传标记,主要是指基因组水平上由单个核苷酸的变异所引起的DNA序列多态性。SNP表现出 的多态性仅涉及到单个碱基的变异,表现是有转换、颠换、插入和缺失等。 根据本发明的一个方面,本发明提供了一种噪声性听力损失疾病相关的SNP。根据 本发明的实施例,所述SNP为人类7号染色体158322806(hg19)位置上的碱基A或C。本发明首 次将7q36.3区域的多态性位点rs10081191(位于人类基因组7号染色体158322806(hg19)位 置)与NIHL的患病风险联系起来。其中,该SNP为人类基因组区域7q36 .3上的多态性位点 rs10081191,确定了7q36.3是NIHL的一个新的易感基因区域,能够有效用于筛选噪声性听 力损失疾病易感群体和确定噪声性听力损失疾病易感个体。 根据本发明的实施例,所述SNP标记位于SEQ ID NO:1所示核苷酸序列的方框标记 处: TGAGATCCATTCCTAGGACAGGCTGACCCCACAATAAGTAGAATTACGTCAGATATTTAGAA(SEQ ID NO:1)。 根据本发明的实施例,所述SNP标记位于SEQ ID NO:1所示核苷酸序列的方框标记 处,SEQ ID NO:1所示核苷酸序列的方框标记处的碱基是A或C。根据本发明的实施例,该SNP 位点的AA基因型个体相比CC、AC基因型个体易感噪声性听力损失疾病。由此,该SNP位点的 AA基因型可以作为确定噪声性听力损失疾病易感个体的重要标准。 即发明人发现,该SNP位点的AA基因型个体的噪声性听力损失疾病的易感性显著 高于CC、AC基因型个体。进而,表明该SNP位点的AA基因型可以作为判断个体易感噪声性听 力损失疾病的重要标准。进而,根据本发明的实施例,通过检测个体的上述SNP,能够有效地 预测个体是否易感噪声性听力损失,具体地,如前所述,该SNP位点的AA基因型个体中易感 噪声性听力损失疾病的比重显著高于CC、AC基因型个体中的比重。从而,例如所述SNP位点 的基因型为AA时,则能够预测待测个体很大可能为易感噪声性听力损失疾病易感个体。由 此,发明人确定,本发明的SNP位点与人类个体的噪声性听力损失疾病的易感性紧密相关, 能够有效用于确定个体是否易感噪声性听力损失疾病。进而能够根据实际情况对个体进行 早期选择和预防,进一步能够有效降低噪声性听力损失疾病的发生率。此外,根据本发明的 一些实施例,利用本发明的SNP标记进行筛选噪声性听力损失疾病易感群体,具有早期筛 选、节省时间、成本低廉、准确性高的优点。 根据本发明的另一方面,本发明还提供了一种用于检测前面所述的本发明的一种 SNP标记的引物组。根据本发明的实施例,所述引物组包含:具有SEQ ID NO:2-4所示的核苷 酸序列,用于检测所述SNP标记。 具体地,引物组的序列如下所示(F为正向引物,R为反向引物,E为延伸引物): F:ACGTTGGATGGAGATCCATTCCTAGGACAG(SEQ ID NO:2)。 R:ACGTTGGATGTAGCCAGGGAACCAAATCAC(SEQ ID NO:3)。 E:GACAGGCTGACCCCA(SEQ ID NO:4)。 根据本发明的实施例,利用本发明的引物组能够有效地对待测个体的上述与噪声 性听力损失疾病相关的SNP标记所在的片段进行PCR扩增,进而通过测序能够有效实现对这 种SNP标记的检测,确定待测个体该种SNP标记位点的基因型,进而能够有效预测待测个体 是否易感噪声性听力损失疾病。具体地,该SNP位点的AA基因型个体中患噪声性听力损失疾 病的比重显著高于CC、AC基因型个体中患噪声性听力损失疾病的比重。从而,例如所述SNP 4 CN 111593108 A 说 明 书 3/16 页 标记位点的基因型为AA时,则能够预测待测个体易感噪声性听力损失疾病。由此,用于检测 前面所述的本发明的SNP标记的引物组,能够有效用于筛选噪声性听力损失疾病易感群体, 进而能够辅助早期实现短时间、低成本、高准确性地确定噪声性听力损失疾病易感个体。 根据本发明的又一方面,本发明还提供了一种用于检测前面所述的SNP标记的试 剂盒。根据本发明的实施例,该试剂盒包含:前面所述的用于检测本发明的SNP标记的引物 组。即本发明的试剂盒中包含具有SEQ ID NO:2-4所示的核苷酸序列的引物组。根据本发明 的实施例,利用本发明的试剂盒中所包含的引物组,能够有效实现对待测个体的上述与噪 声性听力损失疾病相关的SNP标记的多态性检测,确定待测个体该SNP标记位点的基因型, 进而能够有效预测待测个体是否易感噪声性听力损失疾病。具体地,该SNP位点的AA基因型 个体中患噪声性听力损失疾病的比重显著高于CC、AC基因型中患噪声性听力损失疾病的比 重。从而,例如所述SNP标记位点的基因型为AA基因型时,则能够预测待测个体很大可能为 易感噪声性听力损失疾病个体。由此,本发明的用于检测前面所述的本发明的SNP标记的试 剂盒,能够有效用于筛选易感噪声性听力损失疾病群体,进而能够辅助早期实现短时间、低 成本、高准确性地确定易感噪声性听力损失疾病个体。 根据本发明的再一方面,本发明还提供了前面所述的本发明的SNP标记、引物组或 试剂盒,在确定噪声性听力损失疾病易感个体中的用途。如前所述,通过能够用于检测本发 明的与噪声性听力损失疾病相关的SNP标记的试剂例如前述的引物组或包含该引物组的试 剂盒等,能够有效地检测确定待测个体的上述SNP标记的基因型,进而基于获得的基因型能 够有效预测待测个体是否易感噪声性听力损失疾。 进而,根据本发明的另一方面,本发明还提供了一种确定噪声性听力损失疾病易 感个体的方法。根据本发明的实施例,该方法通过对待测个体进行前面所述的SNP标记的检 测,预测所述待测个体是否易感噪声性听力损失疾病。具体地,可以通过能够用于检测本发 明的与噪声性听力损失疾病相关的SNP标记的试剂例如前述的引物组或包含该引物组的试 剂盒等,对待测个体进行PCR扩增、测序,以便检测确定待测个体的上述SNP标记的基因型, 进而基于获得的基因型能够有效预测待测个体是否易感噪声性听力损失疾病。其中,如前 所述,该SNP位点的AA基因型个体中患噪声性听力损失疾病的比重显著高于CC、AC基因型中 患噪声性听力损失疾病的比重。从而,例如所述SNP标记位点的基因型为AA时,则能够预测 待测个体极可能为易患噪声性听力损失疾病个体。由此,本发明的确定噪声性听力损失疾 病易感个体的方法,能够快速、高效、准确地确定噪声性听力损失疾病易感个体。 另外,根据本发明上述实施例的确定噪声性听力损失疾病易感个体的方法还可以 具有如下附加的技术特征: 根据本发明的实施例,对待测个体进行SNP标记检测的方法不受特别限制。测序、 单链构象多态性聚合酶链式反应(PCR single strand conformation polymorphism,PCR- SSCP)、限制性片段长度多态性聚合酶链式反应(PCR-restriction fragment length polymorphism,PCR-RFLP)及飞行时间质谱等技术均可以实现SNP的检测。其中,测序是一种 准确性最高、灵活性强,通量大、检测周期短的检测技术。只需在SNP位点的两侧设计一对引 物,扩增400-700bp的产物,再通过测序即可直接检测SNP位点的基因型。因而,本发明采用 测序的方法进行SNP标记检测。根据本发明的一些具体示例,通过对待测个体进行前面所述 SNP标记的检测,预测所述待测个体是否易感噪声性听力损失疾病,进一步包括:提取待测 5 CN 111593108 A 说 明 书 4/16 页 个体的基因组DNA;利用前面所述的引物组,将所述待测个体的基因组DNA进行PCR扩增,以 便获得PCR扩增产物;对所述PCR扩增产物进行测序,以便获得测序结果;基于所述测序结 果,确定所述待测个体的所述SNP标记的基因型;以及基于所述待测个体的所述SNP标记的 基因型,预测所述待测个体是否易感噪声性听力损失疾病。由此,能够有效提高确定噪声性 听力损失疾病易感个体的效率。 根据本发明的实施例,提取待测个体的基因组DNA的方法不受特别限制,可以采用 任何已知的基因组DNA提取方法或试剂盒进行。根据本发明的一些具体示例,采用常规酚- 氯仿方法抽提待测个体的基因组DNA。由此,能够有效获得质量好、纯度高的基因组DNA,便 于后续步骤进行。 根据本发明的实施例,将所述待测个体的基因组DNA进行PCR扩增的条件不受特别 限制。根据本发明的一些具体示例,PCR扩增:5μl反应体系为:10ng/μl基因组DNA 1μl,20μM 的上下游引物各0.25μl,10μM的探针各0.125μl,以及2.5μl 2×预混缓冲液(Applied Biosystems Sequenom Genotyping Master Mix;包括dNTP及Taq DNA聚合酶)。PCR条件为: 50℃ 2分钟;95℃ 10分钟;95℃ 15秒和60℃ 1分钟,共计40循环。由此,能够快速、高效、准 确地扩增本发明的SNP标记所在的片段,获得目标扩增产物,便于后续步骤的进行。根据本 发明的实施例,对所述PCR扩增产物进行测序的方法不受特别限制,只要能够有效获得PCR 扩增产物即SNP标记所在的片段的序列即可。根据本发明的一些具体示例,可以采用选自 HISEQ2000、SOLiD、454和单分子测序方法的至少一种对所述PCR扩增产物进行测序。由此, 能够高通量、快速、高效、准确地获得测序结果。 根据本发明的实施例,基于测序结果,通过比对人类参考基因组序列,能够有效确 定待测个体的SNP标记为AA、CC还是AC。 根据本发明的实施例,该SNP位点的AA基因型个体中患噪声性听力损失疾病的比 重极显著高于CC、AC基因型的个体中患噪声性听力损失疾病的比重。由此,基于确定的待测 个体的该SNP标记的基因型,能够准确有效地预测待测个体是否易感噪声性听力损失疾病。 具体地,例如所述SNP标记位点的基因型为AA时,则能够预测待测个体很大可能为易感噪声 性听力损失疾病个体。进而本发明的方法能够有效用于确定噪声性听力损失疾病易感个 体。 需要说明的是,本发明的与噪声性听力损失疾病相关的SNP标记及其应用具有如 下优点: (1)本发明提供的SNP标记不受个体的年龄、性别等限制,可用于筛选噪声性听力 损失疾病易感人群; (2)检测本发明的个体SNP位点的方法,准确可靠,操作方便; (3)本发明的个体SNP位点的检出,为筛选噪声性听力损失疾病易感人群提供了科 学依据。 本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变 得明显,或通过本发明的实践了解到。 附图说明 本发明的上述和附加的方面和优点从结合下面附图对实施例的描述中将变得明 6 CN 111593108 A 说 明 书 5/16 页 显和容易理解,其中: 图1显示了根据本发明实施例的研究工作流程概述; 其中,数字指的是病例和对照以及基因型或插补出来的SNP数量,利用1000人基因 组计划的数据进行插补,并在发掘阶段生成3830431个SNPs的基因型,在发掘阶段,29个显 著相关的SNP(P≤1.0×10-4)在验证阶段被分型。在验证阶段我们验证了rs10081191。最后, 结合两个阶段的研究结果对rs10081191进行meta分析; 图2显示了根据本发明实施例的主成分分析结果。(A-C)病例对照主成分图。圆圈 实点:病例;三角实点:对照。(D)病例-对照和千人基因组计划基因型数据主成分图。圆圈: 本研究中的病例和对照个体;倒三角:日本个体;正三角:中国北京个体;菱形:中国南方个 体; 图3显示了根据本发明实施例的发掘阶段全基因组P值的曼哈顿图和分位数图; (A)曼哈顿图显示利用logistic回归加性模型计算病例/对照人群在发现阶段通 过基因分型和推算出来的SNP的全基因组P值。x轴代表基因组位置,y轴显示-log10(P)。红 线表示P值为1.0×10-4。选择P≤1.0×10-4的SNPs进行验证; (B)分位数图,红线表示没有真正关联的零假设,具有梯度λ(膨胀系数)的黑线拟 合到观测试验统计分布的90%以下,该图是基于通过质量控制的SNPs,这些SNPs都是来源 于基因分型和基因插补,膨胀系数的值是0.996; 图4显示了根据本发明实施例的rs10081191在发掘和验证阶段森林图; 图5显示了根据本发明实施例的发掘阶段rs10081191周围相关位置的区域图,其 中, 基因组位置基于NCBI Build 37。在meta分析中,紫色菱形代表rs10081191的 meta-P值,其在发掘阶段的初始P值用紫色圆点表示。其他SNP与rs10081191的连锁不平衡 值用不同颜色表示。红色表示r2>0.8,橙色表示0.6