技术摘要:
本文提供了用于产生如用于在细胞疗法中使用的表达重组受体的工程化T细胞的方法。在一些方面,所提供的方法包括在刺激条件下孵育所述细胞、通过转导或转染将重组多肽引入所述细胞和/或在促进增殖和/或扩增的条件下培育所述细胞的一个或多个步骤,其中一个或多个步骤在抑 全部
背景技术:
多种细胞疗法方法可用于治疗疾病和病症。细胞疗法方法是涉及用重组受体(如 嵌合抗原受体)基因工程化的免疫细胞(如T细胞)的方法。需要用于制造和/或工程化此类 细胞疗法的改进方法,包括提供更有效的方法和/ 或改进的细胞组合物产品。提供了满足 此类需要的用于产生工程化细胞的方法、工程化细胞、组合物、试剂盒和制品以及治疗方 法。
技术实现要素:
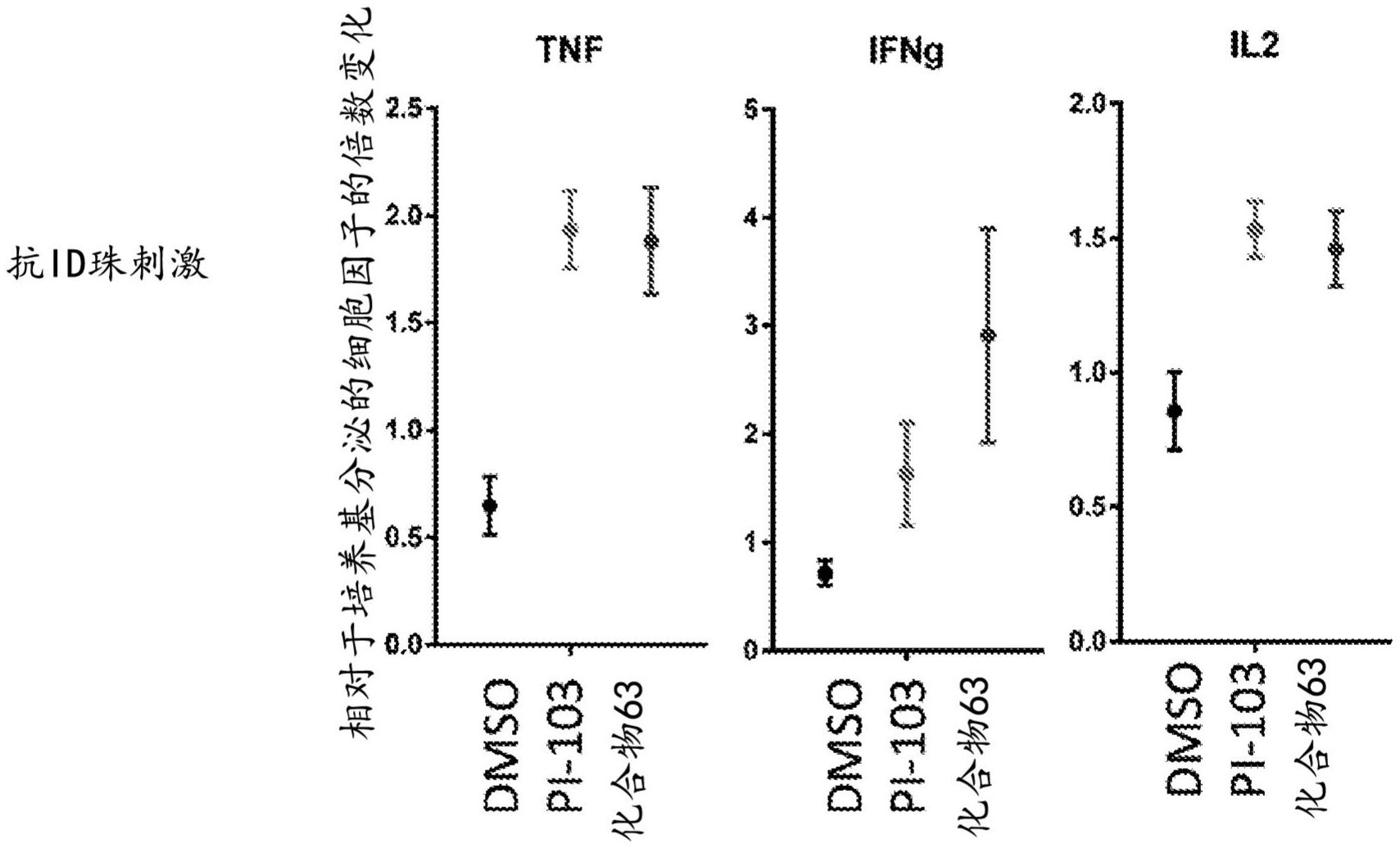
本文提供了用于产生工程化细胞的组合物的方法,所述方法包括在抑制 mTOR活 性的药剂存在下培育包含包括用重组受体工程化的细胞的原代人T 细胞的工程化细胞组 合物,其中所述组合物中的细胞在培育之前尚未暴露于所述药剂;并且其中所述方法导致 所述组合物中的所述细胞的增殖或扩增以产生包含工程化T细胞的输出组合物。在任何所 提供方法的特定实施方案中,所述原代T细胞是CD4 和/或CD8 T细胞。在任何所提供方法的 一些实施方案中,所述工程化T细胞组合物包含经富集CD4 T细胞。在任何所提供方法的某 些实施方案中,所述工程化T细胞组合物包含经富集CD8 T细胞。 本文提供了用于产生工程化细胞的组合物的方法,所述方法包括在抑制 mTOR活 性的药剂存在下培育包含包括用重组受体工程化的T细胞的经富集 CD4 和/或经富集CD8 原代人T细胞的工程化细胞组合物;其中所述方法导致所述组合物中细胞的增殖或扩增以 12 CN 111615556 A 说 明 书 2/126 页 产生包含工程化的经富集CD4 和/或经富集CD8 T细胞的输出组合物。在任何所提供方法的 一些实施方案中,所述工程化T细胞组合物包含大于或大于约70%、大于或大于约75%、大 于或大于约80%、大于或大于约85%、大于或大于约90%、大于或大于约95%或大于或大于 约98%CD4 原代人T细胞;和/或所述输入组合物基本上由CD4 原代人T细胞组成。在任何所 提供方法的特定实施方案中,所述工程化T细胞组合物包含大于或大于约70%、大于或大于 约75%、大于或大于约80%、大于或大于约85%、大于或大于约90%、大于或大于约95%或 大于或大于约98% CD8 原代人T细胞;和/或所述输入组合物基本上由CD8 原代人T细胞组 成。在任何所提供方法的某些实施方案中,所述工程化T细胞组合物包含大于或大于约 70%、大于或大于约75%、大于或大于约80%、大于或大于约85%、大于或大于约90%、大于 或大于约95%或大于或大于约98%CD4 和CD8 原代人T细胞;和/或所述输入组合物基本上 由CD4 和CD8 原代人T细胞组成。 在任何所提供方法的某些实施方案中,所述培育是在一种或多种细胞因子存在下 进行。在任何所提供方法的一些实施方案中,所述一种或多种细胞因子包括IL-2、IL-4、IL- 7、IL-9、IL-12、IL-15、G-CSF和GM-CSF中的一种或多种。在任何所提供方法的特定实施方案 中,所述一种或多种细胞因子是重组细胞因子。 在任何所提供方法的某些实施方案中,在所述培育之前,所述方法进一步包括: (a)在刺激条件下孵育包含原代T细胞的输入组合物,所述刺激条件包括存在能够激活TCR 复合物的一种或多种组分的一个或多个细胞内信号传导结构域和/或一种或多种共刺激分 子的一个或多个细胞内信号传导结构域的刺激试剂,从而生成经刺激组合物;以及(b)将重 组受体引入所述经刺激组合物中,从而生成包含工程化T细胞的工程化组合物。 在任何所提供方法的一些实施方案中,所述输入组合物、所述经刺激组合物和/或 所述工程化组合物包含原代CD4 和/或CD8 T细胞。在任何所提供方法的特定实施方案中, 所述输入组合物、所述经刺激组合物和/或所述工程化组合物包含经富集CD4 T细胞。在任 何所提供方法的某些实施方案中,所述输入组合物、所述经刺激组合物和/或所述工程化组 合物包含经富集 CD8 T细胞。 本文提供了用于产生工程化细胞的组合物的方法,所述方法包括:(a)在刺激条件 下孵育包含针对CD4 和/或CD8 原代人T细胞进行富集的T细胞的输入组合物,所述刺激条 件包括以下的存在:(i)能够激活TCR复合物的一种或多种组分的一个或多个细胞内信号传 导结构域和/或一种或多种共刺激分子的一个或多个细胞内信号传导结构域的刺激试剂和 (ii)抑制mTOR活性的药剂;以及(b)将重组受体引入所述经刺激组合物中,从而生成包含工 程化T细胞的工程化组合物。 在任何所提供方法的一些实施方案中,所述输入组合物、所述经刺激组合物和/或 所述工程化组合物包含大于或大于约70%、大于或大于约75%、大于或大于约80%、大于或 大于约85%、大于或大于约90%、大于或大于约95%或大于或大于约98%CD4 原代人T细 胞;和/或所述输入组合物基本上由 CD4 原代人T细胞组成。在任何所提供方法的特定实施 方案中,所述输入组合物、所述经刺激组合物和/或所述工程化组合物包含大于或大于约 70%、大于或大于约75%、大于或大于约80%、大于或大于约85%、大于或大于约90%、大于 或大于约95%或大于或大于约98%CD8 原代人T细胞;和/或所述输入组合物基本上由CD8 原代人T细胞组成。在任何所提供方法的某些实施方案中,所述输入组合物、所述经刺激组 13 CN 111615556 A 说 明 书 3/126 页 合物和/或所述工程化组合物包含大于或大于约70%、大于或大于约75%、大于或大于约 80%、大于或大于约85%、大于或大于约90%、大于或大于约95%或大于或大于约98%CD4 和CD8 原代人T细胞;和/或所述输入组合物基本上由CD4 和CD8 原代人T细胞组成。 在任何所提供方法的某些实施方案中,所述抑制mTOR活性的药剂是小分子、小有 机分子、多核苷酸、寡核苷酸、siRNA或多肽。在一些实施方案中,所述抑制mTOR活性的药剂 是小有机分子。在任何所提供方法的一些实施方案中,所述抑制mTOR活性的药剂抑制 mTORC1和/或mTORC2激酶活性。在任何所提供方法的特定实施方案中,所述抑制mTOR活性的 药剂抑制至少一种另外的激酶的活性。在任何所提供方法的某些实施方案中,所述至少一 种另外的激酶是PI3K。在任何所提供方法的一些实施方案中,其中所述抑制mTOR活性的药 剂是BEZ235、BGT226、GDC0980、NVP-BEZ235、 PF-04691502、PI-103、SAR245409、SF1126、 VS5584或XL765。 在任何所提供方法的特定实施方案中,所述抑制mTOR活性的药剂:(i) 不抑制 PI3K活性;(ii)在对mTOR活性的IC50下不可检测地抑制PI3K活性;和/或(iii)在所有可检测 地抑制mTOR活性的浓度下均不可检测地抑制 PI3K。在任何所提供方法的某些实施方案中, 所述抑制mTOR活性的药剂抑制mTORC1和mTORC2激酶活性。在任何所提供方法的一些实施方 案中,所述抑制mTOR活性的药剂是吡唑并嘧啶、Torin l、Torkinib、PP30、Ku-0063794、 WAY-600(Wyeth)、WAY-687(Wyeth)、WAY-354(Wyeth)、OSI-027、DS3078a 或AZD8055。在任何 所提供方法的特定实施方案中,所述抑制mTOR活性的药剂选择性地抑制mTORC1活性。 在任何所提供方法的某些实施方案中,所述抑制mTOR活性的药剂:(i) 不抑制 mTORC2活性;(ii)在针对mTORC1活性的IC50下不可检测地抑制 mTORC2活性;和/或(iii)在 所有可检测地抑制mTORC1活性的浓度下均不可检测地抑制mTORC2。在任何所提供方法的一 些实施方案中,所述抑制 mTOR活性的药剂是雷帕霉素、替西罗莫司(temsirolimus)、依维 莫司 (everolimus)、地弗莫司(deforolimus)或AZD8055。 在任何所提供方法的特定实施方案中,所述药剂包括式I中所示的式, 其中R1是取代或未取代的C1-8烷基、取代或未取代的芳基、取代或未取代的杂芳 基、取代或未取代的环烷基或取代或未取代的杂环烷基,R2是取代或未取代的C1-8烷基、取 代或未取代的芳基、取代或未取代的杂芳基、取代或未取代的环烷基或取代或未取代的杂 环烷基,并且R3和R4独立地是H或C1-8烷基。在一些实施方案中,所述抑制mTOR活性的药剂是 或包括式(I)的化合物、或其药学上可接受的盐或溶剂化物。在一些实施方案中,所述抑制 mTOR 活性的药剂是或包括式(I)的化合物、或其药学上可接受的盐。 14 CN 111615556 A 说 明 书 4/126 页 在任何所提供方法的某些实施方案中,R1是取代的芳基、取代或未取代的杂芳基, 如取代的苯基。在任何所提供方法的一些实施方案中,R2是取代或未取代的芳基和/或取代 或未取代的苯基。在一些实施方案中,R2是取代或未取代的芳基,如取代或未取代的苯基。 在任何所提供方法的特定实施方案中,取代的基团是被一个或多个如下基团取代:卤素; C1-8烷基;C2-8烯基; C2-8炔基;羟基;C1-8烷氧基;氨基;硝基;硫醇;硫醚;亚胺;氰基;酰胺基; 膦酸基;膦;羧基;硫代羰基;磺酰基;磺酰胺;酮;醛;酯;羰基;卤代烷基;B(OH)2;碳环环烷 基;杂环烷基;单环或稠合或非稠合多环芳基或杂芳基;氨基;O-低级烷基;O-芳基;芳基;芳 基-低级烷基;CO2CH3; CONH2;OCH2CONH2;NH2;SO2NH2;OCHF2;CF3;或OCF3基团。在任何所提供 方法的某些实施方案中,所述抑制mTOR活性的药剂是化合物63。在任何所提供方法的一些 实施方案中,所述抑制mTOR活性的药剂是或包括 2-(3-羟基苯基)-9-(2-异丙基苯基)-8- 氧代-8,9-二氢-7H-嘌呤-6-甲酰胺、或其药学上可接受的盐或溶剂化物。在任何所提供方 法的一些实施方案中,所述抑制mTOR活性的药剂是或包括 或其 药学上可接受的盐。 在任何所提供方法的一些实施方案中,所述药剂包括式(II)中所示的式, 其中L是直接键、NH或O,Y是N或CR3,其中R1是H、取代或未取代的C1-8烷基、取代或未 取代的C2-8烯基、取代或未取代的芳基、取代或未取代的杂芳基、取代或未取代的环烷基或 取代或未取代的杂环烷基,R2是H、取代或未取代的C1-8烷基、取代或未取代的芳基、取代或 未取代的杂芳基、取代或未取代的环烷基或取代或未取代的杂环烷基,R3是H、取代或未取 代的C1-8烷基、取代或未取代的芳基、取代或未取代的杂芳基、取代或未取代的环烷基、取代 或未取代的杂环烷基、-NHR4或-N(R4)2,并且R4在每次出现时独立地是取代或未取代的C1-8 烷基、取代或未取代的芳基、取代或未取代的杂芳基、取代或未取代的环烷基或取代或未取 代的杂环烷基。在一些实施方案中,所述抑制mTOR活性的药剂是或包括式(II)的化合物、或 其药学上可接受的盐或溶剂化物。在一些实施方案中,所述抑制mTOR活性的药剂是或包括 式 (II)的化合物、或其药学上可接受的盐。 在任何所提供方法的特定实施方案中,R1是取代的芳基和/或取代的苯基。在任何 所提供方法的一些实施方案中,R1是取代的芳基,如取代的苯基。在任何所提供方法的某些 15 CN 111615556 A 说 明 书 5/126 页 实施方案中,Y是CH。在任何所提供方法的一些实施方案中,L是直接键。在任何所提供方法 的特定实施方案中,R1是取代的芳基并且R2是被一个或多个选自以下的取代基取代的C1-8烷 基:烷氧基、氨基、羟基、环烷基或杂环烷基。在任何所提供方法的某些实施方案中,R2是被 一个或多个杂环烷基取代的C1-8烷基。在任何所提供方法的一些实施方案中,所述抑制mTOR 活性的药剂是化合物155。在任何所提供方法的一些实施方案中,所述抑制mTOR活性的药剂 是或包括6-(4-(2H-1,2,4-三唑-3-基)苯基)-1-(2-(四氢-2H-吡喃-4-基)乙基)-1H-咪唑 并[4,5-b]吡嗪-2(3H)-酮、或其药学上可接受的盐或溶剂化物。在任何所提供方法的一些 实施方案中,所述抑制mTOR活性的药剂是或包括 或其药学 上可接受的盐。 在任何所提供方法的特定实施方案中,所述药剂包括式III中所示的式 其中R1是取代或未取代的C1-8烷基、取代或未取代的芳基、取代或未取代的环烷 基、取代或未取代的杂环基或取代或未取代的杂环基烷基,R2是H、取代或未取代的C1-8烷 基、取代或未取代的环烷基、取代或未取代的杂环基、取代或未取代的杂环基烷基、取代或 未取代的芳烷基或取代或未取代的环烷基烷基,并且R3是H,或取代或未取代的C1-8烷基。在 任何所提供方法的某些实施方案中,R1是取代或未取代的芳基或取代或未取代的杂芳基。 在任何所提供方法的一些实施方案中,R1是取代的吡啶基。在一些实施方案中,所述抑制 mTOR活性的药剂是或包括式(III)的化合物、或其药学上可接受的盐或溶剂化物。在一些实 施方案中,所述抑制mTOR活性的药剂是或包括式(III) 的化合物、或其药学上可接受的盐。 在任何所提供方法的特定实施方案中,R1是被一个或多个独立地选自以下的取代 基取代的吡啶基:取代或未取代的C1-8烷基、取代或未取代的杂环基、卤素、氨基羰基、氰基、 羟基烷基、-OR和-NR2,其中每个R独立地是 H,或取代或未取代的C1-4烷基。在某些实施方案 中,R1是1H-吡咯并[2,3-b] 吡啶基或苯并咪唑基,任选地被一个或多个独立地选自以下的 取代基取代:取代或未取代的C1-8烷基和-NR2,其中R独立地是H,或取代或未取代的C1-4烷 基。 在任何所提供方法的一些实施方案中,R1是 16 CN 111615556 A 说 明 书 6/126 页 其中R在每次出现时独立地是H、或取代或未取代的C1-4烷基(例如,甲基); R1在每 次出现时独立地是取代或未取代的C1-4烷基、卤素、氰基、-OR或-NR2; m是0-3;并且n是0- 3。 在任何所提供方法的特定实施方案中,R2是H、甲基、乙基、正丙基、异丙基、正丁 基、仲丁基、异丁基、叔丁基、正戊基、异戊基、环戊基、环己基、四氢呋喃基、四氢吡喃基、 (C1-4烷基)-苯基、(C1-4烷基)-环丙基、(C1-4烷基)-环丁基、(C1-4烷基)-环戊基、(C1-4烷基)- 环己基、(C1-4烷基)-吡咯烷基、 (C1-4烷基)-哌啶基、(C1-4烷基)-哌嗪基、(C1-4烷基)-吗啉 基、(C1-4烷基)-四氢呋喃基或(C1-4烷基)-四氢吡喃基,各自任选地被取代。 在任何所提供方法的某些实施方案中,R2是H、C1-4烷基、(C1-4烷基)(OR)、 其中R在每次出现时独立地是H、或取代或未取代的C1-8烷基,R'在每次出现时独立 地是H、-OR、氰基或取代或未取代的C1-8烷基,并且p是0-3。 在任何所提供方法的一些实施方案中,所述抑制mTOR活性的药剂是化合物246。在 任何所提供方法的一些实施方案中,所述抑制mTOR活性的药剂是或包括7-(6-(2-羟基丙- 2-基)吡啶-3-基)-1-((1r,4r)-4-甲氧基环己基)-3,4-二氢吡嗪并[2,3-b]吡嗪-2(1H)- 酮、或其药学上可接受的盐或溶剂化物。在任何所提供方法的一些实施方案中,所述抑制 17 CN 111615556 A 说 明 书 7/126 页 mTOR活性的药剂是或包括 或其药学上可接受的盐。 本文提供了用于产生工程化细胞的组合物的方法,所述方法包括在抑制 mTOR活 性的药剂存在下培育包含包括用重组受体工程化的T细胞的经富集原代人T细胞的工程化 细胞组合物;其中所述抑制mTOR活性的药剂是化合物63、化合物155或化合物246;并且其中 所述方法导致所述组合物中细胞的增殖或扩增以产生包含工程化T细胞的输出组合物。 在任何所提供方法的特定实施方案中,在500nM与2μM之间、在1nM 与100nM之间、 在50nM与250nM之间或在100nM与500nM之间的化合物63 存在下培育所述工程化细胞组合 物。在任何所提供方法的某些实施方案中,在500nM与2μM之间、在1nM与100nM之间、在50nM 与250nM之间或在 100nM与500nM之间的化合物155存在下培育所述工程化细胞组合物。在 任何所提供方法的一些实施方案中,在500nM与2μM之间、在1nM与100nM 之间、在50nM与 250nM之间或在100nM与500nM之间的化合物246存在下培育所述工程化细胞组合物。 在任何所提供方法的特定实施方案中,在所述培育之前,所述方法进一步包括: (a)在刺激条件下、在抑制mTOR活性的药剂存在下孵育包含原代T 细胞的输入组合物,其中 所述刺激条件包括存在能够激活TCR复合物的一种或多种组分的一个或多个细胞内信号传 导结构域和/或一种或多种共刺激分子的一个或多个细胞内信号传导结构域的刺激试剂, 从而生成经刺激组合物;并且其中所述抑制mTOR活性的药剂是化合物63、化合物155或化合 物 246;以及(b)将重组受体引入所述经刺激组合物中,从而生成包含工程化T 细胞的工程 化组合物。 本文提供了用于产生工程化细胞的组合物的方法,所述方法包括:(a)在刺激条件 下孵育包含原代人T细胞的输入组合物,所述刺激条件包括以下的存在:(i)能够激活TCR复 合物的一种或多种组分的一个或多个细胞内信号传导结构域和/或一种或多种共刺激分子 的一个或多个细胞内信号传导结构域的刺激试剂和(ii)抑制mTOR活性的药剂,其中所述抑 制mTOR活性的药剂是化合物63、化合物155或化合物246;以及(b)将重组受体引入所述经刺 激组合物中,从而生成包含工程化T细胞的工程化组合物。在一些实施方案中,所述原代T细 胞富含CD4 和/或CD8 T细胞。 在任何所提供方法的某些实施方案中,所述刺激试剂包含与TCR复合物的成员特 异性地结合、任选地与CD3特异性地结合的一级药剂。在任何所提供方法的一些实施方案 中,所述刺激试剂进一步包含与T细胞共刺激分子特异性地结合的二级药剂,任选地其中所 述共刺激分子选自CD28、CD137 (4-1-BB)、OX40或ICOS。在任何所提供方法的特定实施方案 中,所述一级和/或二级药剂包括抗体,任选地其中所述刺激试剂包括与抗CD3抗体和抗 CD28抗体或其抗原结合片段一起孵育。在任何所提供方法的某些实施方案中,所述一级药 剂和/或二级药剂存在于固体支持物的表面上。在任何所提供方法的一些实施方案中,固体 支持物是或包括珠。在任何所提供方法的特定实施方案中,所述珠的直径大于或大于约3.5 μm,但是不大于约9μm或不大于约8μm或不大于约7μm或不大于约6μm或不大于约5μm。在任何 18 CN 111615556 A 说 明 书 8/126 页 所提供方法的某些实施方案中,所述珠的直径为或为约4.5μm。在任何所提供方法的一些实 施方案中,所述珠是惰性的。在任何所提供方法的特定实施方案中,所述珠是或包括聚苯乙 烯表面。在任何所提供方法的某些实施方案中,所述珠是磁性或超顺磁性的。在任何所提供 方法的一些实施方案中,珠与细胞的比率为从或从约4:1至0.25:1。 在任何所提供方法的特定实施方案中,所述引入包括用包含编码所述重组受体的 多核苷酸的病毒载体转导所述经刺激组合物的细胞。在任何所提供的方法的某些实施方案 中,所述病毒载体是逆转录病毒载体。在任何所提供的方法的一些实施方案中,所述病毒载 体是逆转录病毒载体或γ逆转录病毒载体。在任何所提供方法的特定实施方案中,所述引 入包括用包含编码所述重组受体的多核苷酸的载体转染所述经刺激组合物的所述细胞。在 任何所提供方法的某些实施方案中,所述载体是转座子,任选地Sleeping Beauty(SB) 转 座子或Piggybac转座子。 在所提供方法的一些实施方案中,在所述培育之后,所述方法进一步包括收集所 述输出组合物的细胞。任何所提供方法的特定实施方案进一步包括任选地在药学上可接受 的赋形剂存在下配制所述输出组合物的细胞以用于低温保存和/或给予至受试者。在任何 所提供方法的某些实施方案中,在低温保护剂存在下配制所述输出组合物的所述细胞。在 任何所提供方法的一些实施方案中,所述低温保护剂包括DMSO。在任何所提供方法的特定 实施方案中,将所述输出组合物的所述细胞配制于容器,任选地小瓶或袋中。 所提供方法的某些实施方案进一步包括在所述孵育之前将所述CD4 和/ 或所述 CD8 T细胞从生物样品中分离。在任何所提供方法的一些实施方案中,所述分离包括基于 CD4和/或CD8的表面表达来选择细胞,任选地通过阳性或阴性选择。在任何所提供方法的特 定实施方案中,所述分离包括进行基于免疫亲和力的选择。在任何所提供方法的某些实施 方案中,所述生物样品包括从受试者获得的原代T细胞。在任何所提供方法的一些实施方案 中,所述生物样品是或包括全血样品、血沉棕黄层样品、外周血单核细胞(PBMC) 样品、未分 级T细胞样品、淋巴细胞样品、白细胞样品、单采术产物或白细胞单采术产物。 在任何所提供方法的特定实施方案中,所述重组受体能够与靶抗原结合,所述靶 抗原与疾病、障碍或病症相关,为疾病、障碍或病症所特有,和 /或在疾病、障碍或病症的细 胞或组织上表达。在任何所提供方法的某些实施方案中,所述疾病、障碍或病症是感染性疾 病或障碍、自身免疫性疾病、炎性疾病、或肿瘤或癌症。在任何所提供的方法的一些实施方 案中,所述靶抗原是肿瘤抗原。 在任何所提供的方法的特定实施方案中,所述靶抗原选自5T4、8H9、avb6 整合素、 B7-H6、B细胞成熟抗原(BCMA)、CA9、癌症-睾丸抗原、碳酸酐酶9(CAIX)、CCL-1、CD19、CD20、 CD22、CEA、乙型肝炎表面抗原、 CD23、CD24、CD30、CD33、CD38、CD44、CD44v6、CD44v7/8、 CD123、CD138、CD171、癌胚抗原(CEA)、CE7、细胞周期蛋白、细胞周期蛋白A2、 c-Met、双重抗 原、EGFR、上皮糖蛋白2(EPG-2)、上皮糖蛋白40(EPG-40)、 EPHa2、肝配蛋白B2、erb-B2、erb- B3、erb-B4、erbB二聚体、EGFR vIII、雌激素受体、胎儿AchR、叶酸受体α、叶酸结合蛋白 (FBP)、FCRL5、FCRH5、胎儿乙酰胆碱受体、G250/CAIX、GD2、GD3、G蛋白偶联受体5D(GPRC5D)、 gp100、Her2/neu(受体酪氨酸激酶erbB2)、HMW-MAA、IL-22R-α、IL-13 受体α2(IL-13Ra2)、 激酶插入结构域受体(kdr)、κ轻链、路易斯Y、L1细胞粘附分子(L1-CAM)、黑色素瘤相关抗原 (MAGE)-A1、MAGE-A3、 MAGE-A6、MART-1、间皮素、鼠CMV、粘蛋白1(MUC1)、MUC16、NCAM、 19 CN 111615556 A 说 明 书 9/126 页 NKG2D、NKG2D配体、NY-ESO-1、O-乙酰化GD2(OGD2)、癌胚胎抗原、黑色素瘤优先表达抗原 (PRAME)、PSCA、孕酮受体、存活蛋白、ROR1、 TAG72、tEGFR、VEGF受体、VEGF-R2、Wilms肿瘤1 (WT-1)、病原体特异性抗原和与通用标签相关的抗原。 在任何所提供方法的某些实施方案中,所述重组受体是或包括功能性非 TCR抗原 受体或TCR或其抗原结合片段。在任何所提供方法的一些实施方案中,所述重组受体是嵌合 抗原受体(CAR)。在任何所提供方法的特定实施方案中,所述重组受体是抗CD19 CAR。在任 何所提供方法的某些实施方案中,所述嵌合抗原受体包含含有抗原结合结构域的细胞外结 构域。 在任何所提供方法的一些实施方案中,所述抗原结合结构域是或包括抗体或其抗 体片段,所述抗体片段任选地是单链片段。在任何所提供方法的特定实施方案中,所述片段 包括通过柔性接头连接的抗体可变区。在任何所提供方法的某些实施方案中,所述片段包 括scFv。在任何所提供方法的一些实施方案中,所述嵌合抗原受体进一步包含间隔子和/或 铰链区。在任何所提供方法的特定实施方案中,所述嵌合抗原受体包含细胞内信号传导区 域。在任何所提供方法的某些实施方案中,细胞内信号传导区域包括细胞内信号传导结构 域。在任何所提供方法的一些实施方案中,所述细胞内信号传导结构域是或包括初级信号 传导结构域、能够在T细胞中诱导初级激活信号的信号传导结构域、T细胞受体(TCR)组分的 信号传导结构域和/或包含基于免疫受体酪氨酸的激活基序(ITAM)的信号传导结构域。在 任何所提供方法的特定实施方案中,所述细胞内信号传导结构域是或包括CD3链(任选地 CD3-zeta (CD3ζ)链)的细胞内信号传导结构域、或其信号传导部分。 在任何所提供方法的某些实施方案中,其中所述嵌合抗原受体进一步包含设置在 所述细胞外结构域与所述细胞内信号传导区域之间的跨膜结构域。在任何所提供方法的一 些实施方案中,所述细胞内信号传导区域进一步包括共刺激信号传导区域。在任何所提供 方法的某些实施方案中,所述共刺激信号传导区域包括T细胞共刺激分子的细胞内信号传 导结构域或其信号传导部分。在任何所提供方法的特定实施方案中,所述共刺激信号传导 区域包括 CD28、4-1BB或ICOS的细胞内信号传导结构域或其信号传导部分。在任何所提供 方法的一些实施方案中,所述共刺激信号传导区域位于跨膜结构域与细胞内信号传导区域 之间。 在任何所提供方法的某些实施方案中,所述原代T细胞包括经富集CD4 T细胞和 经富集CD8 T细胞的单独组合物,并且其中分别培育所述经富集 CD4 T细胞和经富集CD8 T 细胞的组合物。在任何所提供方法的特定实施方案中,所述原代T细胞包括经富集CD4 T细 胞和经富集CD8 T细胞的单独组合物,并且其中将所述组合物混合以便一起培育所述经富 集CD4 T细胞和经富集CD8 T细胞。 本文提供了通过本文所提供的任何方法产生的包含工程化细胞的组合物。在特定 实施方案中,所述组合物进一步包含药学上可接受的载体。在一些实施方案中,所述组合物 包含低温保护剂,任选地DMSO。 本文提供了制品,所述制品包括本文提供的任何组合物和用于将所述输出组合物 给予至受试者的说明书。在某些实施方案中,所述受试者患有疾病或病症,任选地其中所述 重组受体特异性地识别或特异性地结合至与所述疾病或病症相关或在所述疾病或病症的 细胞上表达或存在的抗原。在特定实施方案中,所述输出组合物是工程化CD4 T细胞的组合 20 CN 111615556 A 说 明 书 10/126 页 物。在一些实施方案中,所述输出组合物是CD8 T细胞的工程化组合物。在某些实施方案中, 所述输出组合物是CD4 和CD8 T细胞的工程化组合物。 本文提供了制品,所述制品包括通过本文提供的方法产生的工程化 CD4 T细胞的 组合物、通过本文提供的方法产生的工程化CD8 T细胞的组合物;和用于将所述工程化CD4 T细胞和所述工程化CD8 T细胞给予至受试者的说明书。在某些实施方案中,所述说明书规 定将所述CD4 T细胞和 CD8 T细胞分开给予至所述受试者。在某些实施方案中,所述说明书 规定将所述CD4 T细胞和所述CD8 T细胞以所需比率给予至所述受试者。本文还提供了制 品,所述制品包括通过本文提供的方法产生的工程化CD4 和CD8 T细胞的组合物;和用于 将所述工程化CD4 和CD8 T细胞给予至受试者的说明书。 本文提供了用于评估细胞组合物的长期刺激方法,所述方法包括将输入组合物在 刺激输入组合物中的细胞的CAR依赖性活性的条件下孵育至少10 天的时间段从而产生输 出组合物,所述输入组合物含有表达嵌合抗原受体 (CAR)的T细胞,所述嵌合抗原受体含有 特异性地结合或识别抗原的细胞外抗原结合结构域;并且评估输出组合物的一种或多种细 胞的一种或多种表型或活性。 在长期刺激方法的任何实施方案的一些中,刺激CAR依赖性活性的条件包括存在 与CAR的抗原结合结构域特异性地结合的结合分子。在一些实施方案中,将结合分子附接至 支持物。在一些实施方案中,支持物是固体支持物。在一些实施方案中,固体支持物是微板 的孔的表面或珠的表面。在一些实施方案中,固体支持物是微板,所述微板具有与微板附接 的结合分子,并且在微板中进行孵育。在一些实施方案中,固体支持物是已经附接有结合分 子的珠,并且在多个所述珠存在下进行孵育。 在长期刺激方法的任何实施方案的一些中,结合分子是或包含由抗原结合结构域 识别的重组抗原或其部分。在一些实施方案中,重组抗原或其部分是BCMA,或者是其由抗原 结合结构域识别的部分。在一些实施方案中,结合分子是或包括与抗原结合结构域特异性 地结合的抗独特型抗体或其抗原结合片段。在一些实施方案中,抗原受体的抗原结合结构 域是或包含抗体 SJ25C1或其抗原结合片段。在一些实施方案中,抗原受体的抗原结合结构 域是或包括抗体FMC63或其抗原结合片段。 在长期刺激方法的任何实施方案的一些中,所述方法在体外或离体进行。 在长期刺激方法的任何实施方案的一些中,在不包含重组细胞因子的培养基存在 下孵育输入组合物。在一些实施方案中,所述孵育在所述时间段中连续地进行或不中断。在 一些实施方案中,在孵育期间,不对细胞进行再铺板、不更换培养基并且不添加结合分子。 在长期刺激方法的任何实施方案的一些中,所述方法包括评估输出组合物的一种 或多种细胞的激活、消耗或分化状态的一种或多种表型。在一些实施方案中,表型是消耗, 并且所述评估包括测量选自以下的一种或多种标记的表达(任选地表面表达):CTLA-4、 FOXP3、PD-1、TIGIT、LAB-3、2B4、 BTLA、TIM3、VISTA、或CD96。在一些实施方案中,表型是激 活,并且所述评估包括测量选自以下的一种或多种标记的表达(任选地表面表达):CD25、 CD26、CD27、CD28、CD30、CD71、CD154、CD40L、CD127、LAG3、或Ki67。在一些实施方案中,表型 是分化状态,并且所述评估包括测量选自以下的一种或多种标记:(i)CD25、CD45RO、CD56、 KLRG1、CD95中的一种或多种和/或(ii)CD45RA、CD27、CD28、CD62L和CCR7中的一种或多种, 任选地其中所述一种或多种标记是与幼稚样T细胞正相关或反相关的标记。 21 CN 111615556 A 说 明 书 11/126 页 在长期刺激方法的任何实施方案的一些中,所述方法包括评估输出组合物的一种 或多种细胞的一种或多种活性。在一些实施方案中,所述一种或多种活性包括CAR依赖性活 性,任选地抗原刺激活性。在一些实施方案中,所述一种或多种活性包括细胞溶解活性或细 胞因子产生。 在长期刺激方法的一些任何实施方案中,所述时间段为至少或至少约11 天、12 天、13天、14天或15天。在一些实施方案中,所述时间段为或为约11 天、12天、13天、14天或 15天。 在长期刺激方法的任何实施方案的一些中,输入组合物含有在所述孵育之前已经 暴露于或接触测试药剂或化合物的细胞,任选地其中所述暴露或所述接触是在如下过程的 一个或多个步骤期间进行,所述过程用于产生包含表达CAR的T细胞的输入组合物。在一些 实施方案中,所述方法是对多种输入组合物进行,所述多种中的所述输入组合物中的每一 种是通过不同的过程产生的。 在长期刺激方法的任何实施方案的一些中,所述方法还包括将输出组合物的表型 或活性与对照组合物的表型或活性进行比较,任选地其中所述对照组合物是T细胞组合物, 所述T细胞已在刺激CAR依赖性活性的相同条件下被孵育至少10天,所述T细胞组合物尚未 在测试药剂或化合物存在下产生,或者已经通过与输入组合物相比的替代性过程产生。在 一些实施方案中,所述方法进一步包括鉴定展现出例如与对照组合物相比消耗减少、激活 减少或分化减少的输出组合物。在一些实施方案中,所述分化减少包括一种或多种幼稚样T 细胞标记的表达增加。 附图说明 图1A-图1D示出了显示在CD4 和CD8 T细胞中检测的磷酸化S6水平的图,所述T细 胞在各种浓度的PI-103(图1A)、化合物155(图1B)、化合物246 (图1C)或化合物63(图1D)存 在下与抗CD3和抗CD28抗体缀合的磁珠一起孵育。 图2示出了显示在仅培养基对照中、或在DMSO、PI-103或各种浓度的化合物155、化 合物63或化合物246存在下孵育之后存在的工程化CD8 (顶图) 和CD4 (底图)T细胞的初始 细胞数的百分比的图。箭头指示导致类似水平的CD8和CD4 T细胞扩增的化合物155、化合物 63和化合物246的最高耐受剂量。虚水平线指示培养基和DMSO对照的平均值的70%。 图3A-图3C示出了在生成的抗CD19 CAR-T细胞组合物之间CD8 T细胞中的细胞糖 酵解代谢的图。图3A提供了显示在通过在仅培养基、DMSO、 PI-103或化合物63存在下扩增 而生成的抗CD19 CAR-T细胞之间,CD8 CAR-T细胞的实时细胞外酸化速率(ECAR)的图。图 3B显示了相对于仅培养基对照,针对ECAR速率(mpH/min)计算的曲线下面积(AUC)。图3C 示 出了相对于仅培养基对照的最大ECAR糖酵解爆发(glycolytic burst)比率。 图4A-图4B提供了显示对抗CD19 CAR-T细胞组合物进行的测定的结果的图,所述 抗CD19 CAR-T细胞组合物通过在仅培养基、DMSO、PI-103或化合物63存在下扩增而生成。图 4A示出了在与经转导以表达CD19的经辐照 K-562细胞(经辐照K562-CD19靶细胞)和未暴露 于抗原的细胞(无刺激(no stim))共培养后,生成的抗CD19 CAR-T细胞组合物的CD8 和CD4 T细胞中磷酸-S6染色的平均荧光强度。顶图显示从单独的细胞组合物测量的单独数据点。 底图显示平均值 /-标准差。图4B提供了显示生成的CAR-T细胞组合物的细胞溶解活性的 22 CN 111615556 A 说 明 书 12/126 页 图,所述CAR-T细胞组合物与K562-CD19靶细胞以 3:1或1:1效应细胞与靶细胞的比率共培 养。将来自生成的CAR-T细胞组合物和表达CD19的K562细胞的测量提供为对照。 图5提供了显示与经辐照K562-CD19靶细胞共培养的抗CD19 CAR-T细胞组合物的 TNF-α(左图)、IFN-γ(中图)和IL-2(右图)的分泌的图。显示了与在仅培养基中扩增的细胞 相比,在来自在PI-103、化合物63或DMSO 媒介物存在下扩增的生成的抗CD19 CAR-T细胞组 合物的共培养上清液中观察到的细胞因子产生的倍数变化。 图6A和图6B示出了显示来自生成的抗CD19 CAR-T细胞组合物的CD8 (图6A)和 CD4 (图6B)T细胞的多功能细胞因子谱的图,所述抗CD19 CAR-T细胞组合物与经辐照K562- CD19靶细胞共培养并且然后进一步与PMA/离子霉素(左图)或高尔基体抑制剂(右图)一起 孵育。显示了与在仅培养基中扩增的细胞相比,在PI-103、化合物63或DMSO媒介物存在下扩 增的生成的抗CD19 CAR-T细胞组合物中,针对CD107a、IFN-γ(IFNg)、IL-2、 IL-17a和TNF- α(TNFa)的不同组合阳性染色的细胞的增加频率。 图7A-图7D示出了显示来自生成的抗CD19 CAR-T细胞组合物的T细胞的活性的图, 所述抗CD19 CAR-T细胞组合物是在重复刺激后在仅培养基、 DMSO、PI-103或化合物63存在 下扩增的。图7A示出了来自与经辐照 K562-CD19靶细胞共培养的生成的抗CD19 CAR-T细胞 组合物的T细胞的群体倍增数。在4轮再刺激之后,在第11天时在没有靶细胞的情况下再培 养T细胞。图7B显示了相对于仅培养基对照,针对群体倍增数计算的曲线下面积 (AUC)。图 7C示出了显示在用经辐照K562-CD19靶细胞进行4轮重复刺激后,在通过与经辐照K562- CD19靶细胞共培养16小时刺激后,来自生成的抗 CD19 CAR-T细胞组合物的T细胞的TNF-α (TNF)、IFN-γ(IFNg)和IL-2产生的图。示出了与仅培养基条件相比,细胞外TNF-α(TNF)、 IFN-γ(IFNg) 和IL-2的倍数变化。图7D示出了描绘在用经辐照K562-CD19靶细胞进行4轮 再刺激后,来自生成的抗CD19 CAR-T细胞组合物的CD8 T细胞的多功能细胞因子谱的图。 图8A-图8D示出了显示来自生成的抗CD19 CAR-T细胞组合物的T细胞的活性的图, 所述抗CD19 CAR-T细胞组合物是在用表面缀合有对于抗CD19 CAR具有特异性的抗独特型 抗体的珠刺激后,在仅培养基、DMSO、PI-103 或化合物63存在下扩增的。图8A示出了来自生 成的抗CD19 CAR-T细胞组合物的T细胞的每孔总活T细胞计数,所述抗CD19 CAR-T细胞组合 物是与表面缀合有抗独特型抗体的珠共培养的。图8B显示了相对于仅培养基对照,针对活T 细胞计数计算的曲线下面积(AUC)。图8C示出了显示在与表面缀合有抗独特型抗体的珠一 起孵育15天后,在通过与经辐射K562-CD19靶细胞共培养16小时刺激后,来自生成的抗CD19 CAR-T细胞组合物的T细胞的TNF-α (TNF)、IFN-γ(IFNg)和IL-2产生的图。示出了与仅培养 基条件相比,细胞外TNF-α(TNF)、IFN-γ(IFNg)和IL-2的倍数变化。图8D示出了描绘在与缀 合有抗独特型抗体的珠一起孵育15天后,来自生成的抗CD19 CAR-T细胞组合物的CD8 T细 胞的多功能细胞因子谱的图。 图9A-图9C示出了显示来自生成的抗CD19 CAR-T细胞组合物的CD4 和CD8 T细胞 的RNA-Seq分析的结果的图,所述抗CD19 CAR-T细胞组合物是在仅培养基、DMSO、PI-103或 化合物63存在下扩增的。图9A示出了描绘来自生成的抗CD19 CAR-T细胞组合物的CD4 (左 图)、CD8 (中图)和组合的CD4 和CD8 (右图)T细胞的差异表达的基因表达的火山图。示出 了与仅用DMSO扩增的T细胞相比,在仅培养基(顶行)、PI-103(中行)和化合物63(底行)中扩 增的T细胞的差异基因表达。图9B示出了描绘相对于来自在DMSO存在下扩增的生成的抗 23 CN 111615556 A 说 明 书 13/126 页 CD19 CAR-T细胞组合物的T细胞中的表达,在来自在PI-103(X轴)和化合物63(Y-轴)存在下 扩增的生成的抗CD19 CAR-T细胞组合物的T细胞中测量的差异表达基因的log2倍数变化 (Log2FC) 的图。图9C示出了描绘示例性鉴定的基因本体论(GO)类别及其相应的Z 得分的 表和图。 图10A和图10B示出了显示在用抗CD19 CAR-T细胞治疗后携带肿瘤的小鼠中的肿 瘤负荷和存活率的图。图10A示出了显示在用抗CD19 CAR-T细胞治疗后携带肿瘤的小鼠至 第80天的肿瘤负荷和存活率的图。图10B示出了显示在用抗CD19 CAR-T细胞治疗后携带肿 瘤的小鼠至第100天的存活率的图。向Nod scidγ(NSG)免疫缺陷小鼠植入表达萤火虫萤光 素酶的Raji细胞,并且所述小鼠未接受治疗,或者接受用高剂量(左图)或低剂量(右图)的 在DMSO或PI-103存在下扩增的抗CD19 CAR-T细胞的治疗。如图10A和图 10B中所示,在所指 示的时间示出如通过生物发光测量的单独小鼠的肿瘤负荷(顶图)和治疗组的存活曲线(底 图)。 图11A和图11B示出了显示在用抗CD19 CAR-T细胞治疗后携带肿瘤的小鼠的肿瘤 负荷和存活率的图。图11A示出了显示在用抗CD19 CAR-T细胞治疗后携带肿瘤的小鼠至第 80天的肿瘤负荷和存活率的图。图10B示出了显示在用抗CD19 CAR-T细胞治疗后携带肿瘤 的小鼠至第100天的存活率的图。向NSG免疫缺陷小鼠植入表达萤火虫萤光素酶的Raji细 胞,并且所述小鼠未接受治疗,或者接受用高剂量(左图)或低剂量(右图)的在DMSO或化合 物63存在下扩增的抗CD19 CAR-T细胞的治疗。如图11A和图11B中所示,在所指示的时间示 出如通过生物发光测量的单独小鼠的肿瘤负荷(顶图)和治疗组的存活曲线(底图)。 图12A和图12B呈现了显示含有抗CD19 CAR T细胞的T细胞组合物的活性的图。将 细胞与抗CD19抗体抗ID缀合的珠一起孵育14天(第14天;次级),或者在评估活性之前不孵 育。示出了在暴露于表达CD19的细胞后的细胞毒性测定(图12A)和内部细胞因子染色(ICS) 测定(图12B)的结果。 图13A-图13C呈现了显示在与抗CD19抗体抗ID缀合的珠一起孵育14天期间或之后 含有抗CD19 CAR T细胞的T细胞组合物的特征的图。示出了在 PI-103、化合物63或媒介物 存在下生成的T细胞组合物的结果。图13A和图13B 示出了未孵育(初级)或孵育14天(次级) 的T细胞组合物响应于暴露于CD19 细胞的活性。示出了在暴露于表达CD19的细胞后通过 ICS进行的多功能染色 (polyfunctional staining)(图13A)和细胞溶解活性(图13B)的结 果。图13C 描绘了从含有抗CD19 CAR表达细胞的细胞组合物的上清液中分泌的细胞因子的 水平,所述抗CD19 CAR表达细胞与表达CD19的细胞以1:1的比率孵育 20小时。测量了IL2、 TNF和IFN-γ的量,并且示出了所有三种细胞因子的量表得分的平均值。 图14描绘了在DMSO或化合物63存在下制备的解冻的CAR-T细胞上促凋亡细胞内半 胱天冬酶3的表达。FACS绘图示出了由三种不同供体制备的活的CD3 CAR T细胞。 图15呈现了显示在DMSO、PI103或化合物63存在下制备的CAR-T细胞的随时间推移 的活细胞数的图。符号表示来自三名单独供体的培养孔的平均值和SEM。 图16呈现了显示在DMSO、PI103或化合物63存在下制备的解冻的CAR-T 细胞的靶 细胞杀伤的图。在解冻后(第0天)立即建立杀伤测定,或在图15 中所述的CAR刺激培养结束 时(第14天)建立杀伤测定。符号表示来自三名单独供体的培养孔的平均值和SEM。 图17A-图17B呈现了显示在PI103或化合物63存在下制备的CAR-T细胞具有改善和 24 CN 111615556 A 说 明 书 14/126 页 持续的效应细胞因子谱的图。在解冻后立即将CAR-T细胞与携带抗原的靶细胞1:1(CAR-T: 靶标)混合(“初级”,顶图),或在图15中所述的CAR刺激培养结束时进行所述混合(“次级”, 底图)。通过来自在高尔基体抑制剂存在下与靶标一起孵育5小时的CAR-T细胞的FACS,依据 细胞因子IL2、TNF和IFNg的细胞内表达来评估T细胞多功能性(图17A)。还测量了来自与靶 标一起孵育20小时的CAR-T细胞的培养上清液中的细胞因子分泌(图 17B)。在每个供体群 组内通过特征缩放对测定值进行归一化和等级评分。 图18呈现了对如图15中所述在PI103或化合物63存在下生成的经富集CD8 和CD4 CAR-T细胞进行的RNAseq的差异表达(DESeq2)分析的结果。选择对于PI103相对于DMSO或化 合物63相对于DMSO具有经调整p值(p-adj) <0.1的差异基因表达,并且示出了log2倍数变 化基因表达值。以正方形示出了仅在PI103处理的细胞中显著差异表达的基因。以圆圈示出 了仅在化合物 63处理的细胞中显著差异表达的基因。以菱形示出了在两种T细胞组合物中 表达的基因。差异表达值是每组的三名单独供体的平均值。 图19A-图19B示出了显示在用抗CD19 CAR-T细胞治疗后携带肿瘤的小鼠中的肿瘤 负荷和存活率的图。图19A示出了显示在用高剂量(1x 106个 CAR-T细胞/小鼠)或低剂量 (2.5x 105个CAR-T细胞/小鼠)的抗CD19 CAR-T 细胞治疗后小鼠中的肿瘤负荷的图。图19B 示出了显示在用高剂量或低剂量的抗CD19 CAR-T细胞治疗后携带肿瘤的小鼠的存活率的 图。 图20A-图20B示出了显示在用抗CD19 CAR-T细胞治疗后携带肿瘤的小鼠中的肿瘤 负荷和存活率的图。图20A示出了显示在用高剂量(1x 106个 CAR-T细胞/小鼠)或低剂量 (2.5x 105个CAR-T细胞/小鼠)的抗CD19 CAR-T 细胞治疗后小鼠中的肿瘤负荷的图。图20B 示出了显示在用高剂量或低剂量的抗CD19 CAR-T细胞治疗后携带肿瘤的小鼠的存活率的 图。 图21A-图21B示出了展示在接受者小鼠的血液中抗CD19 CAR-T细胞随时间的持久 性的图。图21A示出了在接受高剂量(1x 106个CAR-T细胞/小鼠) 的在DMSO(D)、化合物63 (C)或PI103(P)存在下制备的CAR-T细胞的小鼠中,在注射后第18天、第25天和第36天的CD4 和CD8 T细胞计数。图 21B示出了在接受低剂量(2.5x 105个CAR-T细胞/小鼠)的在DMSO (D)、化合物63(C)或PI103(P)存在下制备的CAR-T细胞的小鼠中,在注射后第18天、第25天 和第36天的CD4 和CD8 T细胞计数。












