技术摘要:
本发明公开了一种抗VSIG4单克隆抗体,根据VSIG4抗原表位特异性分析,合成VSIG4特异性多肽,将VSIG4特异性多肽与KLH偶连后作为抗原免疫BALB/c小鼠,取免疫后BALB/c小鼠的脾细胞与小鼠骨髓瘤细胞Sp2/0融合,筛选获得分泌抗VSIG4单克隆抗体的杂交瘤细胞,抗VSIG4单克隆抗 全部
背景技术:
甲状腺癌是最常见的内分泌系统恶性肿瘤,也是近20年来发病率增长最快的人类 恶性肿瘤之一。2018年世界范围甲状腺癌新发病例近56.7万例,其中中国约19.4万例,已成 为我国多个地区女性第一高发恶性肿瘤,严重威胁我国居民的健康[1]。甲状腺癌分多种类 型,其中,绝大多数是乳头状甲状腺癌,占了80%-90%,剩下10%-20%里包括滤泡癌、髓样癌、 低分化癌、未分化癌等。除了甲状腺乳头状癌,其它几种类型的甲状腺癌预后差,尤其是甲 状腺未分化癌(Anaplastic Thyroid Carcinoma , ATC),堪称人类最恶性的肿瘤之一。ATC 患者的中位生存期不足6个月,1年生存率约17%,而5年生存率仅8%。2018年全国ATC新发病 例近4000例,新增死亡病例约3440例,占甲状腺癌死亡总数的40%。ATC进展迅速,手术、外放 射、碘131 、药物治疗疗效均极其有限,患者常死于局部肿瘤扩张引起的窒息或肿瘤远处转 移[2-3]。因此,目前亟需寻找有效的治疗新靶点,以期突破该类患者的治疗瓶颈。 肿瘤相关巨噬细胞(Tumor Associated Macrophage, TAM)是肿瘤间质中数量最 多的炎症细胞群,可促进肿瘤增殖、侵袭、转移及血管新生,尤其是肿瘤免疫逃逸[4]。研究 表明,甲状腺癌中TAM的数量与生存期负相关,是甲状腺癌预后不利因素[5]。Caillou等发 现在ATC组织中,TAM数量约占肿瘤组织细胞总量57%,且相互联系形成网状结构[6],这种病 理结构为ATC细胞提供极佳的“免疫豁免区”。生理免疫状态下,巨噬细胞识别抗原后首先将 表面抗原肽-MHC分子复合物呈递给T细胞识别,并通过表达协同刺激信号B7分子与T细胞表 面CD28结合活化T细胞,进而介导免疫应答。然而在肿瘤微环境中,TAM表型及功能受肿瘤细 胞严密调控,TAM大量表达负性共刺激分子与PD-1、CTLA-4等免疫检查点蛋白,抑制T细胞抗 肿瘤免疫应答,促使肿瘤发生免疫逃逸[7]。与正常细胞相比,ATC细胞作为一种截然不同的 “非己”成分,理论上会被宿主免疫系统识别并清除,然而,ATC细胞的生长却无法被免疫系 统限制,因此,寻找肿瘤免疫逃逸机制并解除免疫抑制是治疗ATC的潜在策略。 随着近几年免疫检查点抑制剂在实体瘤治疗中的成功,免疫疗法为恶性肿瘤的治 疗带来新思路。已有个案报道对存在BRAF突变及PD-L1高表达的ATC患者通过维罗非尼联合 纳武单抗进行治疗,可使患者肿瘤明显消退,且可持续20个月[8]。该研究提示免疫疗法在 ATC治疗中的潜力,但值得注意的是,Ahn等通过407例甲状腺癌组织进行PD-L1免疫组化染 色,发现ATC组织中肿瘤细胞和免疫细胞PD-L1表达阳性率仅为22.2%和11.1% [9],提示该 方案并不适合于多数ATC患者的治疗。 VSIG4与PD-L1,PD-L2同属于B7家族,可抑制T细胞功能或补体旁路途径的活化,从 而调节自身免疫疾病及炎症疾病的发展[10-11]。Hepatology的研究表明,枯否细胞表达 VSIG4可对抗T细胞及NK细胞引起的自身免疫肝损伤[12]。最新的研究发现,VSIG4可抑制杀 伤型巨噬细胞(M1)极化,改善爆发性肝炎及高脂饮食引起的肥胖[13]。流行病学结果显示, VSIG4强表达是恶性胶质瘤、非小细胞肺癌等肿瘤的预后不利因素[14-15]。然而,VSIG4如 3 CN 111574627 A 说 明 书 2/7 页 何促进肿瘤的发生发展研究甚少,目前仅有研究指出VSIG4阳性TAM可促进肺癌的发展 [15]。 1 . Bray F, Ferlay J , Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394- 424. 2 . Fahiminiya S , de Kock L , Foulkes WD . Biologic and Clinical Perspectives on Thyroid Cancer. N. Engl. J. Med. 2016; 375(23) . 3. Wiseman SM, Masoudi H, Niblock P, Turbin D, Rajput A, Hay J, Bugis S, Filipenko D, Huntsman D, Gilks B. Anaplastic thyroid carcinoma: expression profile of targets for therapy offers new insights for disease treatment. Ann Surg Oncol. 2007; 14(2):719-29. 4 . Rivera LB , Bergers G . Location , location , location: macrophage positioning within tumors determines pro- or antitumor activity. Cancer Cell. 2013; 24(6):687-9. 5. Ryder M, Ghossein RA, Ricarte-Filho JC, Knauf JA, Fagin JA. Increased density of tumor-associated macrophages is associated with decreased survival in advanced thyroid cancer. Endocr-Relat Cancer. 2008; 15(4) . 6. Caillou B, Talbot M, Weyemi U, Pioche-Durieu C, Al Ghuzlan A, Bidart JM, Chouaib S, Schlumberger M, Dupuy C. Tumor-associated macrophages (TAMs) form an interconnected cellular supportive network in anaplastic thyroid carcinoma. PLoS One. 2011; 6(7):e22567. 7. Joyce JA, Fearon DT. T cell exclusion, immune privilege, and the tumor microenvironment. Science. 2015, 348(6230):74-80. 8. Kollipara R, Schneider B, Radovich M, et al. Exceptional Response with Immunotherapy in a Patient with Anaplastic Thyroid Cancer[J] . Oncologist , 2017, 22(10):1149-1151 9. Ahn S , Kim T H , Kim S W , et al. Comprehensive screening for PD-L1 expression in thyroid cancer[J]. Endocr-Relat Cancer, 2017, 24(2):97-106. 10. Katschke KJ Jr, Helmy KY, Steffek M, Xi H, Yin J, Lee WP, Gribling P, Barck KH, Carano RA, Taylor RE, Rangell L, Diehl L, Hass PE, Wiesmann C, van Lookeren Campagne M . A novel inhibitor of the alternative pathway of complement reverses inflammation and bone destruction in experimental arthritis. J Exp Med. 2007; 204(6):1319-25. 11 . Jung K , Seo SK , Choi I . Endogenous VSIG4 negatively regulates the helper T cell-mediated antibody response. Immunol Lett. 2015; 165(2):78-83. 12. Jung K, Kang M, Park C, Hyun Choi Y, Jeon Y, Park SH, Seo SK, Jin D, Choi I . Protective role of V-set and immunoglobulin domain-containing 4 expressed on kupffer cells during immune-mediated liver injury by inducing 4 CN 111574627 A 说 明 书 3/7 页 tolerance of liver T- and natural killer T-cells . Hepatology . 2012; 56(5): 1838-48. 13. Li J, Diao B, Guo S, Huang X, Yang C, Feng Z, Yan W, Ning Q, Zheng L, Chen Y , Wu Y . VSIG4 inhibits proinflammatory macrophage activation by reprogramming mitochondrial pyruvate metabolism. Nat Commun. 2017; 8(1) . 14. Xu T, Jiang Y, Yan Y, Wang H, Lu C, Xu H, Li W, Fu D, Lu Y, Chen J. VSIG4 is highly expressed and correlated with poor prognosis of high-grade glioma patients. Am J Transl Res. 2015; 7(6):1172-80. 15 . Liao Y , Guo S , Chen Y , Cao D , Xu H , Yang C , Fei L , Ni B , Ruan Z . VSIG4 expression on macrophages facilitates lung cancer development . Lab Invest. 2014; 94(7):706-15。
技术实现要素:
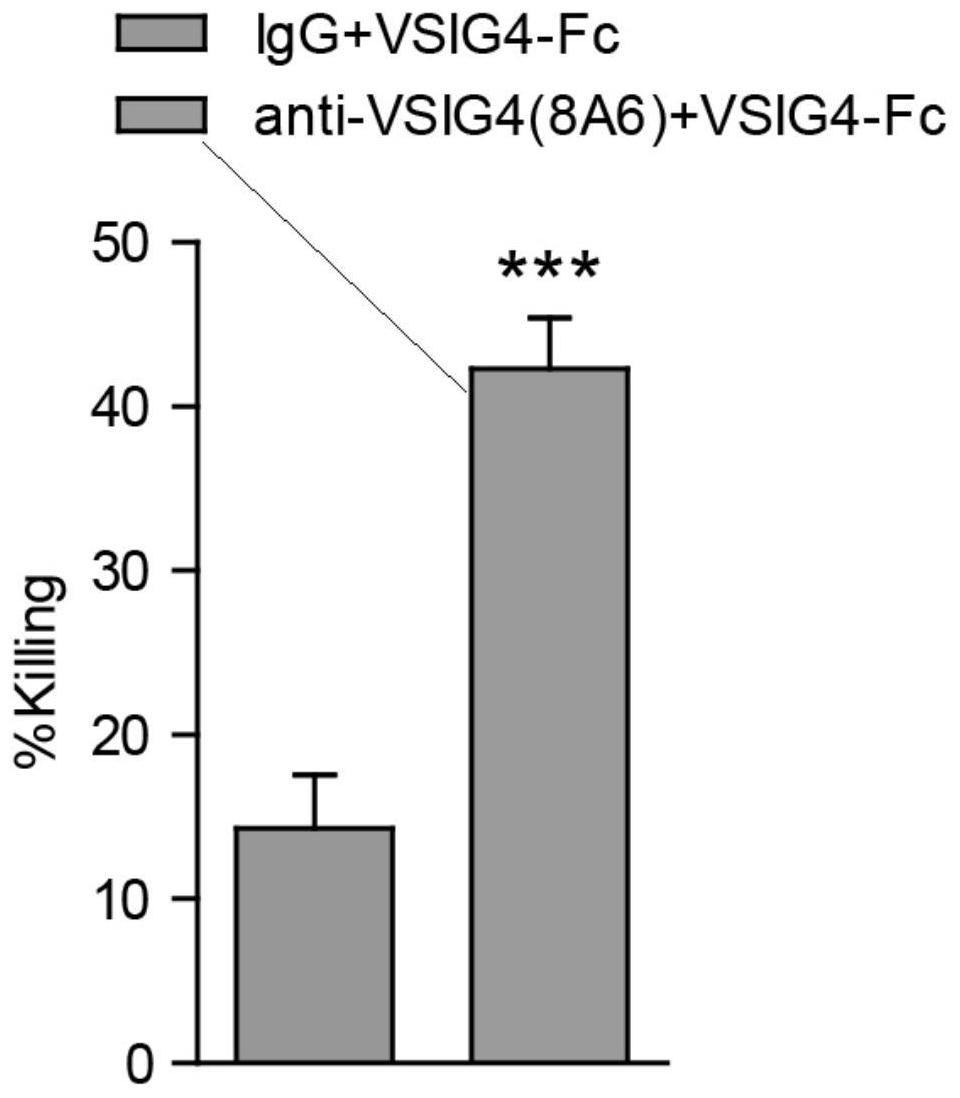
本发明的目的在于提供一种抗VSIG4单克隆抗体及其用途,可为ATC患者提供安 全、有效的治疗策略,进而改变该类患者无有效治疗手段的困境。 本发明解决其技术问题所采用的技术方案是: 一种抗VSIG4单克隆抗体,根据VSIG4抗原表位特异性分析,合成VSIG4特异性多肽,将 VSIG4特异性多肽与KLH偶连后作为抗原免疫BALB/c小鼠,取免疫后BALB/c小鼠的脾细胞与 小鼠骨髓瘤细胞Sp2/0融合,筛选获得分泌抗VSIG4单克隆抗体的杂交瘤细胞,抗VSIG4单克 隆抗体的杂交瘤细胞采用动物体内生产法或体外培养法生产获得抗VSIG4单克隆抗体。 申请人发现,与正常甲状腺组织及乳头状甲状腺癌(Papillary Thyroid Carcinoma , PTC)相比,PD-L1及CTLA4的平均表达水平在ATC患者组织中上调并不显著,提 示除PD-L1/PD1外,还存在其他肿瘤免疫逃逸机制。因此筛选ATC特异免疫检查点并设计相 应靶向抗体有望成为其治疗的重要策略。申请人前期通过基因芯片筛选发现免疫抑制蛋白 VSIG4在ATC中表达较PTC及正常组织显著上调,且VSIG4阳性TAM大量聚集于ATC组织,提示 其可能是促ATC免疫逃逸的关键细胞亚群。VSIG4 (V-set and Ig domain-containing 4) 又称为免疫球蛋白超家族-39 (Ig superfamily protein 39, Z39Ig),主要表达于巨噬细 胞,具有很强的免疫抑制作用。 申请人通过杂交瘤技术筛选制备了靶向VSIG4的单克隆抗体,用以阻断VSIG4与T 细胞的结合。动物实验结果显示,抗VSIG4单克隆抗体可显著抑制ATC肿瘤生长,并且其抗肿 瘤效果优于Atezolizumab(靶向阻断PD-L1)。此外,研究发现抗VSIG4单克隆抗体亦可显著 抑制胰腺癌细胞株Panc02小鼠皮下荷瘤后的肿瘤生长,提示不仅在ATC中靶向VSIG4具有很 强的抗肿瘤活性,抗VSIG4单克隆抗体还具有抑制其他肿瘤的生长的潜力。 本发明筛选ATC特异表达免疫抑制蛋白VSIG4,并针对该靶点设计了靶向阻断单克 隆抗体,确定了其抗肿瘤活性。 所述VSIG4特异性多肽的序列为:VRKYNPPRINTEAP。 VSIG4特异性肽段与KLH偶连的具体操作为:将KLH与交联剂SMCC混合,室温旋转反 应,使KLH充分活化,将VSIG4特异性多肽加入已活化的KLH中室温旋转反应,然后将偶连产 物加入到PBS中形成抗原。优选的,将1mg KLH与500 ul浓度1mg/mL交联剂SMCC混合,室温旋 5 CN 111574627 A 说 明 书 4/7 页 转反应30 min,使KLH充分活化,将1mg多肽加入1ml已活化的KLH中室温旋转反应2 h,然后 将偶连产物加入到10mM pH7.4的PBS中,形成最终的偶连产物浓度为1mg/ml的抗原。 抗原免疫BALB/c小鼠进行三次免疫,且在BALB/c小鼠的脾细胞与小鼠骨髓瘤细胞 Sp2/0融合前3天对BALB/c小鼠进行一次加强免疫。 一种抗VSIG4单克隆抗体作为制备治疗甲状腺癌药物的应用。 所述甲状腺癌为甲状腺未分化癌。 一种抗VSIG4单克隆抗体作为制备治疗胰腺癌药物的应用。 本发明的有益效果是:获取了VSIG4特异结合且具有抗肿瘤活性的单克隆抗体,适 用于甲状腺未分化癌及胰腺癌等癌症的治疗。 附图说明 图1是本发明抗VSIG4单克隆抗体的制备流程图。 图2是抗VSIG4单克隆抗体的效价及亲和力分析。 (A)抗VSIG4单克隆抗体的效价 分析;(B)表面等离子体共振实验考察VSIG4单克隆抗体与VSIG4的亲和力。 图3是抗VSIG4单克隆抗体生物学功能分析。(A)抗VSIG4单克隆抗体可逆转VSIG4 重组蛋白对T细胞增殖抑制作用。(B)抗VSIG4单克隆抗体可逆转VSIG4重组蛋白对T细胞IL2 分泌的抑制作用。(C)抗VSIG4单克隆抗体可逆转VSIG4重组蛋白对T细胞IFNγ分泌的抑制 作用。**P<0.01,***P<0.001。 图4是抗VSIG4单克隆抗体具有显著体外抗肿瘤活性。LDH检测试剂盒考察T细胞的 肿瘤杀伤作用。抗VSIG4单克隆抗体可恢复CD8阳性T细胞的细胞杀伤作用,效应T细胞与 8505C比例为3:1。***P<0.001。 图5是抗VSIG4单克隆抗体体内抗肿瘤效应研究。(A) 肿瘤免疫双人源化小鼠模型 考察抗VSIG4单克隆抗体(10 mg/kg)及Atezolizumab(抗PD-L1单克隆抗体)(10 mg/kg)对 ATC细胞株8505C肿瘤生长的影响,anti-VSIG4 vs IgG1 *P<0.05,**P<0.01,***P<0.001; anti-VSIG4 vs anti-PD-L1 # P<0.05,## P<0.01,### P<0.001;(B) C57BL/6小鼠皮下荷 瘤模型考察抗VSIG4单克隆抗体(10 mg/kg)对胰腺癌细胞株Panc02肿瘤生长的影响,anti- VSIG4 vs PBS *P<0.05,**P<0.01,***P<0.001。 图6甲状腺未分化癌免疫调节相关蛋白的表达谱差异。(A-B)基因芯片GSE33630及 GSE29265中28个免疫调节相关蛋白在ATC、PTC及正常甲状腺组织中的表达水平。 图7 VSIG4阳性TAM可能介导ATC免疫逃逸。(A) 蛋白质组学分析VSIG4在不同病理 组织中的离子信号强度;(B) RT-PCR检测VSIG4在不同病理组织中的表达;(C) 免疫组化染 色检测VSIG4在不同甲状腺癌组织中的表达;(D-E) 基于GEO数据库基因芯片分析VSIG4在 PTC、ATC及正常组织中的表达水平;(F) 免疫荧光染色检测VSIG4(绿)/CD68(红)在不同甲 状腺癌组织中的表达。












