技术摘要:
本发明提供一种基于CRISPR/Cas9重编程ITNK细胞的方法,所述方法通过电转化将RNP复合物转入激活的T细胞中,得到所述ITNK细胞。所述方法将RNP复合物通过电转的方法转入T细胞中,使其分化成为ITNK细胞,所述方法能够提高体外重编程效率,且得到ITNK细胞具有较好的体外扩增 全部
背景技术:
CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats,规律 成簇间隔短回文重复系统),CRISPR/Cas是一种具有核酸内切酶活性的复合体,其中Cas是 CRISPR相关的蛋白质。CRISPR/Cas能够识别特定的DNA序列,进行特定位点切割造成双链 DNA断裂(Double-strand breaks,DSB),在没有模板的条件下,发生非同源重组末端连接 (Non-homologous end joining,NHEJ) ,造成移码突变(frameshift mutation),导致基因 敲除。 CRISPR/Cas系统是一种原本存在于自然界原核生物中的免疫防御系统,用来抵抗 噬菌体或者病毒等外来遗传物质的入侵。它为细菌提供了获得性免疫(类似于哺乳动物的 二次免疫),当细菌遭受病毒入侵时,会产生相应的“记忆”。当病毒二次入侵时,CRISPR/Cas 系统可以识别出外源DNA,并将它们切断,使外源基因的表达沉默,从而达到抵抗病毒干扰 的目的。 由于CRISPR/Cas系统精确的靶向功能,CRISPR/Cas系统被开发成一种高效的基因 编辑工具。在CRISPR/Cas系统中,CRISPR/Cas9系统是研究最深入,应用最成熟的一种。其 中,Cas9靶向切割DNA是通过两种小RNA:crRNA(CRISPR RNA)和tracrRNA(trans- activating crRNA)和靶序列互补识别的原理实现的。目前,已经能够将这两种小RNA融合 成一条RNA链,简称sgRNA(single guide RNA)。不过,尽管这种技术已经成功应用于多种细 胞系,它对原代细胞的编辑效率却非常低,严重限制了CRISPR技术在原代细胞上的应用。 T细胞是适应性免疫系统中非常重要的调节和效应细胞,近年来基于T细胞的免疫 治疗技术受到了越来越多的关注。同时,人们也在不断尝试对T细胞进行基因编辑以研究其 激活分化机制或者增强其抗肿瘤功能。Li等人在2010年首次提出且成功将小鼠T细胞重编 程成NK样细胞(induced T-to-natural killer cells,ITNK细胞)(具体参见Li ,P .et al .Reprogramming of T cells to natural killer-like cells upon Bcl11b deletion.Science 329,85-89(2010) .),并于近年采用CRISPR/Cas9技术成功地将人T细胞 重编程成为ITNK细胞。 为进一步提高重编程效率,有研究者尝试将Cas9和gRNA通过病毒载体或者电转的 方式对原代T细胞进行基因编辑,但是打靶效率非常低,而且直接电转DNA会对T细胞造成较 高毒性。还有研究者尝试电转Cas9和体外转录或合成的单链gRNA的复合物来提高对原代T 细胞的编辑效率(参见Rutz ,S .&Seki ,A .Optimized RNP transfection for highly efficient CRISPR/Cas9-mediated gene knockout in primary T cells .Journal of Experimental Medicine 215,985-997(2018) .)。但是,使用CRISPR/CAS9技术重编程ITNK 细胞仍然面临效率低且毒性大等问题。 3 CN 111607569 A 说 明 书 2/6 页 因此,如何进一步提高重编程效率、降低对细胞的毒性,同时提高重编程后细胞的 功能,得到打靶效率较高且能有效识别和杀伤肿瘤细胞的重编程ITNK细胞,是本领域急需 解决的问题。
技术实现要素:
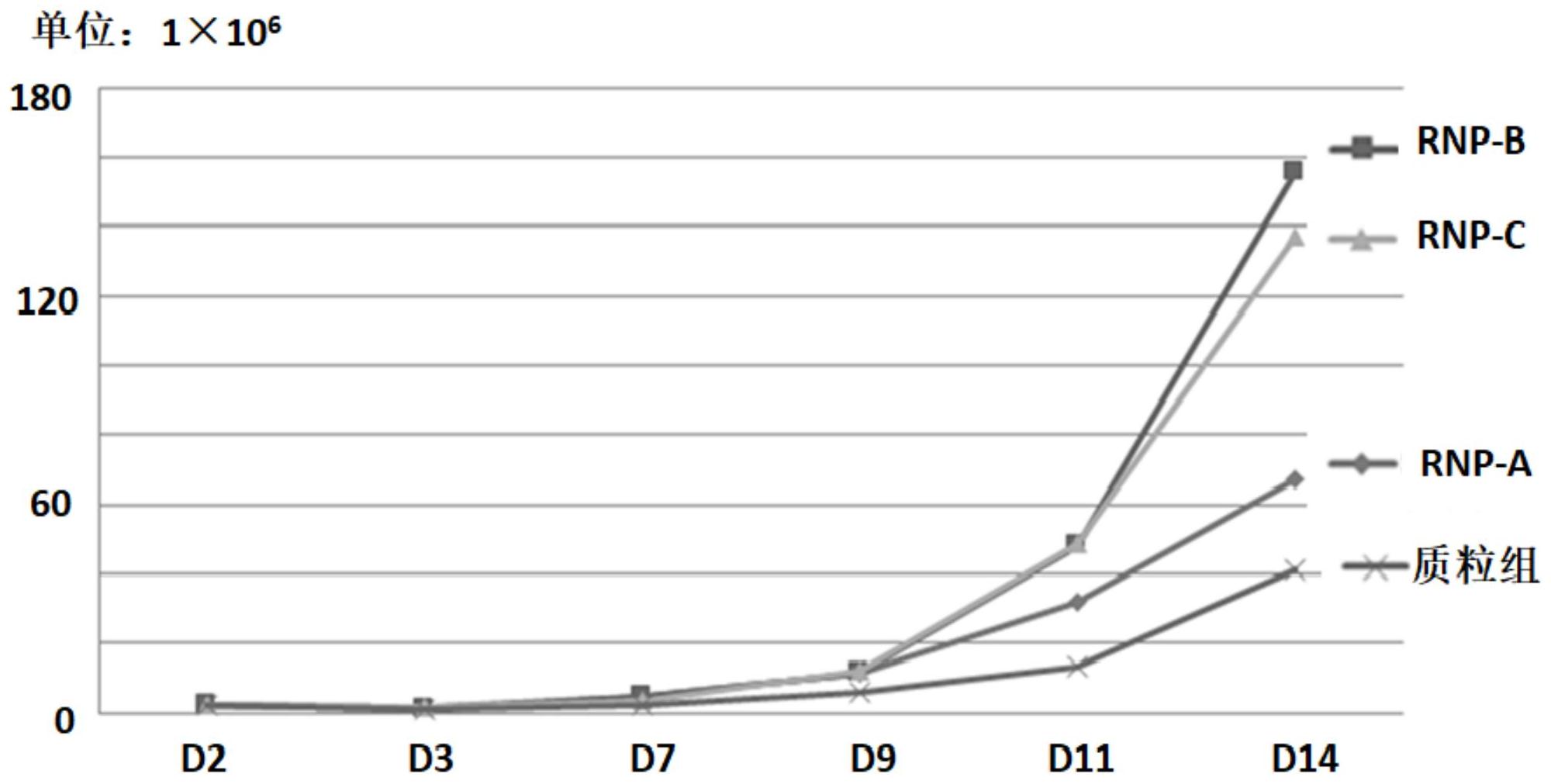
鉴于现有技术中存在的问题,本发明提供一种基于CRISPR/Cas9重编程ITNK细胞 的方法,该方法操作步骤较为简单,重编程效率较高,且能够获得扩增能力较好、杀伤肿瘤 细胞效率高的重编程ITNK细胞。 为达此目的,本发明采用以下技术方案: 第一方面,基于CRISPR/Cas9重编程ITNK细胞的方法,所述方法通过电转化将RNP 复合物转入激活的T细胞中,得到所述ITNK细胞;所述RNP复合物包括crRNA、tracrRNA和 Cas9蛋白。 本发明中,采用电转化的方式将RNP复合物转入T细胞当中,所述T细胞为原代T细 胞,通过此方法可以实现对原代T细胞的基因编辑,将其转化成NK样细胞,即ITNK细胞,且该 方法重编程效率较高;同时,通过该方法制备得到的ITNK细胞的体外扩增能力较强,对肿瘤 细胞的杀伤能力也较好。 本发明中,所述crRNA表示CRISPR RNA,tracrRNA表示trans-activating crRNA, crRNA和tracrRNA结合能够实现Cas9的靶向切割。 作为本发明优选的技术方案,所述RNP复合物中crRNA和tracrRNA的总摩尔量与 Cas9蛋白的摩尔量比为1:(1~5),例如可以是1:1、1:1.5、1:2、1:2.5、1:3、1:3.5、1:4、1: 4.5或1:5等。 优选地,所述RNP复合物中crRNA和tracrRNA的摩尔量比为1:(0.8-1.2),例如可以 是1:0.8、1:0.85、1:0.9、1:0.95、1:1、1:1.15或1:1.2等。 优选地,所述crRNA的靶基因包括Bcl11b基因。本发明中将原代T细胞中的Bcl11b 基因敲除,可以诱导原代T细胞分化为具有NK样细胞活性,称为ITNK细胞。 为了更加直观地凸显出电转RNP复合物的重编辑效率,重编辑后细胞的扩增能力 与杀伤能力,本发明以含有cas9蛋白和敲除Bcl11b gRNA的PX458质粒(记为PX458- gBCL11b)为阳性对照组与电转RNP复合物的实验组进行了比较,实验中为了提高基因编辑 的成功率,使用了多种不同的sg-RNA的序列,其中,所使用的sg-RNA的序列包括SEQ ID NO.1~6: sgRNA1:gaccctgacctgctcacctg(SEQ ID NO.1) sgRNA2:gaccatgaactgctcacttg(SEQ ID NO.2) sgRNA3:gaagcagtgtggcggcagct(SEQ ID NO.3) sgRNA4:gaagcattgtggcttcagct(SEQ ID NO.4) sgRNA5:ggtcagacggaggctccctt(SEQ ID NO.5) sgRNA6:ggtcatccggaggctcgatt(SEQ ID NO.6)。 通过mMESSAGE mMACHINETM T7 Transcription Kit试剂盒体外获得靶向基因的 gRNA的mRNA产品。与直接电转质粒PX458-gBCL11b得到ITNK细胞相比,本发明提供的重编程 方法的效率较高,重编辑后细胞的扩增能力与杀伤能力都较好。 4 CN 111607569 A 说 明 书 3/6 页 优选地,所述RNP复合物的摩尔浓度为40~120μM,例如可以是40μM、50μM、60μM、70 μM、80μM、90μM、100μM、110μM或120μM等。 优选地,电转时所述RNP复合物与细胞的使用量比例为(2~100)μL:106个细胞,例 如可以是2μL:106个、5μL:106个、10μL:106个、15μL:106个、20μL:106个、25μL:106个、30μL: 106个、50μL:106个、60μL:106个、70μL:106个、80μL:106个、90μL:106个或100μL:106个等。 作为本发明优选的技术方案,所述crRNA的核苷酸序列为25~35bp,例如可以是 25bp、26bp、27bp、28bp、29bp、30bp、31bp、32bp、33bp、34bp或35bp等。 优选地,所述crRNA的核苷酸序列如SEQ ID NO.7~12所示。 crRNA1:gaccctgacctgctcacctggttttagagcta(SEQ ID NO.7) crRNA2:gaccatgaactgctcacttggttttagagcta(SEQ ID NO.8) crRNA3:gaagcagtgtggcggcagctgttttagagcta(SEQ ID NO.9) crRNA4:gaagcattgtggcttcagctgttttagagcta(SEQ ID NO.10) crRNA5:ggtcagacggaggctcccttgttttagagcta(SEQ ID NO.11) crRNA6:ggtcatccggaggctcgattgttttagagcta(SEQ ID NO.12) 作为本发明优选的技术方案,所述tracrRNA的核苷酸序列为50~60bp,例如可以 是50bp、51bp、52bp、53bp、54bp、55bp、56bp、57bp、58bp、59bp或60bp等。 优选地,所述tracrRNA的核苷酸序列可以是如SEQ ID NO.13和14所示的核苷酸序 列。 tracrRNA1:tagcaagttaaaataaggctagtcatttatcacattgaaaatctggcaccgagtcggtg (SEQ ID NO.13) tracrRNA2:tagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtg (SEQ ID NO.14)。 作为本发明优选的技术方案,所述电转化的电压为1.5~2.5kV,时间为3~5ms。 优选地,所述电转化结束后,所得细胞悬液置于完全培养基中培养。 优选地,所述完全培养基包括T551-H3完全培养基,所述T551-H3完全培养基中含 有质量分数为3~8%自体血清(例如可以是4%、5%、6%或7%等),所述自体血清为T细胞 来源中的血清,所述T551-H3完全培养基中还包括400~800IU/mL(例如可以是500IU/mL、 600IU/mL、700IU/mL或750IU/mL等)hIL-2以及10~30μg/mL(例如可以是15μg/mL、20μg/mL、 25μg/mL或28μg/mL等)的硫酸庆大霉素。 作为本发明优选的技术方案,所述T细胞采用Ficoll密度梯度离心法进行分离。优 选地,所述T细胞采用磁珠分选方法进行分选。 本发明中所述Ficoll密度梯度离心法与磁珠分选方法均为本领域常用的实验方 法。 作为本发明优选的技术方案,所述方法包括如下步骤: (1)将crRNA、tracrRNA和Cas9蛋白制成RNP复合物,所述RNP复合物中crRNA和 tracrRNA的总摩尔量与Cas9蛋白的摩尔量比为1:(1~5),所述RNP复合物中crRNA和 tracrRNA的摩尔量比为1:(0.8-1.2),所述crRNA的核苷酸序列如SEQ ID NO.7~12所示,所 述tracrRNA的核苷酸序列如SEQ ID NO.13~14所示,所述crRNA的靶基因为Bcl11b基因; (2)采用Ficoll密度梯度离心法分离外周血得到外周血单个核细胞,采用磁珠分 5 CN 111607569 A 说 明 书 4/6 页 选方法进行分选得到T细胞,并激活所述T细胞;所述激活时可以采用MACS激活试剂盒激活T 细胞24~48小时,再洗脱激活磁珠,得到激活的T细胞备用; (3)通过电转化的方法将步骤(1)所述的RNP复合物电转入步骤(2)所述激活的T细 胞中,之后再转入完全培养基中培养,培养18~24小时后,更换新鲜的完全培养基,培养一 段时间后能够得到所述ITNK细胞。 第二方面,如第一方面所述的方法制备得到的ITNK细胞。 利用第一方面所述的电转化方法得到的ITNK细胞的体外扩增能力和体外杀伤能 力都优于直接电转ITNK质粒获得的ITNK细胞。 本发明中,所述的ITNK细胞可以应用于治疗肿瘤的药物等多种研究当中。 本发明所述的数值范围不仅包括上述列举的点值,还包括没有列举出的上述数值 范围之间的任意的点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括 的具体点值。 与现有技术相比,本发明至少具有以下有益效果: (1)本发明提供的重编程方法将RNP复合物通过电转的方法转入T细胞中,使其分 化成为ITNK细胞,所述方法能够提高体外重编程效率,电转RNP复合物得到的ITNK细胞中, CD8阳性细胞群的NKp30为40.6~61.6%;该方法能够从整体上提升重编程ITNK细胞制备能 力,使更多的临床患者获益; (2)本发明提供的重编程方法得到ITNK细胞具有较好的体外扩增能力,在电转后 第14天,其细胞扩增倍数为26.8~62.2倍;且所述ITNK细胞具有较强的体外杀伤功能,在效 靶比降低至1:2甚至更低时,电转RNP组对靶细胞的杀伤能力明显强于电转质粒组。 附图说明 图1为实施例2中不同组细胞的重编程效率散点图。 图2为实施例3中不同组细胞的体外扩增能力曲线图。 图3为实施例4中不同组细胞的体外杀伤能力曲线图。












