技术摘要:
本文提供了用于治疗癌症的方法和组合物,所述癌症包括对免疫疗法没有应答的癌症。在一方面,所述治疗方法包括向所述受试者施用治疗有效量的β‑连环蛋白抑制剂、治疗有效量的IDO抑制剂和治疗有效量的免疫治疗剂。另一方面涉及用于在治疗癌症中使用的包含β‑连环蛋白抑 全部
背景技术:
免疫系统使用免疫细胞表面的某些分子作为检查点,以控制T细胞激活并阻止免 疫系统靶向健康细胞和诱导自身免疫。某些癌细胞能够利用这些免疫检查点分子逃避免疫 系统。近年来,阻断免疫检查点分子(诸如细胞毒性T淋巴细胞相关蛋白4(CTLA-4)和程序性 细胞死亡受体1(PD-1))的免疫治疗策略已显示出对某些癌症的成功。在2011年,抗CTLA-4 单克隆抗体(伊匹单抗(ipilimumab))被批准用于治疗晚期黑素瘤患者。在2014年,两种抗 PD-1单克隆抗体(纳武单抗(nivolumab)和派姆单抗(pembrolizumab))被批准用于治疗某 些晚期癌症患者。自2016年以来,已批准了三种抗PD-L1单克隆抗体(阿特珠单抗 (atezolizumab)、阿维鲁单抗(avelumab)和德瓦鲁单抗(durvalumab))用于晚期癌症。阻断 免疫检查点分子(如CTLA-4、PD-1和PD-L1)的抗体似乎释放了对T细胞激活的制动,并促进 了强有力的抗肿瘤免疫应答。然而,只有一小组患者对该免疫疗法有应答。 至少在某些情况下,对免疫疗法有应答的肿瘤具有预先存在的T细胞发炎表型伴 有浸润性T细胞、广泛的趋化因子谱(将T细胞募集至肿瘤微环境)以及高水平的IFNγ分泌 (也称为热肿瘤或发炎肿瘤)。Gajewski等人,Nat Immunol.,2013,14(10):1014-22;Ji等 人,Cancer Immunol Immunother,2012,61:1019-31。相反,某些对免疫疗法无应答的肿瘤 已显示出没有T细胞发炎的表型(也称为冷肿瘤或非发炎肿瘤)。同前。 肿瘤细胞已发展出逃避免疫系统的不同策略。一种这样的策略涉及吲哚胺2,3-双 加氧酶-1(IDO1)酶的表达。IDO1是一种细胞内含亚铁血红素的酶,其催化必需氨基酸色氨 酸降解为犬尿氨酸及其下游分解代谢物。IDO1表达促进T细胞浸润减少的免疫抑制肿瘤微 环境(即,冷肿瘤或非发炎肿瘤)。IDO1在许多癌症中表达,并且IDO1的过表达与多种癌症类 型中的晚期疾病阶段和肿瘤转移相关联。Munn,Front.Biosci.,2012,(Elite编)4:734-45。 在癌症中,IDO1可以直接由肿瘤细胞表达或者由周围微环境中的抗原呈递细胞间接诱导。 Holmgaard等人,Cell Reports,2015,13:412-24。尽管尚未完全了解IDO过表达促进对免疫 疗法的抗性的机制,但已知IDO1通过耗竭必需氨基酸色氨酸来抑制效应T细胞的激活,并通 过产生犬尿氨酸促进FoxP3调控性T细胞(Treg)的分化和激活(Munn和Mellor , J.Clin.Invest.,2007,117:1147-54)。在某些实体瘤中过表达的另一种吲哚胺2,3-双加氧 酶同种型(IDO2)也已参与免疫抗性,色氨酸2,3-双加氧酶(TDO)也是如此,其与IDO1和IDO2 一样是色氨酸分解代谢酶。Pendergast等人,Cancer Research,2017,77(24):6795-6811。 6 CN 111587116 A 说 明 书 2/45 页 最近,已显示IDO抑制剂增强靶向PD-1/PD-L1途径的某些免疫疗法的有效性。利用 IDO抑制剂艾卡哚司他(epa cad os ta t) (In cy te)与PD-1抑制剂帕博利珠单抗 (prembrolizumab) 和纳武单抗 的组合的I/II期试验已在黑素瘤 患者中取得了积极的早期结果。Gangadhar等人,在2016年欧洲肿瘤医学会峰会(European Society for medical Oncology Congress)提出,10月7-11日,2016,摘要,1110PD;Perez 等人,J.Clin.Oncol.,2017,ASCO摘要,3003。所述组合在其他肿瘤中也显示出功效,所述其 他肿瘤包括头颈部转移性或复发性鳞状细胞癌、晚期尿路上皮细胞癌和晚期肾细胞癌。来 自Incyte的艾卡哚司他组合Merck的 (派姆单抗)的ECHO-202试验的更新数 据证明跨多种肿瘤类型的临床活性,这是在2017年6月5日日期的来自Merck网站的Incyte 和Merck联合新闻发布。艾卡哚司他和派姆单抗用于不可切除或转移性黑素瘤的III期研究 目前正在进行中。临床试验政府标识符:NCT02752074。 在II期研究中,当与派姆单抗组合时,小分子IDO抑制剂吲哚莫德(indoximod) (Ne wLink G e ne ti cs)已在晚期黑素瘤患者中显示出功效。关于Ind oxim od加 (派姆单抗)的更新数据证明晚期黑素瘤患者的应答率得到改善,这是在 2017年8月7日日期的来自NewLink Genetics的新闻发布。在晚期黑素瘤患者中,还评价了 与FDA批准的以下检查点抑制剂之一组合的吲哚莫德:伊匹单抗、纳武单抗或派姆单抗。临 床试验政府标识符:NCT02073123。已显示另一种IDO抑制剂BMS-986205在晚期癌症患者中 是安全耐受的,并且正在扩展研究以评估与纳武单抗和/或伊匹单抗的组合疗法。Siu等人, AACR摘要CT116 ,2017 ,77(13增刊)。在I期研究中正在评价其他IDO抑制剂,如NLG802 (NewLink Genetics)和HTI-1090(Atridia Pty Ltd)。 本领域仍然需要开发新的癌症治疗选择,包括将增强非发炎肿瘤对免疫疗法的应 答性的选择。
技术实现要素:
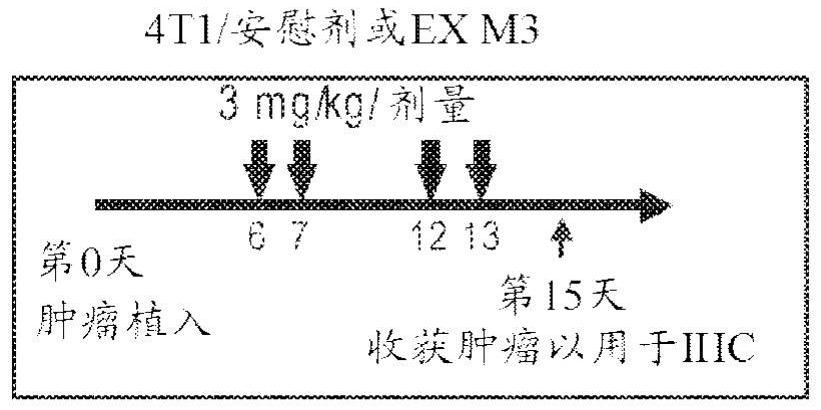
本申请公开了降低β-连环蛋白和IDO表达可以显著增强某些肿瘤对免疫疗法的应 答性。无意于受任何理论的束缚,似乎降低β-连环蛋白和IDO表达可以将某些对免疫疗法有 抗性的非发炎或冷肿瘤转化为发炎或热肿瘤,同时增加CD8 T细胞浸润并降低免疫抑制性 Foxp3 调控性T细胞(Treg)的水平。一旦转化,发炎或热肿瘤就会对免疫疗法(例如,免疫检 查点分子的阻断)有应答。因此,本申请提供了用于通过降低β-连环蛋白和IDO表达将某些 非发炎肿瘤转化为对免疫疗法有应答的肿瘤的方法。 通常,通过施用β-连环蛋白核酸抑制剂分子来降低β-连环蛋白的表达,所述核酸 抑制剂包括但不限于诸如以下的核酸抑制剂分子:短干扰RNA(siRNA)、常规反义寡核苷酸、 微RNA(miRNA)、核糖酶和适体。然而,任何β-连环蛋白抑制剂可用于本文所述的方法和组合 物中。如本文所公开的,用β-连环蛋白和IDO抑制剂和免疫疗法的组合治疗癌症不仅减慢了 肿瘤生长,而且实际上诱导了体内肿瘤模型中的肿瘤消退。 一方面涉及治疗受试者中的癌症的方法,其包括向受试者施用治疗有效量的β-连 环蛋白抑制剂、治疗有效量的IDO抑制剂和治疗有效量的免疫治疗剂。在某些实施方案中, 受试者是人。 另一方面涉及包含β-连环蛋白抑制剂的药物组合物,用于在治疗癌症中使用,其 7 CN 111587116 A 说 明 书 3/45 页 中所述组合物与IDO抑制剂和免疫治疗剂组合施用。 在所述方法或组合物的某些实施方案中,癌症是Wnt激活的癌症。在所述方法或组 合物的某些实施方案中,癌症是过表达IDO1的Wnt激活的癌症。 在所述方法或组合物的某些实施方案中,IDO抑制剂包括艾卡哚司他、吲哚莫德、 BMS-986205、NLG802、HTI-1090、navoximod、PF-06840003、IOM2983、RG-70099、苯基苯磺酰 肼、β-(3-苯并呋喃基)-丙氨酸、β-[3-苯并(b)噻吩基]-丙氨酸或6-硝基-D-色氨酸。在所述 方法或组合物的某些实施方案中,IDO抑制剂包括艾卡哚司他。 在所述方法或组合物的某些实施方案中,β-连环蛋白抑制剂是β-连环蛋白核酸抑 制剂分子,包括但不限于siRNA、常规反义寡核苷酸、miRNA、核糖酶和适体。在所述方法或组 合物的某些实施方案中,β-连环蛋白核酸抑制剂分子是双链RNAi抑制剂分子,其包含形成 互补区的有义链和反义链,任选地其中有义链与反义链之间的互补区是约15-45个核苷酸。 在所述方法或组合物的某些实施方案中,β-连环蛋白核酸抑制剂分子是双链RNAi 抑制剂分子,其包含有义链和反义链以及在有义链与反义链之间、约15-45、18-26或19-21 个核苷酸的互补区。在某些实施方案中,有义链为15-66个核苷酸,并且反义链为15-66个核 苷酸。在某些实施方案中,有义链为25-40个核苷酸或19-25个核苷酸。在某些实施方案中, 反义链为25-40个核苷酸或19-25个核苷酸。在某些实施方案中,有义链为19-25个核苷酸, 并且反义链为19-25个核苷酸。在某些实施方案中,有义链为26-30或34-40个核苷酸并且含 有茎和四元环,并且反义链为18-24个核苷酸,其中有义链和反义链形成18-24个核苷酸的 双链体区。在某些实施方案中,有义链为27-29或33-39个核苷酸并且含有茎和三元环,并且 反义链为18-24个核苷酸,其中有义链和反义链形成18-24个核苷酸的双链体区。 在所述方法或组合物的某些实施方案中,β-连环蛋白核酸抑制剂分子是双链RNAi 抑制剂分子,其包含有义链和反义链以及在有义链与反义链之间、18-34个核苷酸的互补 区,其中有义链的长度为25-36个核苷酸,并且反义链的长度为26-38个核苷酸并且在其3'- 末端包含1-5个核苷酸的单链突出端。在某些实施方案中,双链RNAi抑制剂分子的反义链在 其5'-末端进一步包含1-10个核苷酸的单链突出端 在所述方法或组合物的某些实施方案中,β-连环蛋白核酸抑制剂分子是双链RNAi 抑制剂分子,其包含有义链和反义链以及在有义链与反义链之间、20-30、21-26、19-24或 19-21个核苷酸的互补区。在某些实施方案中,有义链具有21个核苷酸并且在其3'-末端包 含2个核苷酸的单链突出端,反义链是21个核苷酸并且在其3'-端具有2个核苷酸的单链突 出端,并且有义链和反义链形成19个核苷酸的双链体区。在某些实施方案中,有义链为21个 核苷酸,反义链为23个核苷酸并且在其3'-端具有2个核苷酸的单链突出端,并且有义链和 反义链形成21个核苷酸的双链体区。 在所述方法或组合物的某些实施方案中,β-连环蛋白核酸抑制剂分子是双链RNAi 抑制剂分子,其包含有义链和反义链以及在有义链与反义链之间、26个核苷酸的互补区,其 中有义链的长度为26个核苷酸,并且其中反义链的长度为38个核苷酸并且在其3'-末端包 含2个核苷酸的单链突出端且在其5'-末端包含10个核苷酸的单链突出端。 在双链RNAi抑制剂分子的某些实施方案中,有义链包含SEQ ID NO:1的序列或由 所述序列组成。在双链RNA抑制剂分子的某些实施方案中,反义链包含SEQ ID NO:2的序列 或由所述序列组成。 8 CN 111587116 A 说 明 书 4/45 页 在所述方法或组合物的某些实施方案中,β-连环蛋白核酸抑制剂分子含有四元 环。在所述方法或组合物的某些实施方案中,β-连环蛋白核酸抑制剂分子含有三元环。 在所述方法或组合物的某些实施方案中,β-连环蛋白核酸抑制剂分子是单链寡核 苷酸。在所述方法或组合物的某些实施方案中,β-连环蛋白核酸抑制剂分子是常规反义寡 核苷酸,其具有5'至3'方向的核苷酸序列,所述核苷酸序列包含人β-连环蛋白基因的区段 的反向互补序列并且长度为12-30、12-25、12-22、14-20或18-22个核苷酸。在某些实施方案 中,常规反义寡核苷酸的长度为16-18或18-20个核苷酸。 在所述方法或组合物的某些实施方案中,免疫治疗剂是抑制性免疫检查点分子的 拮抗剂或共刺激检查点分子的激动剂。在某些实施方案中,免疫治疗剂是抑制性检查点的 拮抗剂,并且抑制性检查点是PD-1或PD-L1。在某些实施方案中,抑制性免疫检查点分子的 拮抗剂或共刺激检查点分子的激动剂是单克隆抗体。在某些实施方案中,单克隆抗体是抗 CTLA-4单克隆抗体、抗PD-1单克隆抗体、抗PD-L1单克隆抗体或抗CTLA-4单克隆抗体与抗 PD-1单克隆抗体的组合。 在其他实施方案中,免疫治疗剂是抑制性免疫检查点分子的拮抗剂,其中抑制性 免疫检查点分子是PD-1的配体,诸如PD-L1或PD-L2;CTLA4的配体,诸如CD80或CD86;或淋巴 细胞激活基因3(LAG3)、杀伤细胞免疫球蛋白样受体(KIR)、T细胞膜蛋白3(TIM3)、半乳糖凝 集素9(GAL9)或腺苷A2a受体(A2aR)。在某些实施方案中,免疫治疗剂是共刺激分子的激动 剂,其中共刺激分子是CD28、诱导型T细胞共刺激剂(ICOS)、CD137、OX40或CD27。在其他实施 方案中,免疫治疗剂是共刺激分子的配体的激动剂,所述配体包括例如CD80、CD86、B7RP1、 B7-H3、B7-H4、CD137L、OX40L或CD70。 在一个实施方案中,所述治疗人受试者中的癌症的方法包括向人受试者施用: 治疗有效量的β-连环蛋白核酸抑制剂分子,其中β-连环蛋白核酸抑制剂分子是双 链RNAi抑制剂分子,其包含有义链和反义链以及在有义链与反义链之间、18-34个核苷酸的 互补区,其中有义链的长度为19-36个核苷酸,并且反义链的长度为18-38个核苷酸并且在 其3'-末端包含1-5个单链核苷酸; 治疗有效量的IDO抑制剂,其中IDO抑制剂包括艾卡哚司他、吲哚莫德、BMS- 986205、NLG802、HTI-1090、navoximod、PF-06840003、IOM2983、RG-70099、苯基苯磺酰肼、β- (3-苯并呋喃基)-丙氨酸、β-[3-苯并(b)噻吩基]-丙氨酸或6-硝基-D-色氨酸;以及 治疗有效量的免疫治疗剂,其中免疫治疗剂包括抗CTLA-4单克隆抗体、抗PD-1单 克隆抗体、抗PD-L1单克隆抗体或抗CTLA-4单克隆抗体与抗PD-1单克隆抗体的组合。在一个 实施方案中,IDO抑制剂包括艾卡哚司他。在某些实施方案中,癌症是Wnt激活的癌症。在某 些实施方案中,癌症是过表达IDO1的Wnt激活的癌症。 在一个实施方案中,药物组合物包含β-连环蛋白抑制剂分子,用于在治疗癌症中 使用,其中所述组合物与IDO抑制剂和免疫治疗剂组合施用,其中β-连环蛋白核酸抑制剂分 子是双链RNAi抑制剂分子,其包含有义链和反义链以及在有义链与反义链之间、18-34个核 苷酸的互补区,其中有义链的长度为19-36个核苷酸,并且反义链的长度为19-38个核苷酸 并且在其3'-末端包含1-5个单链核苷酸,其中IDO抑制剂包括艾卡哚司他、吲哚莫德、BMS- 986205、NLG802、HTI-1090、navoximod、PF-06840003、IOM2983、RG-70099、苯基苯磺酰肼、β- (3-苯并呋喃基)-丙氨酸、β-[3-苯并(b)噻吩基]-丙氨酸或6-硝基-D-色氨酸,并且其中免 9 CN 111587116 A 说 明 书 5/45 页 疫治疗剂是抗CTLA-4单克隆抗体、抗PD-1单克隆抗体、抗PD-L1单克隆抗体或抗CTLA-4单克 隆抗体与抗PD-1单克隆抗体的组合。在某些实施方案中,IDO抑制剂包括艾卡哚司他。在某 些实施方案中,癌症是Wnt激活的癌症。在某些实施方案中,癌症是过表达IDO1的Wnt激活的 癌症。 在所述方法或组合物的一个实施方案中,在有义链与反义链之间的互补区为21- 26个核苷酸,其中有义链的长度为21-26个核苷酸,并且其中反义链的长度为23-38个核苷 酸并且在其3'-末端包含1-2个核苷酸的单链突出端。在某些实施方案中,反义链在其5'-末 端进一步包含1-10个核苷酸的单链突出端。 在所述方法或组合物的一个实施方案中,在有义链与反义链之间的互补区为19个 核苷酸,其中有义链的长度为21个核苷酸并且在其3'-末端包含2个核苷酸的单链突出端, 并且其中反义链的长度为21个核苷酸并且在其3'-末端包含2个核苷酸的单链突出端。在另 一个实施方案中,在有义链与反义链之间的互补区为21个核苷酸,其中有义链的长度为21 个核苷酸,并且其中反义链的长度为23个核苷酸并且在其3'-末端包含2个核苷酸的单链突 出端。 在所述方法或组合物的某些实施方案中,β-连环蛋白核酸抑制剂分子是双链RNAi 抑制剂分子,其包含有义链和反义链以及在有义链与反义链之间、26个核苷酸的互补区,其 中有义链的长度为26个核苷酸,并且其中反义链的长度为38个核苷酸并且在其3'-末端包 含2个核苷酸的单链突出端且在其5'-末端包含10个核苷酸的单链突出端。 在所述方法或组合物的某些实施方案中,有义链包含SEQ ID NO:1的序列或由所 述序列组成,并且反义链包含SEQ ID NO:2的序列或由所述序列组成。 在所述方法或组合物的某些实施方案中,有义链为34-36个核苷酸并且含有茎和 四元环,并且反义链为18-24个核苷酸,其中有义链和反义链形成18-24个核苷酸的双链体 区。在所述方法或组合物的某些实施方案中,有义链为26-30个核苷酸并且含有茎和四元 环,并且反义链为18-24个核苷酸,其中有义链和反义链形成18-24个核苷酸的双链体区,并 且其中茎含有1、2或3个碱基对和至少一个双环核苷酸。 在所述方法或组合物的某些实施方案中,有义链为33-35个核苷酸并且含有茎和 三元环,并且反义链为18-24个核苷酸,其中有义链和反义链形成18-24个核苷酸的双链体 区。在所述方法或组合物的某些实施方案中,有义链为27-29个核苷酸并且含有茎和三元 环,并且反义链为18-24个核苷酸,其中有义链和反义链形成18-24个核苷酸的双链体区,并 且其中茎含有2或3个碱基对和至少一个双环核苷酸。 在所述方法或组合物的某些实施方案中,用脂质纳米颗粒配制β-连环蛋白核酸抑 制剂分子。在某些实施方案中,脂质纳米颗粒包含阳离子脂质和聚乙二醇化脂质。 在所述方法的某些实施方案中,施用β-连环蛋白核酸抑制剂分子、IDO抑制剂和免 疫治疗剂减少了受试者中的癌症量。 在所述方法的某些实施方案中,在施用步骤之前,受试者已被鉴定为患有非Wnt激 活的癌症和/或过表达IDO1的癌症。 在某些实施方案中,所述方法进一步包括在施用步骤之前,分析来自受试者的肿 瘤样品以确定受试者是否患有非Wnt激活的癌症的步骤。 在所述方法或组合物的某些实施方案中,当免疫治疗剂不与β-连环蛋白核酸抑制 10 CN 111587116 A 说 明 书 6/45 页 剂分子和IDO抑制剂组合施用时,Wnt激活的癌症对用免疫治疗剂的治疗有抗性。 另一个方面涉及加强免疫治疗剂对癌症的治疗效果的方法,所述方法包括以足以 加强免疫治疗剂对癌症的治疗效果的量向患有癌症的受试者施用β-连环蛋白核酸抑制剂 分子,诸如本文所述的双链RNAi抑制剂分子,和IDO抑制剂。在某些实施方案中,癌症是Wnt 激活的癌症。在某些实施方案中,癌症是过表达IDO1的Wnt激活的癌症。 在所述方法的某些实施方案中,在施用β-连环蛋白核酸抑制剂分子和IDO抑制剂 之前,癌症与对免疫疗法有抗性的非T细胞发炎表型相关联,并且其中施用β-连环蛋白核酸 抑制剂分子和IDO抑制剂将非T细胞发炎表型转化为对免疫治疗剂有应答的T细胞发炎表 型。 在某些实施方案中,IDO抑制剂包括艾卡哚司他、吲哚莫德、BMS-986205、NLG802、 HTI-1090、navoximod、PF-06840003、IOM2983、RG-70099、苯基苯磺酰肼、β-(3-苯并呋喃 基)-丙氨酸、β-[3-苯并(b)噻吩基]-丙氨酸或6-硝基-D-色氨酸。在某些实施方案中,IDO抑 制剂包括艾卡哚司他。 在某些实施方案中,免疫治疗剂是抑制性免疫检查点分子的拮抗剂或共刺激检查 点分子的激动剂。在某些实施方案中,免疫治疗剂是抑制性检查点的拮抗剂,并且抑制性检 查点是PD-1或PD-L1。在某些实施方案中,抑制性免疫检查点分子的拮抗剂或共刺激检查点 分子的激动剂是单克隆抗体。在某些实施方案中,单克隆抗体是抗CTLA-4单克隆抗体、抗 PD-1单克隆抗体、抗PD-L1单克隆抗体或抗CTLA-4单克隆抗体与抗PD-1单克隆抗体的组合。 在其他实施方案中,免疫治疗剂是抑制性免疫检查点分子的拮抗剂,其中抑制性 免疫检查点分子是PD-1的配体,诸如PD-L1或PD-L2;CTLA4的配体,诸如CD80或CD86;或淋巴 细胞激活基因3(LAG3)、杀伤细胞免疫球蛋白样受体(KIR)、T细胞膜蛋白3(TIM3)、半乳糖凝 集素9(GAL9)或腺苷A2a受体(A2aR)。在某些实施方案中,免疫治疗剂是共刺激分子的激动 剂,其中共刺激分子是CD28、诱导型T细胞共刺激剂(ICOS)、CD137、OX40或CD27。在其他实施 方案中,免疫治疗剂是共刺激分子的配体的激动剂,所述配体包括例如CD80、CD86、B7RP1、 B7-H3、B7-H4、CD137L、OX40L或CD70。 附图说明 并入本说明书并且构成本说明书的一部分的附图说明某些实施方案,并且与书面 说明一起用于解释本文所公开的组合物和方法的某些原理。 图1A示出了用于Balb/C小鼠的治疗方案,所述小鼠被植入Wnt激活的4T1肿瘤并用 安慰剂或BCAT1进行治疗,如实施例3中所述。 图1B通过免疫组织化学显示,BCAT1治疗降低了β-连环蛋白水平并增加了CD8T细 胞浸润,但未显著降低4T1肿瘤中的IDO1水平。 图1C显示,与安慰剂相比,在植入Balb/C小鼠中的4T1肿瘤中,两个周期的BCAT1治 疗抑制了肿瘤生长。 图2A示出了用于Balb/C小鼠的治疗方案,所述小鼠被植入4T1肿瘤并用PBS或 BCAT1进行治疗,如实施例3中所述。 图2B通过流式细胞术分析显示,对4T1肿瘤的BCAT1治疗增加了CD8 T细胞、增加了 多种检查点分子(PD-1、LAG-3 和Tim-3 ),并且增加了调控T细胞(Treg),但未显著改变肿 11 CN 111587116 A 说 明 书 7/45 页 瘤微环境中髓源性抑制细胞(MDSC)的数目。 图3A示出了用于Balb/C小鼠的治疗方案,所述小鼠被植入4T1肿瘤并用媒介物或 IDO抑制剂(IDOi)(被称为艾卡哚司他)进行治疗,如实施例4中所述。 图3B通过免疫组织化学显示,IDOi治疗降低了β-连环蛋白水平、增加了CD8T细胞 浸润,并且降低4T1肿瘤中的IDO1水平。 图3C显示,与安慰剂相比,在植入Balb/C小鼠中的4T1肿瘤中,两个周期的IDOi治 疗抑制了肿瘤生长。 图4A-C示出了作为单一剂(图4A)、两种剂的组合(图4B)或三种剂的组合(图4C)施 用的IDOi(艾卡哚司他)、抗PD-1抗体(PD-1)和BCAT在植入4T1肿瘤的Balb/C小鼠中的功效, 其中所有三种剂的组合显示出肿瘤消退,如实施例5中所述。 图5A-B示出了用IDOi、抗PD-1抗体和/或BCAT1治疗的4T1肿瘤中的CD8(图5A)和 Foxp3(图5B)的mRNA水平并且证明仅所有三种剂的组合显著增加CD8 mRNA水平并且显著降 低Foxp3 mRNA水平。 图6A示出了用于C57BL/6小鼠的治疗方案,所述小鼠被植入非Wnt激活的B16F10肿 瘤并用安慰剂或BCAT1进行治疗,如实施例6中所述。 图6B通过免疫组织化学显示,BCAT1治疗降低了β-连环蛋白水平、增加了CD8T细胞 浸润,并且降低了B16F10肿瘤中的IDO1水平。 图6C显示,与安慰剂相比,在植入C57BL/6小鼠中的B16F10肿瘤中,两个周期的 BCAT1治疗未显著抑制肿瘤生长。 图7A示出了用于C57BL/6小鼠的治疗方案,所述小鼠被植入B16F10肿瘤并用安慰 剂或BCAT1进行治疗,如实施例6中所述。 图7B通过流式细胞术分析显示,对B16F10肿瘤的BCAT1治疗增加CD8 T细胞,增加 多种检查点分子(PD-1、LAG-3 和Tim-3 ),但未显著改变调控T细胞(Treg)或肿瘤微环境中 髓源性抑制细胞(MDSC)的数目。 图8A示出了用于C57BL/6小鼠的治疗方案,所述小鼠被植入B16F10肿瘤并用媒介 物或IDO抑制剂(IDOi)(被称为艾卡哚司他)进行治疗,如实施例7中所述。 图8B通过免疫组织化学显示,IDOi治疗降低了β-连环蛋白水平、增加了CD8T细胞 浸润,并且降低了B16F10肿瘤中的IDO1水平。 图8C显示,与安慰剂相比,在植入C57BL/6小鼠中的B16F10肿瘤中,两个周期的 IDOi治疗未显著抑制肿瘤生长。 图9A-C示出了作为单一剂(图9A)或者两种或三种剂的组合(图9B和9C)施用的 IDOi(艾卡哚司他)、抗PD-1抗体(PD-1)和BCAT1在植入B16F10肿瘤的C57BL/6小鼠中的功 效,如实施例8中所述。 图10A示出了用于携带MMTV-Wnt肿瘤的小鼠的治疗方案,所述小鼠用安慰剂或 BCAT1进行治疗,如实施例9中所述。 图10B通过免疫组织化学显示,BCAT1治疗降低了β-连环蛋白水平并增加了CD8 T 细胞浸润,但未显著降低MMTV-Wnt肿瘤中的IDO1水平。 图10C显示,与安慰剂相比,在携带MMTV-Wnt肿瘤的小鼠中,两个周期的BCAT1治疗 抑制了肿瘤生长。 12 CN 111587116 A 说 明 书 8/45 页 图11A示出了用于携带MMTV-Wnt肿瘤的小鼠的治疗方案,所述小鼠用媒介物或IDO 抑制剂(IDOi)(被称为艾卡哚司他)进行治疗,如实施例10中所述。 图11B通过免疫组织化学显示,IDOi治疗降低了IDO1水平并且增加了β-连环蛋白 和CD8水平。 图12示出了双链β-连环蛋白核酸抑制剂分子的一个非限制性实施方案,其具有有 义(或信使)链(SEQ ID NO:1)和反义(引导)链(SEQ ID NO:2)。该β-连环蛋白核酸抑制剂分 子在本文中称为BCAT1。 图13示出了可以用于配制β-连环蛋白核酸抑制剂分子的脂质纳米颗粒(LNP)的一 个非限制性实施方案。LNP包含以下核心脂质:DL-048(阳离子脂质)和DSG-MPEG(聚乙二醇 脂质),以及以下包膜脂质:DL-103(阳离子脂质)、DSPC、胆固醇和DSPE-MPEG(聚乙二醇化脂 质)。 图14示出了Wnt信号传导途径的简化图。左侧描绘了其中Wnt配体未与其表面受体 结合的细胞,β-连环蛋白被隔离在破坏复合物中并被靶向进行泛素化和降解,并且靶基因 被阻遏。右侧描绘了Wnt配体结合其表面受体后的细胞,其中破坏复合物分解,稳定化的β- 连环蛋白释放并行进到细胞核,并且靶基因被激活。 定义 为了更容易理解本公开,以下首先定义某些术语。以下术语和其他术语的另外的 定义可以通过说明书进行阐述。如果以下阐述的术语的定义与以引用的方式并入的申请或 专利中的定义不一致,则应使用本申请中阐述的定义来理解所述术语的含义。 如本说明书以及随附权利要求中所用,除非上下文另外明确指示,否则单数形式 的“一个/种(a/an)”与“所述”包括复数提及形式。因此,例如提及“一种方法”包括本文所述 类型的和/或在阅读本公开等后对于本领域技术人员将变得清楚的一种或多种方法,和/或 步骤。 施用:如本文所用,将组合物“施用”至受试者意指将组合物给予、应用至受试者或 使组合物与受试者接触。可以通过许多途径中的任一种来完成施用,所述许多途径包括例 如局部、口服、皮下、肌内、腹膜内、静脉内、鞘内和皮内。 酰基:如本文所用,术语“酰基”是指烷基羰基、环烷基羰基和芳基羰基部分。 烷氧基:如本文所用,术语“烷氧基”是指通过氧原子连接至分子部分的烷基。 烯基:如本文使用,术语“烯基”是指具有至少一个碳碳双键并且具有在约2个至约 20个范围内的碳原子的直链或支链烃基。“取代的烯基”是指进一步携带一个或多个取代基 的烯基。如本文所用,“低级烯基”是指具有2个至约6个碳原子的烯基部分。 烷基:如本文所用,术语“烷基”是指具有1个至约20个碳原子的直链或支链烃基。 无论何时它出现在本文中,数值范围诸如“C1-C6烷基”意指烷基可以包含仅1个碳原子、2个 碳原子、3个碳原子等,最多至并包括6个碳原子,但是术语“烷基”还包括其中未指定碳原子 的数值范围的情况。例如,术语“烷基”可以是指在C1-C10(例如C1-C6)之间的子范围。“取代的 烷基”是指携带取代基的烷基部分。如本文所用,“低级烷基”是指具有1个至约6个碳原子的 烷基部分。 炔基:如本文所用,“炔基”是指具有至少一个碳碳三键并且具有在约2个至约20个 范围内的碳原子的直链或支链烃基。“取代的炔基”是指进一步携带一个或多个取代基的炔 13 CN 111587116 A 说 明 书 9/45 页 基。如本文所用,“低级炔基”是指具有约2个至约6个碳原子的炔基部分。 抗体:如本文所用,术语“抗体”是指免疫球蛋白或其抗原结合结构域。所述术语包 括但不限于多克隆抗体、单克隆抗体、单特异性抗体、多特异性抗体、非特异性抗体、人源化 抗体、人抗体、单链抗体、嵌合抗体、合成抗体、重组抗体、杂合抗体、突变抗体、嫁接抗体和 体外产生的抗体。抗体可以包括恒定区或其一部分,诸如κ、λ、α、γ、δ、ε和μ恒定区基因。例 如,可以使用各种同种型的重链恒定区,包括:IgG1、IgG2、IgG3、IgG4、IgM、IgA1、IgA2、IgD和 IgE。举例来说,轻链恒定区可以是κ或λ。 抗原结合结构域:如本文所用,术语“抗原结合结构域”是指抗体分子的一部分,其 包含负责抗体与抗原之间的特异性结合的氨基酸。对于某些抗原,抗原结合结构域可以仅 与抗原的一部分结合。抗原的被抗体特异性识别并结合的部分称为“表位”或“抗原决定 簇”。抗原结合结构域包括Fab(片段抗原结合);F(ab')2片段,一种具有通过二硫桥在铰链 区连接的两个Fab片段的二价片段;Fv片段;单链Fv片段(scFv),参见例如,Bird等人(1988) Science242:423-426;和Huston等人(1988)Proc.Natl.Acad.Sci.USA85:5879-5883);Fd片 段,其具有两个VH和CH1结构域;dAb(Ward等人,(1989)Nature341:544-546),以及其他保留 抗原结合功能的抗体片段。Fab片段具有通过二硫键在恒定区之间共价连接的VH-CH1和VL- CL结构域。Fv片段较小并且具有非共价连接的VH和VL结构域。为了克服非共价连接的结构域 解离的趋势,可以构建scFv。scFv含有柔性多肽,其连接(1)VH的C-末端与VL的N-末端,或(2) VL的C-末端与VH的N-末端。15-mer(Gly4Ser)3肽可以用作接头,但是其他接头是本领域已知 的。这些抗体片段是使用本领域技术人员已知的常规技术获得的,并且以与完整抗体相同 的方式评价片段的功能。 反义链:dsRNAi抑制剂分子包含两条寡核苷酸链:反义链和有义链。反义链或其区 与靶核酸的相应区部分、基本上或完全互补。此外,双链RNAi抑制剂分子的反义链或其区与 双链RNAi抑制剂分子的有义链或其区部分、基本上或完全互补。在某些实施方案中,反义链 还可以含有与靶核酸序列不互补的核苷酸。非互补核苷酸可以在互补序列的任一侧或可以 在互补序列的两侧。在某些实施方案中,当反义链或其区与有义链或其区部分或基本互补 时,非互补核苷酸可以位于一个或多个互补区之间(例如一个或多个错配)。双链RNAi抑制 剂分子的反义链也称为引导链。 大约:如本文所用,当应用到一种或多种感兴趣的值时,术语“大约”或“约”是指类 似于所述参考值的值。在某些实施方案中,术语“大约”或“约”是指在所陈述的参考值的任 一方向上的(大于或小于)25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、 10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小范围内的值范围,除非另外说明或以 另外的方式从上下文显而易见(除了这种数值将超过可能值的100%的情况)。 酰基:如本文所用,术语“芳基”是指具有在5个至19个范围内的碳原子的芳族单环 或多环基团。“取代的芳基”是指进一步携带一个或多个取代基的芳基。 β-连环蛋白:如本文所用,“β-连环蛋白”是指编码这种β-连环蛋白的多肽或核酸 序列。当提及多肽时,“β-连环蛋白”是指β-连环蛋白基因/转录物(CTNNB1)(基因库登录号 NM_001904.3(人β-连环蛋白转录变体1)、NM_001098209.1(人β-连环蛋白转录变体2)、NM_ 001098210.1(人β-连环蛋白转录变体3)以及NM_007614.2和NM_007614.3(小鼠β-连环蛋 白)的多肽基因产物。 14 CN 111587116 A 说 明 书 10/45 页 BCAT1:如本文所用,“BCAT1”是指这样的核酸抑制剂分子,其靶向β-连环蛋白基因 并且具有有着由SEQ ID NO:1组成的核酸序列的正义链和有着由SEQ ID NO:2组成的核酸 序列的反义链。 双环核苷酸:如本文所用,术语“双环核苷酸”是指包含双环糖部分的核苷酸。 双环糖部分:如本文所用,术语“双环糖部分”是指包含4至7元环的修饰糖部分(包 括但不限于呋喃糖基),所述修饰糖部分包含连接4至7元环的两个原子以形成第双环,从而 产生双环结构的桥。通常,4至7元环为糖。在一些实施方案中,4至7元环为呋喃糖基。在某些 实施方案中,桥连接呋喃糖基的2'-碳和4'-碳。 互补的:如本文所用,术语“互补的”是指两个核苷酸之间的结构关系(例如,在两 个相对的核酸上或在单条核酸链的相对区上),其允许两个核苷酸彼此形成碱基对。例如, 与相对核酸的嘧啶核苷酸互补的一种核酸的嘌呤核苷酸可以通过彼此形成氢键而碱基配 对在一起。在一些实施方案中,互补核苷酸可以以Watson-Crick方式或以允许形成稳定双 链体的任何其他方式碱基配对。“完全互补”或100%互补性是指这样的一种情况,其中第一 寡核苷酸链或第一寡核苷酸链的区段的每个核苷酸单体可以与第二寡核苷酸链或第二寡 核苷酸链的区段的每个核苷酸单体形成碱基配对。小于100%的互补性是指这样一种情况, 其中两个寡核苷酸链(或两个寡核苷酸链的两个区段)的一些但不是全部核苷酸单体可以 彼此形成碱基对。“基本互补性”是指两条寡核苷酸链(或两条寡核苷酸链的区段)彼此表现 出90%或更大的互补性。“充分互补”是指靶mRNA与核酸抑制剂分子之间的互补性,使得靶 mRNA编码的蛋白质的量减少。 互补链:如本文所用,术语“互补链”是指与另一条链部分、基本上或完全互补的双 链核酸抑制剂分子的链。 常规反义寡核苷酸:如本文所用,术语“常规反义寡核苷酸”是指通过以下机制之 一抑制靶基因表达的单链寡核苷酸:(1)空间位阻,例如,反义寡核苷酸通过以下方式干扰 参与基因表达和/或编码蛋白产生的事件序列中的某个步骤:直接干扰例如基因的转录、 mRNA前体的剪接和mRNA的翻译;(2)诱导RNA酶H对靶基因的RNA转录物的酶消化;(3)诱导 RNA酶L对靶基因的RNA转录物的酶消化;(4)诱导RNA酶P对靶基因的RNA转录物的酶消化; (5)诱导双链RNA酶对靶基因的RNA转录物的酶消化;和(6)在同一个反义寡核苷酸中,将空 间位阻和酶消化活性的诱导相结合。常规反义寡核苷酸不像RNAi抑制剂分子那样具有RNAi 作用机制。RNAi抑制剂分子可以通过若干种方式与常规反义寡核苷酸区分开,包括对Ago2 的要求,所述Ago2与RNAi反义链组合使得反义链将Ago2蛋白引导至一个或多个预期靶标并 且其中要求Ago2沉默靶标。 环烷基:如本文所用,术语“环烷基”是指含有3个至12个碳,例如3个至8个碳和例 如3个至6个碳的环状(即,含环的)烃基。 脱氧核糖呋喃糖基:如本文所用,术语“脱氧核糖呋喃糖基”是存在于天然存在的 DNA中并且在2'-碳上具有氢基的呋喃糖基,如下所示: 15 CN 111587116 A 说 明 书 11/45 页 脱氧核糖核苷酸:如本文所用,术语“脱氧核糖核苷酸”是指在糖部分的2'-位具有 氢基的天然核苷酸(如本文所定义)或修饰核苷酸(如本文所定义)。 双链体:如本文所用,关于核酸(例如,寡核苷酸)的术语“双链体”是指通过核苷酸 的两个反平行序列的互补碱基配对形成的结构。 赋形剂:如本文所用,术语“赋形剂”是指可以包含在组合物中例如以提供或有助 于所希望的稠度或稳定作用的非治疗剂。 呋喃糖基:如本文所用,术语“呋喃糖基”是指包含5元环的结构,所述5元环具有四 个碳原子和一个氧原子。 卤素:如本文所用,术语“卤素”是指选自氟、氯、溴和碘的原子。 杂环:如本文所用,术语“杂环”或“杂环的”是指含有一个或多个杂原子(例如,N、 O、S等)作为环结构的一部分并且具有在3个至14个范围内的碳原子的非芳族环(即,含有 环)基。“取代的杂环的”或“取代的杂环”是指进一步携带一个或多个取代基的杂环基。 IDO抑制剂:如本文所用,术语“IDO抑制剂”是指降低吲哚胺2,3-双加氧酶(“IDO”) 的活性的化合物或剂。 核苷酸间连接基团:如本文所用,术语“核苷酸间连接基团”或“核苷酸间键”是指 能够共价连接两个核苷部分的化学基团。通常,化学基团是含磷酸或亚磷酸酯基团的含磷 键基团。磷酸连接基团旨在包括磷酸二酯键、二硫代磷酸酯键、硫代磷酸酯键、磷酸三酯键、 硫羰基烷基膦酸酯键、硫羰基烷基磷酸三酯(thionalkylphosphotriester)键、亚磷酰胺 键、膦酸酯键和/或硼烷磷酸酯键。许多含磷键是本领域熟知的,如例如以下专利中公开的: 美国专利号3,687,808;4,469,863;4,476,301;5,023,243;5,177,196;5,188,897;5,264, 423;5,276,019;5,278,302;5,286,717;5,321,131;5,399,676;5,405,939;5,453,496;5, 455,233;5,466,677;5,476,925;5,519,126;5,536,821;5,541 ,306;5,550,111;5,563, 253;5,571,799;5,587,361;5,194,599;5,565,555;5,527,899;5,721,218;5,672,697和5, 625,050。在其他实施方案中,寡核苷酸含有一个或多个不含磷原子的核苷酸间连接基团, 诸如短链烷基或环烷基核苷酸间键、混合的杂原子和烷基或环烷基核苷酸间键或一个或多 个短链杂原子或杂环核苷酸间键,包括但不限于具有以下主链的那些:硅氧烷主链;硫化 物、亚砜和砜主链;甲醛乙酰基(formacetyl)和硫代甲醛乙酰基主链;亚甲基甲醛乙酰基和 硫代甲醛乙酰基主链;核糖乙酰基主链;含烯烃的主链;氨基磺酸酯主链;亚甲基亚氨基和 亚甲基肼基主链;磺酸酯和磺酰胺主链;和酰胺主链。不含磷键是本领域熟知的,如例如以 下专利中公开的:美国专利号5,034,506;5,166,315;5,185,444;5,214,134;5,216,141;5, 235,033;5,264,562;5,264,564;5,405,938;5,434,257;5,466,677;5,470,967;5,489, 16 CN 111587116 A 说 明 书 12/45 页 677;5,541,307;5,561,225;5,596,086;5,602,240;5,610,289;5,602,240;5,608,046;5, 610,289;5,618,704;5,623,070;5,663,312;5,633,360;5,677,437;5,792,608;5,646,269 和5,677,439。 免疫检查点分子:如本文所用,术语“免疫检查点分子”是指免疫细胞(诸如T细胞) 上的分子,所述分子在正常生理条件下对于在免疫系统对外源病原体作出应答时维持自身 耐受性(或预防自身免疫性)和保护宿主细胞和组织是重要的。某些免疫检查点分子是共刺 激性分子,其可放大涉及对抗原的T细胞应答的信号,而某些免疫检查点分子是抑制性分子 (例如,CTLA-4或PD-1),其减少参与对抗原的T细胞应答的信号。 环:如本文所用,术语“环”是指由核酸的单一链形成的结构,在所述结构中,侧接 特定单链核苷酸区的互补区按使互补区之间的单链核苷酸区排除在双链体形成或Watson- Crick碱基配对之外的方式杂交。环是任何长度的单链核苷酸区。环的实例包括诸如发夹、 四元环或三元环的结构中存在的未配对核苷酸。 修饰核碱基:如本文所用,术语“修饰核碱基”是指不是天然核碱基或通用核碱基 的任何核碱基。合适的修饰核碱基包括二氨基嘌呤及其衍生物、烷基化嘌呤或嘧啶、酰化嘌 呤或嘧啶、硫醇化嘌呤或嘧啶等。其他合适的修饰核碱基包括嘌呤和嘧啶的类似物。合适的 类似物包括但不限于1-甲基腺嘌呤、2-甲基腺嘌呤、N6-甲基腺嘌呤、N6-异戊基腺嘌呤、2- 甲硫基-N6-异戊基腺嘌呤、N,N-二甲基腺嘌呤、8-溴腺嘌呤、2-硫胞嘧啶、3-甲基胞嘧啶、5- 甲基胞嘧啶、5-乙基胞嘧啶、4-乙酰胞嘧啶、1-甲基鸟嘌呤、2-甲基鸟嘌呤、7-甲基鸟嘌呤、 2,2-二甲基鸟嘌呤、8-溴鸟嘌呤、8-氯鸟嘌呤、8-氨基鸟嘌呤、8-甲基鸟嘌呤、8-硫鸟嘌呤、 5-氟尿嘧啶、5-溴尿嘧啶、5-氯尿嘧啶、5-碘尿嘧啶、5-乙基尿嘧啶、5-丙基尿嘧啶、5-甲氧 基尿嘧啶、5-羟甲基尿嘧啶、5-(羧基羟甲基)尿嘧啶、5-(甲基氨基甲基)尿嘧啶、5-(羧甲基 氨基甲基)-尿嘧啶、2-硫尿嘧啶、5-甲基-2-硫尿嘧啶、5-(2-溴乙烯基)尿嘧啶、尿嘧啶-5- 氧乙酸、尿嘧啶-5-氧乙酸甲酯、假尿嘧啶、1-甲基假尿嘧啶、Q核苷(queosine)、次黄嘌呤、 黄嘌呤、2-氨基嘌呤、6-羟基氨基嘌呤、硝基吡咯基、硝基吲哚基和二氟甲苯基、6-硫嘌呤和 2,6-二氨基嘌呤硝基吡咯基、硝基吲哚基和二氟甲苯基。通常,核碱基包括含氮碱基。在某 些实施方案中,核碱基不含氮原子。参见例如,美国公布的专利申请号20080274462。 修饰核苷:如本文所用,术语“修饰核苷”是指与糖(例如,脱氧核糖或核糖或其类 似物)处于N-糖苷键中的杂环含氮碱基,所述糖不与磷酸酯基团或修饰磷酸酯基团(如本文 所定义)连接,并且含有修饰核碱基(如本文所定义)、通用核碱基(如本文所定义)或修饰糖 部分(如本文所定义)中的一种或多种。修饰或通用核碱基(在本文中也称为碱基类似物)通 常位于核苷糖部分的1'-位,并且是指在1'-位的除腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶和尿 嘧啶以外的核碱基。在某些实施方案中,修饰或通用核碱基为含氮碱基。在某些实施方案 中,修饰核碱基不含氮原子。参见例如,美国公布的专利申请号20080274462。在某些实施方 案中,修饰核苷酸不含核碱基(无碱基)。本文描述了在本公开的上下文中合适的修饰或通 用核碱基或修饰糖。 修饰核苷酸:如本文所用,术语“修饰核苷酸”是指与糖(例如,核糖或脱氧核糖或 其类似物)处于N-糖苷键中的杂环含氮碱基,所述糖与磷酸酯基团或修饰磷酸酯基团(如本 文所定义)连接,并且含有修饰核碱基(如本文所定义)、通用核碱基(如本文所定义)、修饰 糖部分(如本文所定义)或修饰磷酸酯基团(如本文所定义)中的一种或多种。修饰或通用核 17 CN 111587116 A 说 明 书 13/45 页 碱基(在本文中也称为碱基类似物)通常位于核苷糖部分的1'-位,并且是指在1'-位的除腺 嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶和尿嘧啶以外的核碱基。在某些实施方案中,修饰或通用核 碱基为含氮碱基。在某些实施方案中,修饰核碱基不含氮原子。参见例如,美国公布的专利 申请号20080274462。在某些实施方案中,修饰核苷酸不含核碱基(无碱基)。本文描述了在 本公开的上下文中合适的修饰或通用核碱基、修饰糖部分或修饰磷酸酯基团。 修饰磷酸酯基团:如本文所用,术语“修饰磷酸酯基团”是指磷酸酯基团的修饰,其 不存在于天然核苷酸中并且包括如本文所述的非天然存在的磷酸酯模拟物,包括包含磷原 子的磷酸酯模拟物和不包含磷酸酯的阴离子磷酸酯模拟物(例如乙酸酯)。修饰磷酸酯基团 还包括如本文所述的非天然存在的核苷酸间连接基团,包括含磷的核苷酸间连接基团(包 括例如硫代磷酸酯)和不含磷的连接基团两者。本文描述了在本公开的上下文中合适的修 饰或通用核碱基、修饰糖部分或修饰磷酸酯。 修饰糖部分:如本文所用,“修饰糖部分”是指取代的糖部分(如本文所定义)或糖 类似物(如本文所定义)。 裸寡核苷酸:如本文所用,术语“裸寡核苷酸”是指未配制在保护性脂质纳米颗粒 或其他保护性配制品中且因此当在体内施用时暴露于血液和内体/溶酶体区室的寡核苷 酸。 天然核碱基:如本文所用,术语“天然核碱基”是指RNA和DNA的五种基本的、天然存 在的杂环核碱基,即嘌呤碱基:腺嘌呤(A)和鸟嘌呤(G);以及嘧啶碱基:胸腺嘧啶(T)、胞嘧 啶(C)和尿嘧啶(U)。 天然糖部分:如本文所用,术语“天然糖部分”是指呋喃核糖基(如本文所定义)或 脱氧核糖呋喃糖基(如本文所定义)。 天然核苷:如本文所用,术语“天然核苷”是指与不与磷酸酯基团连接的天然糖部 分(如本文定义)处于N-糖苷键的天然核苷碱基(如本文定义)。 天然核苷酸:如本文所用,术语“天然核苷酸”是指与与磷酸酯基团连接的天然糖 部分处于N-糖苷键的天然核苷碱基(如本文定义)。 非T细胞发炎表型:如本文所用,“非T细胞发炎表型”是指没有针对肿瘤的预先存 在的T细胞应答的肿瘤微环境,如通过浸润CD8 T细胞在肿瘤微环境中几乎没有积累所证 实。通常,非T细胞发炎的表型的特征还在于有限的趋化因子谱(其不促进肿瘤微环境中CD8 T细胞的募集和积累)和/或极小或不存在的I型IFN基因特征。 非Wnt激活的疾病或障碍:如本文所用,“非Wnt激活的”疾病或障碍是指不与Wnt/ β-连环蛋白途径的激活相关联的疾病或障碍。“非Wnt激活的”疾病或障碍包括某些癌症和/ 或增生性疾病、病症或障碍,包括某些结直肠癌、硬纤维瘤、子宫内膜癌、胃癌、肝细胞癌、肝 母细胞瘤、肾脏(威尔姆氏(Wilms’)肿瘤)、髓母细胞瘤、黑素瘤、神经母细胞瘤、卵巢癌(子 宫内膜样癌)、胰腺癌、钙化上皮瘤、前列腺癌、肾癌、甲状腺癌(间变性癌)和子宫癌(子宫内 膜癌)。在一个实施方案中,“非Wnt激活的”疾病或障碍是结直肠癌、肝细胞癌或黑素瘤。在 一个实施方案中,“非Wnt激活的”疾病或障碍是神经母细胞瘤、肾癌或黑素瘤。应当理解,疾 病或障碍,包括上文列出的癌症和/或增生性疾病,可以包括疾病或障碍的非Wnt激活的亚 型和疾病或障碍的Wnt激活的亚型,这与下文提供Wnt激活的疾病或障碍的定义一致。 核酸抑制剂分子:如本文所用,术语“核酸抑制剂分子”是指降低或消除靶基因的 18 CN 111587116 A 说 明 书 14/45 页 表达的寡核苷酸分子,其中寡核苷酸分子含有特异性靶向靶基因mRNA中的序列的区。通常, 核酸抑制剂分子的靶向区包含与靶基因mRNA上的序列充分互补的序列,以将核酸抑制剂分 子的作用引导至指定的靶基因。核酸抑制剂分子可以包括核糖核苷酸、脱氧核糖核苷酸和/ 或修饰核苷酸。 核碱基:如本文所用,术语“核碱基”是指天然核碱基(如本文定义)、修饰核碱基 (如本文定义)或通用核碱基(如本文定义)。 核苷:如本文所用,术语“核苷”是指天然核苷(如本文定义)或修饰核苷(如本文定 义)。 核苷酸:如本文所用,术语“核苷酸”是指天然核苷酸(如本文定义)或修饰核苷酸 (如本文定义)。 突出端:如本文所用,术语“突出端”是指在双链核酸抑制剂分子的任一链的任一 端的一个或多个末端非碱基配对核苷酸。在某些实施方案中,突出端由延伸超过互补链的 末端的一条链或区域产生,所述第一链或区域与所述互补链形成双链体。能够通过碱基对 的氢键形成双链体的两个寡核苷酸区域中的一者或两者可以具有延伸超过由两个多核苷 酸或区域共享的互补的3'和/或5'端的5'和/或3'端。延伸超过双链体的3'和/或5'-端的单 链区称为突出端。 药物组合物:如本文所用,术语“药物组合物”包含药理学有效量的β-连环蛋白核 酸抑制剂分子、IDO抑制剂或免疫治疗剂,诸如抗体(包括例如,抗CTLA-4、抗PD-1或抗PD-L1 抗体中一种或多种)和药学上可接受的赋形剂。如本文所用,“药理学有效量”、“治疗有效 量”或“有效量”是指β-连环蛋白核酸抑制剂分子、IDO抑制剂或免疫治疗剂诸如抗体(包括 例如,抗CTLA-4、抗PD-1或抗PD-L1抗体中的一种或多种)有效产生预期药理学、治疗或预防 结果的量。 药学上可接受的赋形剂:如本文所用,术语“药学上可接受的赋形剂”意指赋形剂 适用于与人和/或动物一起使用而无过度不良副作用(诸如毒性、刺激和过敏反应),与合理 益处/风险比相称。 磷酸酯模拟物:如本文所用,术语“磷酸酯模拟物”是指在寡核苷酸的5'-末端处的 模拟磷酸酯基团的静电和空间特性的化学部分。已经开发了许多磷酸酯模拟物,它们可以 连接到寡核苷酸的5 '-端 (参见例如,美国专利号8 ,9 2 7 ,5 1 3 ;P r a k a s h等人 NucleicAcidsRes.,2015,43(6):2993-3011)。通常,这些5'-磷酸酯模拟物含有磷酸酶抗性 键。合适的磷酸酯模拟物包括5'-膦酸酯,诸如5'-亚甲基膦酸酯(5'-MP)和5'-(E)-乙烯基 膦酸酯(5'-VP)以及与寡核苷酸的5'-末端核苷酸的糖部分(例如,核糖或脱氧核糖或其类 似物)的4'-碳结合的4'-磷酸酯类似物,诸如4'-氧甲基膦酸酯、4'-硫代甲基膦酸酯或4'- 氨基甲基膦酸酯,如PCT国际公开号WO2018/045317中所述,所述专利以引用的方式整体并 入本文。在某些实施方案中,4'-氧甲基膦酸酯由式–O-CH2-PO(OH)2或–O-CH2-PO(OR)2表示, 其中R独立地选自H、CH3、烷基或保护基。在某些实施方案中,烷基为CH2CH3。更通常,R独立地 选自H、CH3或CH2CH3。对于寡核苷酸的5'-端,已开发其他修饰(参见例如,WO2011/133871)。 加强:如本文所用,术语“加强(potentiate或potentiating)”是指一种或多种治 疗剂(例如,β-连环蛋白核酸抑制剂分子和IDO抑制剂)增加或增强另一种治疗剂(例如,抑 制性免疫检查点分子,诸如CTLA-4或PD-1的拮抗剂,或共刺激检查点分子的激动剂)的治疗 19 CN 111587116 A 说 明 书 15/45 页 效果的能力。 保护基:如本文所用,术语“保护基”在常规化学意义上用作在所需反应的某些条 件下可逆地使官能团不可反应的基团。在所需的反应之后,可以除去保护基以使受保护的 官能团脱保护。所有保护基应在不降解大部分合成分子的条件下可除去。 降低:如本文所用,术语“降低(reduce或reduces)”是指其本领域通常接受的含 义。关于示例性核酸抑制剂分子(例如,β-连环蛋白RNAi抑制剂分子),所述术语通常是指使 基因的表达、或编码一种或多种蛋白质或蛋白质亚基的RNA分子或等同RNA分子的水平或一 种或多种蛋白质或蛋白质亚基的活性降低至低于在核酸抑制剂分子不存在下所观察到的 那些。 抗性:关于免疫疗法使用的术语“抗性(resistance)”或“有抗性的(resistant)” 是指癌症和/或增生性疾病、病症或障碍对免疫疗法没有显示出医学上显著应答。如本文所 公开的,可以通过降低β-连环蛋白和IDO表达来逆转对免疫疗法的抗性。 核糖呋喃糖基:如本文所用,术语“核糖呋喃糖基”是存在于天然存在的RNA中并且 在2'-碳上具有羟基的呋喃糖基,如下所示: 核糖核苷酸:如本文所用,术语“核糖核苷酸”是指在糖部分的2'-位具有羟基的天 然核苷酸(如本文所定义)或修饰核苷酸(如本文所定义)。 RNAi抑制剂分子:如本文所用,术语“RNAi抑制剂分子”是指(a)具有有义链(信使 链)和反义链(引导链)的双链核酸抑制剂分子(“dsRNAi抑制剂分子”),其中反义链或反义 链的一部分被Argonaute2(Ago2)内切核酸酶用于裂解靶mRNA或(b)具有单条反义链的单链 核酸抑制剂分子(“ssRNAi抑制剂分子”),其中反义链(或反义链的一部分)被Ago2内切核酸 酶用于裂解靶mRNA。 有义链:dsRNAi抑制剂分子包含两条寡核苷酸链:反义链和有义链。有义链或其区 与dsRNAi抑制剂分子的反义链或其区部分、基本上或完全互补。在某些实施方案中,有义链 还可以含有与反义链不互补的核苷酸。非互补核苷酸可以在互补序列的任一侧或可以在互 补序列的两侧。在某些实施方案中,当有义链或其区与反义链或其区部分或基本互补时,非 互补核苷酸可以位于一个或多个互补区之间(例如一个或多个错配)。有义链还被称为信使 链。 受试者:如本文所用,术语“受试者”意指任何哺乳动物,包括小时、兔子和人。在一 个实施方案中,受试者是人。术语“个体”或“患者”旨在与“受试者”可互换。 取代基或取代的:如本文所用,术语“取代基”或“取代的”是指给定结构中的氢基 团被取代基的基团替代。除非另外指明,否则当在给定结构中超过一个位置可以被超过一 个取代基取代时,在每个位置处的取代基可以相同或不同。如本文所用,术语“取代的”设想 20 CN 111587116 A 说 明 书 16/45 页 包括与有机化合物相容的所有可允许的取代基。可允许的取代基包括有机化合物的无环和 有环的、支链和非支链的、碳环和杂环的、芳族和非芳族的取代基。本公开并非旨在以任何 方式受有机化合物的可允许的取代基的限制。 取代的糖部分:如本文所用,“取代的糖部分”包括含有一个或多个修饰的呋喃糖 基。通常,修饰发生在糖的2'-、3'-、4'-或5'-碳位置。在某些实施方案中,取代的糖部分是 双环糖部分,其包含连接呋喃糖基的2'-碳和4-碳的桥。 糖类似物:如本文所用,术语“糖类似物”是指这样的一种结构,其不包含呋喃糖基 并且能够替代核苷酸的天然存在的糖部分以使得所产生的核苷酸能够(1)并入寡核苷酸中 和(2)与互补核苷酸杂交。此类结构通常包括对呋喃糖基的相对简单的变化,诸如下述环, 所述环包含不同的原子数(例如,4元环、6元环或7元环);用非氧原子(例如,碳、硫或氮)替 代呋喃糖基的氧;或原子数和氧替代均变化。此类结构还可以包含与对于取代的糖部分描 述的那些对应的取代基。糖类似物还包括更复杂的糖替代物(例如,肽核酸的非环系统)。糖 类似物包括但不限于吗啉代、环己烯基和环己六醇。 糖部分:如本文所用,术语“糖部分”是指核苷酸或核苷的天然糖部分或修饰糖部 分。 靶位点:如本文所用,术语“靶位点”、“靶序列”、“靶核酸”、“靶区”、“靶基因”可互 换使用,并且是指被“靶向”例如用于由RNAi抑制剂分子介导的裂解的RNA或DNA序列,是 RNAi抑制剂分子在其引导/反义区内含有与该靶序列部分、基本上或完全或充分互补的序 列。 T细胞发炎的肿瘤表型:如本文所用,“T细胞发炎表型”是指具有针对肿瘤的预先 存在的T细胞应答的肿瘤微环境,如通过浸润CD8 T细胞在肿瘤微环境中积累所证实。通 常,T细胞发炎的表型的特征还在于广泛的趋化因子谱(其能够将CD8 T细胞募集到肿瘤微 环境(包括CXCL9和/或CXCL10))和/或I型IFN基因特征。 TDO抑制剂:如本文所用,术语“TDO抑制剂”是指降低色氨酸2,3-双加氧酶(“TDO”) 的活性的化合物或剂。 四元环:如本文所用,术语“四元环”是指这样的环,所述环形成有助于相邻 Watson-Crick杂交的核苷酸的稳定的稳定二级结构。在不受理论限制的情况下,四元环可 以通过堆叠相互作用使相邻Watson-Crick碱基对稳定。此外,四元环中核苷酸间的相互作 用包括但不限于,非Watson-Crick碱基配对、堆叠相互作用、氢键和接触相互作用(Cheong 等人,Nature,1990,346(6285):680-2;Heus和Pardi,Science,1991,253(5016):191-4)。四 元环使相邻双链体的解链温度(Tm)升高,其高于根据由随机碱基组成的简易模型环序列所 预期的。例如,在10mM NaHPO4中,四元环可以使包含长度为至少2个碱基对的双链体的发夹 的解链温度为至少50℃、至少55℃、至少56℃、至少58℃、至少60℃、至少65℃或至少75℃。 四元环可以含有核糖核苷酸、脱氧核糖核苷酸、修饰核苷酸及其组合。在某些实施方案中, 四元环由四个核苷酸组成。在某些实施方案中,四元环由五个核苷酸组成。 RNA四元环的实例包括UNCG家族四元环(例如,UUCG)、GNRA家族四元环(例如, GAAA)和CUUG四元环。(Woese等人,PNAS,1990,87(21):8467-71;Antao等人,Nucleic Acids Res.,1991,19(21):5901-5)。DNA四元环的实例包括d(GNNA)家族四元环(例如,d(GTTA))、d (GNRA)家族四元环、d(GNAB)家族四元环、d(CNNG)家族四元环和d(TNCG)家族四元环(例如, 21 CN 111587116 A 说 明 书 17/45 页 d(TTCG))。(Nakano等人Biochemistry ,2002,41(48):14281-14292.Shinji等人,Nippon Kagakkai Koen Yokoshu,2000,78(2):731)。 治疗有效量:如本文所用,“治疗有效量”或“药理有效量”意指一种或多种化合物 的有效产生预期的药理、治疗或预防结果的量。 三元环:如本文所用,术语“三元环”是指这样的环,所述环形成有助于相邻 Watson-Crick杂交的核苷酸的稳定并且由三个核苷酸组成的稳定二级结构。在不受理论限 制的情况下,三元环可以通过三元环内的非Watson-Crick碱基配对和碱基堆叠相互作用而 稳定。(Yoshizawa等人,Biochemistry1997;36,4761-4767)。三元环还使相邻双链体的解链 温度(Tm)升高,其高于根据由随机碱基组成的简易模型环序列所预期的。三元环可以含有 核糖核苷酸、脱氧核糖核苷酸、修饰核苷酸及其组合。三元环的实例包括GNA家族三元环(例 如,GAA、GTA、GCA和GGA)。(Yoshizawa1997)。在某些实施方案中,三元环具有GAA的核苷酸序 列。 通用核碱基:如本文所用,“通用核碱基”是指这样的碱基,其可以与天然存在的核 酸中通常存在的超过一个碱基配对并且因此可以取代双链体中此类天然存在的碱基。所述 碱基不需要能够与每个天然碱基配对。例如,某些碱基仅或选择性地与嘌呤配对,或仅或选 择性地与嘧啶配对。通用核碱基可以经由Watson-Crick或非Watson-Crick相互作用(例如, Hoogsteen相互作用)形成氢键形成碱基对。代表性的通用核碱基包括肌苷及其衍生物。 Wnt激活的疾病或障碍:如本文所用,“Wnt激活的”疾病或障碍是指与激活的Wnt/ β-连环蛋白途径相关联的疾病或障碍。“Wnt激活的”疾病或障碍包括癌症和/或增生性疾 病、病症或障碍,包括结直肠癌、硬纤维瘤、子宫内膜癌、胃癌、肝细胞癌、肝母细胞瘤、肾脏 (威尔姆氏肿瘤)、髓母细胞瘤、黑素瘤、卵巢癌(子宫内膜样癌)、胰腺癌、钙化上皮瘤、前列 腺癌、甲状腺癌(间变性癌)和子宫癌(子宫内膜癌)。在一个实施方案中,“Wnt激活的”疾病 或障碍是结直肠癌、肝细胞癌或黑素瘤。应当理解,疾病或障碍,包括上文列出的癌症和/或 增生性疾病,可以包括疾病或障碍的Wnt激活的型式和疾病或障碍的非Wnt激活的型式,这 与上文提供的非Wnt激活的疾病或障碍的定义一致。 Wnt/β-连环蛋白途径:如本文所用,“Wnt/β-连环蛋白途径”是指通过Wnt配体、受 体和共受体的组合介导的细胞中的分子信号传导途径,所述配体和受体启动涉及β-连环蛋 白的下游信号传导途径(参见例如,图14)。在Wnt信号传导不存在下,β-连环蛋白被靶向经 由细胞质中的泛素化进行降解。在Wnt配体和Wnt信号转导的存在下,β-连环蛋白稳定化并 行进到细胞核,在那里它可以与转录因子(诸如T细胞转录因子(TCF)和淋巴增强转录因子 (LEF))相互作用,并且激活基因转录。Wnt/β-连环蛋白途径的失调和激活最通常是由β-连 环蛋白基因或编码腺瘤性结肠息肉病(APC)的基因(其负调控β-连环蛋白的功能)中的突变 引起的,但也可能由编码Wnt/β-连环蛋白途径的其他成分(诸如Axin、LEF和ICAT)的基因中 的突变引起。












