技术摘要:
本发明公开了非融合型抗桥粒芯糖蛋白DSG3兔源单克隆抗体的制备方法,包括以下步骤:1)选择适合的免疫动物,对其进行DSG3的免疫;2)提取免疫成功的动物血液,收集外周血单个核细胞,分离出能够分泌DSG3抗体的B淋巴细胞群;3)建立兔源单链抗体酵母展示库;4)构建DSG3 全部
背景技术:
抗桥粒芯糖蛋白(DSG)为钙粘蛋白超家族成员之一,DSG所组成的桥粒在细胞间粘 附过程中发挥重要作用。目前已发现四种DSG,其中DSG1及DSG3与皮肤科关系极为密切,是 包括天疱疮在内的多种自身免疫以及部分遗传性大疱性疾病的靶点,同时越来越多的研究 显示DSG可能在细胞的增殖、调亡与迁移过程中发挥重要作用,因此可能与鳞状细胞癌的发 生、发展具有临床相关性。目前血清抗桥粒芯蛋白DSG3抗体检测已用于天疱疮的诊断,在天 疱疮等疾病治疗性候选药物及诊断试剂盒开发中发挥着关键性的作用。 现有血清抗桥粒芯蛋白DSG3抗体为DSG3的鼠源单克隆抗体和DSG3的兔源多克隆 抗体,其中鼠源单克隆抗体是通过B淋巴细胞融合肿瘤细胞,筛选能够分泌该抗体的融合细 胞,通过该融合细胞的细胞株获得抗体,而兔多克隆抗体则是用免疫动物后的血清制备抗 体。这两种制备抗体的方法,筛选的过程具有极大的随机性和不确定性,因此在无法获得该 抗体的融合细胞株的情况下,是不能进行抗体的制备的,其不具有工业重现性,严重制约了 该抗体的产业化生产和应用。
技术实现要素:
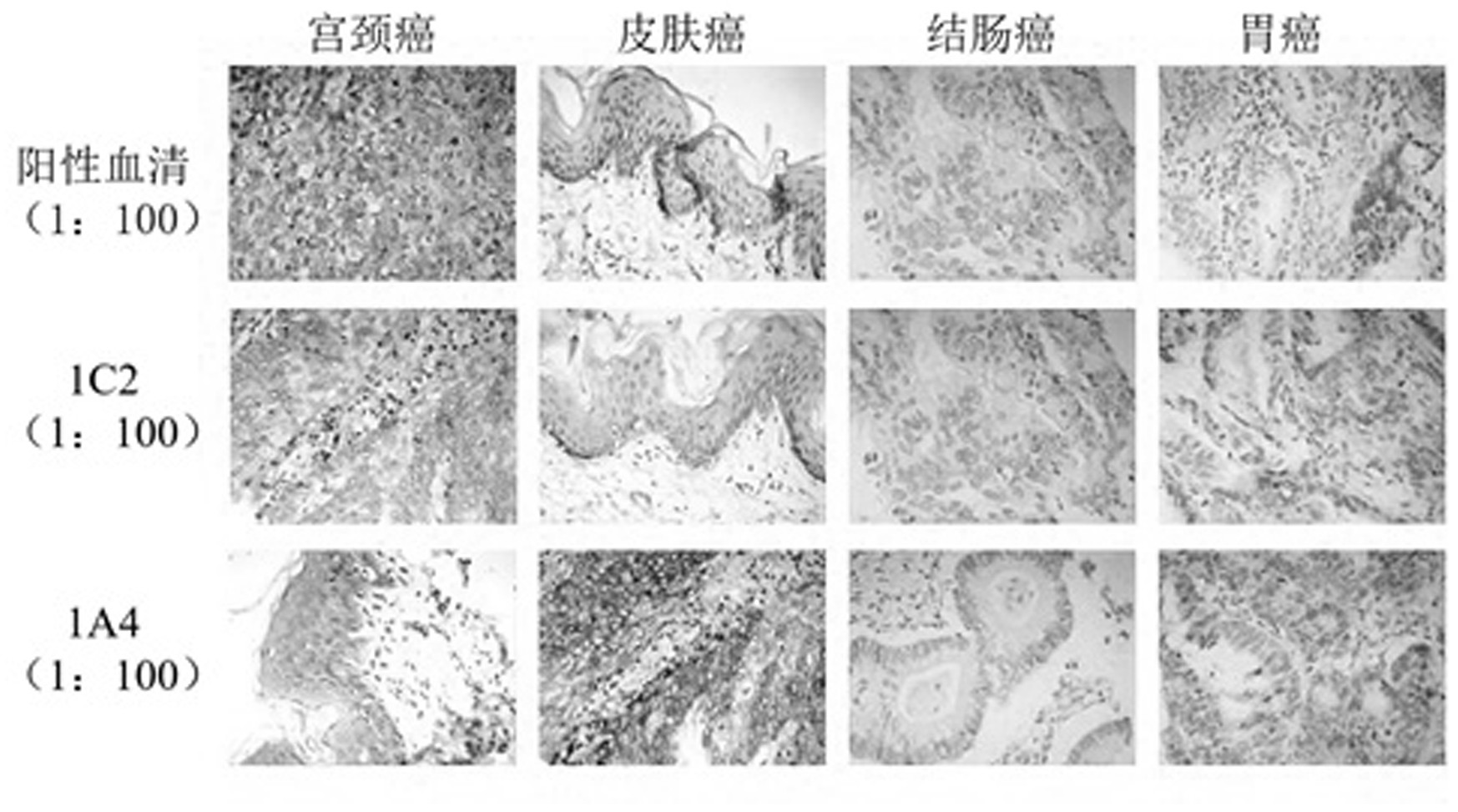
针对现有技术的不足,本发明的目的在于提供一种通过基因工程手段,制备得到 的兔源DSG3单克隆抗体,该抗体相较于鼠源DSG3单克隆抗体具有更高的亲和力和特异性, 以及具有更多识别新型表位和小分子抗原的优点,该制备方法能够制备稳定的DSG3抗体, 具有工业重现性,适合产业化推广应用。 为了实现上述目的,本发明通过下述技术方案实现:非融合型抗桥粒芯糖蛋白 DSG3兔源单克隆抗体的制备方法,其特征在于,包括以下步骤: (1)选择适合的免疫动物,对其进行DSG3的免疫; (2)提取免疫成功的动物血液,收集外周血单个核细胞,分离出能够分泌DSG3抗体 的B淋巴细胞群; (3)建立兔源单链抗体酵母展示库:获取B淋巴细胞群中具有编码抗体重链可变区 和轻链可变区的DNA,组合成单链可变区片段,即ScFv片段,然后将其连入酵母表面展示载 体pYD1,再将酵母表面展示载体pYD1转化入EBY100酵母细胞,培养后,筛选出能够与DSG3重 组蛋白和V5 Tag抗体均能结合的双阳性酵母细胞; (4)构建DSG3兔源单克隆抗体表达载体库:从筛选得到的双阳性酵母细胞中提取 质粒DNA,在该质粒DNA中连入DNA控制表达序列,获得可表达抗体分子的DNA片段,接着该 DNA片段连入毕赤酵母表达载体PZ中,形成毕赤酵母表达载体PZ重组质粒; (5)构建DSG3兔源单克隆抗体酵母表达库:将毕赤酵母表达载体PZ重组质粒转化 5 CN 111606994 A 说 明 书 2/13 页 入酵母表达菌X33中,筛选能够分泌DSG3抗体的X33重组转化单克隆菌; (6)获得能够稳定分泌DSG3抗体的X33重组转化单克隆菌株; (7)对获得的DSG3兔源单克隆抗体进行纯化。 为了更好地实现本发明的制备方法,进一步地,所述步骤(1)中,选择的免疫动物 为年龄在三个月左右、体重2.5kg左右,健康的雄性新西兰大白兔。 为了更好地实现本发明的制备方法,进一步地,所述步骤(1)中,具体的免疫过程 如下: (1.1)首次免疫前,经耳静脉取血作为阴性对照; (1 .2)制备首次免疫制剂和后续的加强免疫制剂,首次免疫制剂为,采用500μg抗 原加入等体积的弗氏完全佐剂,混匀和乳化后制得;加强免疫制剂为,采用250μg等体积混 合弗氏不完全佐剂,混匀和乳化后制得;其中,抗原包被量为10ng/孔; (1.3)使用首次免疫制剂对选取的兔子进行四肢、腋下及背部皮下多点注射,进行 首次免疫; (1 .4)首次免疫三周后,使用加强免疫制剂对兔子进行第二次免疫,之后每隔两 周,对兔子进行第三次和第四次的免疫; (1.5)第三次免疫7天后,经耳静脉取血,测定抗体效价。 为了更好地实现本发明的制备方法,进一步地,所述步骤(2)中,收集外周血单个 核细胞的具体过程为:用含抗凝剂的血液收集管从免疫后的兔子耳静脉处收集外周血,用 PBS缓冲液以1:1的比例进行稀释,在室温环境下,通过密度梯度离心法从外周血中分离得 到外周血单个核细胞。 为了更好地实现本发明的制备方法,进一步地,所述步骤(2)中,从外周血单个核 细胞中分离出能够分泌DSG3抗体的B淋巴细胞群的具体过程为:用labelledkits对抗原做 FITC标记,将得到的外周血单个核细胞重悬于FACS缓冲液中,加入7-AAD-PerCP、anti-IgM- PE、anti-IgG-APC以及FITC标记的抗原进行染色,抗体和标记的抗原按0.7-1 .2μg/1× 108cells加入,在冰上避光孵育25-35min,用FACS缓冲液洗涤两次,最后重悬于FACS缓冲液 中,通过流式分选获取anti-IgM-PE,anti-IgG-APC以及FITC标记抗原呈阳性的活细胞群, 该活细胞群即为能够分泌DSG3抗体的B淋巴细胞群。 为了更好地实现本发明的制备方法,进一步地,所述步骤(3)建立兔源单链抗体酵 母展示库的具体过程为: (3.1)裂解B淋巴细胞群,提取总的RNA,并进行逆转录得到cDNA; (3.2)扩增cDNA得到含有ScFv片段的DNA,提取该含有ScFv片段的DNA并回收纯化; (3.3)通过双酶切的方法处理含有ScFv片段的DNA和酵母表达展示载体pYD1,然后 将含有ScFv片段的DNA的片段与酵母表达展示载体pYD1连接,通过TOP10大肠杆菌感受态细 胞筛选出连接成功的pYD1质粒,并将pYD1质粒提取出来; (3.4)使用单酶处理pYD1质粒,使其线性化,将线性化的pYD1质粒加入EBY100酵母 感受态中,获得内部具有pYD1质粒的EBY100酵母细胞; (3.5)培养步骤(3.4)获得的酵母细胞,并从该培养物中,应用流式细胞术筛选出 可与DSG3重组蛋白以及V5 Tag抗体均能结合的双阳性酵母细胞。 为了更好地实现本发明的制备方法,进一步地,所述步骤(4)中构建DSG3兔源单克 6 CN 111606994 A 说 明 书 3/13 页 隆抗体表达载体库的具体过程为: (4.1)提取双阳性酵母细胞中的pYD1质粒进行双酶切,获得具有接头的pYD1质粒 的DNA片段; (4 .2)使用连接酶在该具有接头的质粒DNA片段中接入一段新的DNA控制表达序 列; (4.3)接着通过转化入大肠杆菌XL-blue感受态,结合抗性压力筛选的方法,获得 具有成功连接质粒的大肠杆菌落群,并将其扩增培养,然后提取出培养菌中的质粒DNA; (4.4)再用限制性内切酶对步骤(4.3)中获得的质粒进行酶切,得到长度为2.6kb 的目的DNA片段; (4.5)使用连接酶将目的DNA片段连入毕赤酵母表达载体PZ中,获得毕赤酵母表达 载体PZ重组质粒,同样使用转化入大肠杆菌XL-blue感受态,结合抗性压力筛选的方法,得 到含有成功连接PZ重组质粒的大肠杆菌菌落群,将该大肠杆菌的增殖培养后,获得大量含 有目的DNA片段的毕赤酵母表达载体PZ重组质粒。 为了更好地实现本发明的制备方法,进一步地,所述步骤(5)中构建DSG3兔源单克 隆抗体酵母表达库的具体过程为: (5.1)对毕赤酵母表达载体PZ重组质粒进行单酶切,使其线性化; (5.2)对线性化的毕赤酵母表达载体PZ重组质粒进行回收和纯化; (5.3)将纯化后的线性化的毕赤酵母表达载体PZ重组质粒转入酵母表达菌X33中, 进行培养。 为了更好地实现本发明的制备方法,进一步地,所述步骤(6)中获得能够稳定分泌 DSG3抗体的X33重组转化单克隆菌株的具体过程为: (6 .1)将筛选得到的X33重组转化单克隆菌接种至96孔板中,含BMGY培养基2mL/ 孔,25~28℃培养,24h后吸取500μL保种,并将培养液更换成诱导表达培养基BMMY,20~22 ℃培养; (6.2)培养90~98h,取培养X33重组转化单克隆菌的上层清液,进行ELISA间接法 检测,其中DSG3重组蛋白作为抗原,其包被量为5ng~15ng/孔; (6.3)各培养孔中取出的培养上清为检测一抗,并进行等比稀释,免疫后血清作为 阳性对照,免疫前血清为阴性对照; (6.4)获得与抗原结合的阳性克隆培养物,用接种环蘸取微量进行划线培养,挑选 X33重组转化单克隆菌进行扩大培养体积至10mL,并做细胞株稳定处理; (6.5)继续扩大体积至100mL,同条件诱导表达。 为了更好地实现本发明的制备方法,进一步地,所述步骤(7)中对DSG3兔源单克隆 抗体进行纯化是通过Protein A亲和层析法对收集得到的有抗体分泌的上清液进行纯化, 具体过程如下: (7.1)将收集到的细胞上清液离心,去除细胞碎片; (7.2)用0.45μm滤头除去未沉淀的蛋白等一些杂质,留样1mL,记录样本总体积,并 用10mM NaOH将上清的pH调至7.0左右; (7.3)用0.1M PB缓冲液平衡Protein A亲和层析柱,充分除去乙醇和杂质,平衡至 OD280<0.1; 7 CN 111606994 A 说 明 书 4/13 页 (7.4)将上述处理过的样本匀速上样,避免产生气泡,收集流穿液; (7.5)上样结束,用0.1M PB缓冲液(pH 7.0)洗涤Protein A亲和层析柱,流速控制 为2mL/min,体积大于50mL,洗涤至OD280<0.1,保留洗涤液待测; (7 .6)用0.1M甘氨酸缓冲液(pH 2 .2~3.0)洗脱Protein A亲和层析柱,流速为 1mL/min,体积不限,分管收集,同时用1M Tris将PH调至7.0左右,洗脱至OD280<0.1,保留液 体待测; (7.7)洗脱后用分光光度计检测OD280,并用8%的SDS-PAGE凝胶电泳,进行抗体产 量初步计算和结构完整度检测; (7.8)然后将样本置于透析袋中,在PBS(pH 7.4)中透析,每6-8h换一次液,换2-3 次; (7.9)用0.22μm的无菌过滤器过滤纯化的抗体,分装保存至-80℃冰箱。 本发明与现有技术相比,具有以下优点及有益效果: 本发明通过基因工程手段,制备得到的兔源DSG3单克隆抗体,该制备方法能够制 备稳定的DSG3抗体,具有工业重现性,适合产业化推广应用,该抗体相较于鼠源DSG3单克隆 抗体具有更高的亲和力和特异性,以及具有更多识别新型表位和小分子抗原的优点。 附图说明 通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其他特征、 目的和优点将会变得更为明显: 图1为本发明中DSG3兔源单克隆抗体1A4对倍稀释成不同比例,使用酶联免疫法验 证验证特异性结果图; 图2为本发明中DSG3兔源单克隆抗体1C2对倍稀释成不同比例,使用酶联免疫法验 证验证特异性结果图; 图3为本发明中DSG3兔源单克隆抗体1C2与DSG3兔源单克隆抗体1A4组织免疫化学 验证结果图。












