技术摘要:
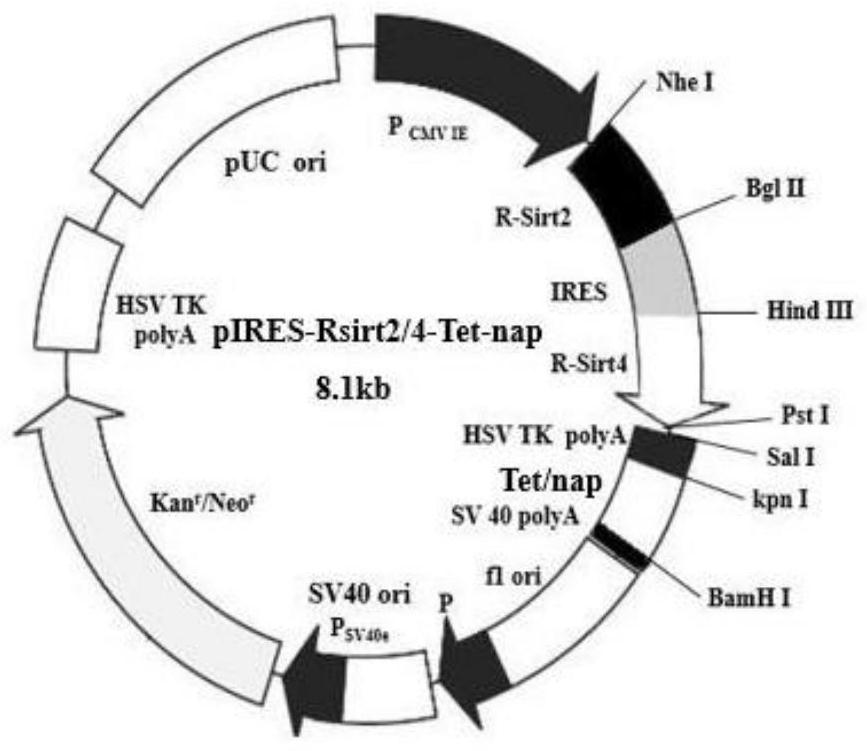
本发明公开了一种pIRES‑Rsirt2/4‑Tet‑nap重组质粒,其沿载体转录方向依次连接有R‑Sirt2基因、IRES序列、R‑Sirt4基因、HSV TK polyA序列、tTA序列、TRE序列和nap序列,或者反向连接。其中,R‑Sirt2和R‑Sirt4基因的功能是重构线粒体网络并逆转衰老细胞表型;IRES 全部
背景技术:
随着人们对IRES结构和功能研究的不断深入,利用IRES结构研究疾病治疗药物、 构建可转入细胞内的病毒模型,以及在基因治疗方面的应用越来越多。经过查询专利,我们 发现如今IRES在构建载体上得到了非常广泛的应用。IRES (internal ribosome entry site)序列是1988年分别由Nahum Sonenberg和Eckard Wimmer实验室在脊髓灰质炎病毒 (PV)和脑心肌炎病毒(EMCV)的RNA基因组中发现的。IRES通常位于RNA病毒的5'UTR中,允许 RNA以5'帽子非依赖性方式翻译。利用IRES连接两个基因,在上游启动子的控制下,IRES和 两个基因转录成为同一条mRNA。翻译时,IRES上游基因翻译起始遵循真核生物基因的帽依 赖性方式,而下游基因则通IRES招募核糖体进入起始基因的翻译,实现了IRES序列连接的 两个基因共用同一个转录单位表达。 目前利用IRES为靶点进行的药物研究主要集中在丙型肝炎病毒感染的治疗药物。 Dash等证实IFN .II、IFN .B和IFN-t能够靶向作用于HCV的5’端IRES,抑制蛋白的翻译。 Prabhu等证实靶向于IRES颈环结构II的siRNA能够在体外抑制HCV的六个基因型,因此颈环 结构II可以作为抑制HCV的靶点研究药物。Ray等找到一种与IRES颈环结构11I相对应的的 RNA分子,能够剂量依赖的抑制IRES介导的翻译,而对帽结构依赖的翻译无作用。颈部和第 四环(SLrV)区域、起始密码子附近的GCAC序列,对于介导核糖体在HCV RNA上的聚集具有重 要功能,Subramanian等实验证实了短发夹结构sh.SLIV在Huh7细胞中对HCV RNA的复制起 到显著的抑制作用。Das等已经发现一种小的酵母RNA能够特异地抑制脊髓灰质炎病毒(PV) IRES介导的翻译。同时这种IRNA能够在体内和体外特异抑制HCV IRES介导的翻译,能够竞 争La自身抗原与HCV IRES的结合,这为抗HCV感染研究药物提供了新的基础。根据IRES结构 的特点,针对结构域II、结构域III-IV和结构域IV设计了不同的RNA适配子,均证实具有抑 制IRES介导翻译的活性。另外,能够靶向性抑制IRES活性的还有人工核糖核酸酶、DNAzyme (Dz)分子、反义寡核苷酸、合成肽(LAP)、肽核酸(PNA)等,这些分子的研究为抗HCV病毒药物 研究奠定了基础。 四环素(tetracycline,Tet)诱导调控表达系统的基本原理是由诱导药物如Tet改 变调控蛋白质的构象,从而控制目标蛋白质的表达。最初Tet诱导调控基因表达系统是以大 肠杆菌Tn10转座子上Tet抗性操纵子为基础而建立的。Tet阻遏蛋白(Tet repressor protein,TetR)与Tet操纵基因(Tet operator,TetO) DNA序列有特异的亲和能力,当细胞 内无Tet存在时,TetR会与TetO结合,从而阻断下游的抗性基因表达。当有Tet存在时,药物 使TetR的构象发生改变,导致TetR与TetO分离,从而引起抗性基因的抑制解除,抗性蛋白表 达使细菌产生耐药性。利用TetR和TetO特异结合的特性,研究人员发展了多种类型的Tet调 4 CN 111593068 A 说 明 书 2/10 页 控系统,但根据其表达特点可以归为两大类:抑制型系统Tet-off和激活性系统Tet-on。 Tet-off基因调控表达系统是Gossen等最早建立起的诱导表达系统,四环素的转 录激活子(tetracycline transcrip-tional activator,tTA)是一种融合蛋白。四环素的 应答元件(Tet-responsive element,TRE)是由人巨细胞的病毒IE启动子微小启动序列 (Pcmv)、目的基因和大肠杆菌的tet纵子序列三部分连接而成。当不加入强力霉素 (Doxycycline,Dox)或四环素时,目的基因转录。Tet-on系统与Tet-off系统的区别在于其 调节蛋白质为反义四环素转录活化因子(reverse tetracy-cline transcriptional activator,rtTA)。它的转录调节元件rtTA由反义的Tet阻遏蛋白(reverse TetR,rTetR)与 VP16融合而成。应答元件TRE与正义四环素诱导表达调控系统的相似,但是其作用机制与正 义四环素诱导表达调控系统相反。 为使得目的基因在细胞内的表达得到有效控制,我们构建一个新型基因治疗载体 pIRES-Rsirt2/4-Tet-nap,将分子伴侣自噬的含有五肽基序的核酸自噬肽引入载体内,通 过外源给予4-表强力霉素诱导载体发生其自噬,再通过检测目基因在细胞内的表达水平, 以此来评估新型表达载体的作为控制目的基因有效可控表达的可行性。
技术实现要素:
本发明的首要目的在于克服现有技术的缺点与不足,提供一种pIRES-Rsirt2/4- Tet-nap重组质粒。该重组质粒转染入细胞内,能有效重构线粒体网络并逆转衰老哺乳动物 细胞衰老表型。 本发明的另一目的在于提供所述的pIRES-Rsirt2/4-Tet-nap重组质粒的构建方 法。 本发明的再一目的在于提供所述的pIRES-Rsirt2/4-Tet-nap重组质粒的应用。 pIRES-Rsirt2/4-Tet-nap双基因共表达自噬载体,其沿载体转录方向依次连接有 R-Sirt2基因、IRES序列、R-Sirt4基因、HSV TK polyA序列、tTA序列、TRE序列和nap序列,或 者相反连接。其中,R-Sirt2和R-Sirt4基因的功能是重构线粒体网络并逆转衰老细胞表型; IRES序列则是连接sirtuin2基因和sirtuin4基因,使两者反向共表达;tTA和TRE是四环素 诱导表达元件,调控DNA结合和分子伴侣介导自噬的肽段nap序列表达。 本发明所述的自噬重组载体,采用IRES序列连接sirtuin2和sirtuin4基因,能在 同一载体中共表达Sirtuin2和Sirtuin4蛋白,表达后由四环素元件诱导调控质粒DNA载体 的细胞内自噬,实现外源质粒DNA载体在哺乳类细胞的高效可控表达。pIRES-Rsirt2/4- Tet-nap双基因共表达自噬重组载体在重构线粒体网络、激活细胞代谢并逆转细胞表型中 的作用明显,因此其在预防和治疗衰老相关疾病或代谢综合征等线粒体功能障碍相关疾病 药物中具有应用广阔。故该重组质粒DNA载体可用于基因治疗线粒体功能障碍相关疾病相 关的载体、药物、食品、保健品中药物中的应用。 附图说明 图1为实施例1pAcGFP1-C3载体信息。 图2为实施例1 pTRE-Tight载体信息。 图3为实施例1 pTet-On载体信息。 5 CN 111593068 A 说 明 书 3/10 页 图4为实施例1构建的pIRES-Rsirt2/4-Tet-nap载体信息。 图5为实施例1粘红酵母sirtuin2和sirtuin4基因的PCR扩增结果(泳道1:DL2000 Marker;泳道2:sirtuin2基因扩增产物;泳道3:sirtuin4基因扩增产物)。 图6为实施例1 pMD18-T-Rsirt2/4载体酶切结果(M:DL5000 Marker;泳道1:EcoRⅠ 和EcoRⅤ双酶切pMD18-T-Rsirt2/4结果)。 图7为实施例1 pIRES-Rsirt2/4-C3载体酶切结果。A、DL2000 Marker鉴定双酶切 结果(M:DL2000 Marker;泳道1:EcoRⅤ和EcoRⅠ双酶切结果);B、DL5000 Marker鉴定双酶切 结果(M:DL5000 Marker;泳道1:EcoRⅤ和EcoRⅠ双酶切结果)。 图8为实施例1启动子调控区片段PCR扩增结果(M:DL2000 Marker;1:启动子调控 区片段扩增产物)。 图9为实施例1转录元件片段PCR扩增结果(M:DL2000 Marker;1:转录元件片段扩 增产物)。 图10为实施例1重组质粒pIRES-Rsirt2/4-Tet-nap双酶切鉴定(M1:DL2000 Marker;1:NheⅠ和BglⅡ双酶切重组质粒pIRES-Rsirt2/4-Tet-nap结果;2:BglⅡ和HindⅢ 双酶切重组质粒pIRES-Rsirt2/4-Tet-nap结果;3:HindⅢ和PstⅠ双酶切重组质粒pIRES- Rsirt2/4-Tet-nap结果;4:KpnⅠ和BamHⅠ双酶切重组质粒pIRES-Rsirt2/4-Tet-nap结果; M2:DL10000 Maker)。 图11为实施例1 SDS-PAGE鉴定表达蛋白(M:蛋白Marker;泳道1:表达Rt-sirt2/4 质粒的大肠杆菌菌株;泳道2:表达空质粒的大肠杆菌菌株;泳道3:未转染的大肠杆菌菌 株)。 图12为实施例1 Western blot检测目的基因的表达。A、在转染后第1天检测 HEK293T细胞中目的基因的表达;B、在转染后第2天检测HEK293T细胞中目的基因的表达;C、 在转染后第4天检测HEK293T细胞中目的基因的表达;D、在转染后第8天检测HEK293T细胞中 目的基因的表达(泳道1:表达Rt-sirt2/4质粒的HEK293T细胞;泳道2:表达空质粒的 HEK293T细胞;泳道3:未转染的HEK293T细胞)。 图13为实施例1自噬后目的基因的表达。A、给予4-表强力霉素后第6 h检测 HEK293T细胞中目的基因的表达;B、给予4-表强力霉素后第12 h检测HEK293T细胞中目的基 因的表达;C、给予4-表强力霉素后第24 h检测HEK293T细胞中目的基因的表达;D、给予4-表 强力霉素后第48 h检测HEK293T细胞中目的基因的表达;E、给予4-表强力霉素后第72 h检 测HEK293T细胞中目的基因的表达(1:未给予4-表强力霉素的质粒Rt-sirt2/4的表达;2:给 予4-表强力霉素的质粒Rt-sirt2/4的表达;3:转染空载质粒的HEK293T细胞)。












