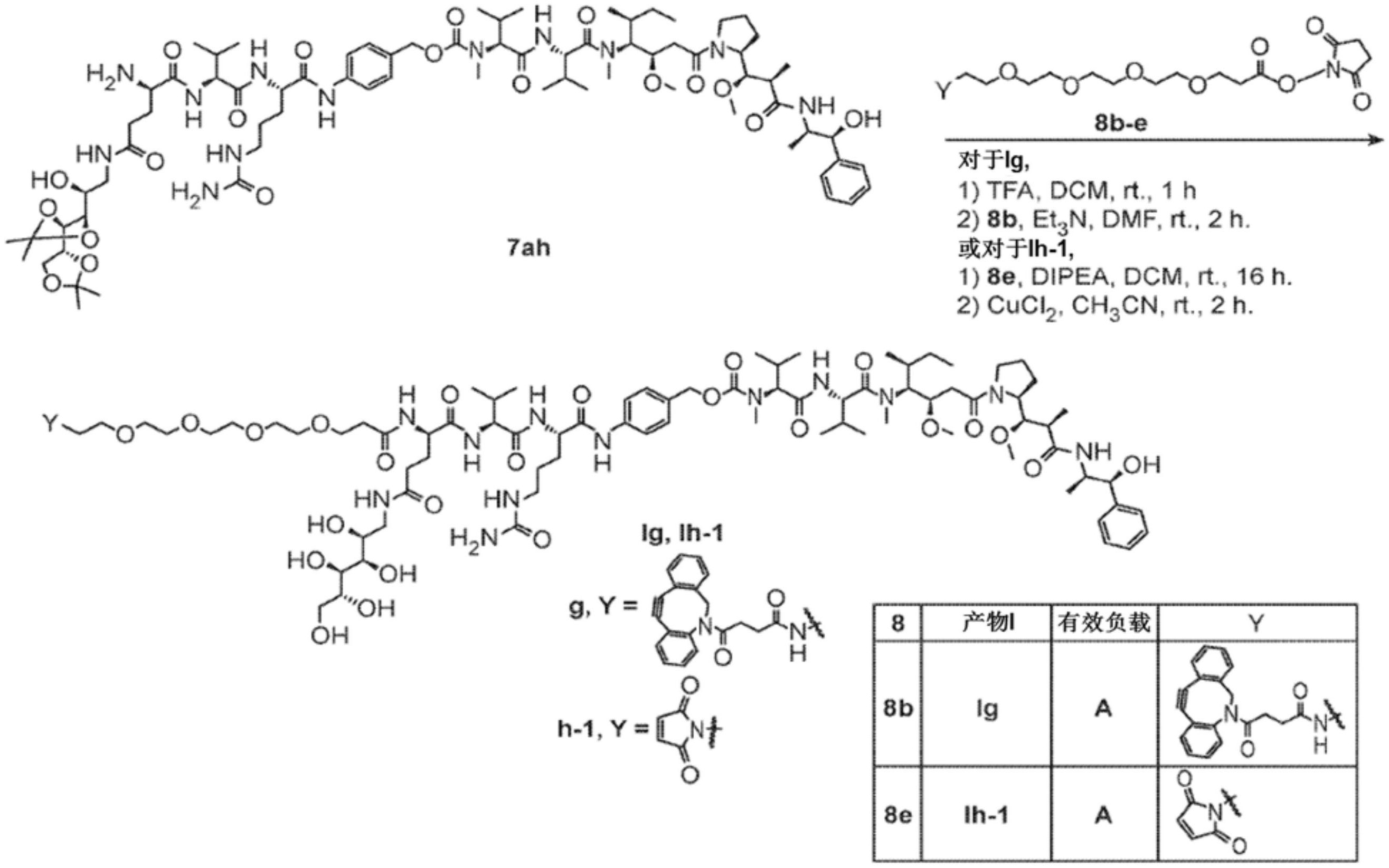
技术摘要:
本发明描述了蛋白质药物偶联物及其组合物,其可用于例如,将药物靶向特异性递送至细胞。通过将本发明所述这些化合物、组合物及偶联物施用于特定靶细胞,减少了由非特异性结合现象例如由非靶细胞引起的副作用。在某些实施方案,本发明提供了化合物、组合物和偶联物,其 全部
背景技术:
的此方面的方法包括向受试者依次施用多剂量的本发明 所述化合物。本发明使用的“依次施用”是指在不同的时间点,例如在以预定间隔(例如,小 时、天、周、或月)隔开的不同天,将化合物的每个剂量施用于受试者。本发明包含以下方法, 所述方法包含依次向患者施用单一初始剂量的本发明所述化合物,随后施用一个或多个二 次剂量的所述化合物,以及任选地后续施用一个或多个三次剂量的所述化合物。 [0328] 术语“初始剂量”,“二次剂量”,和“三次剂量”是指本发明所述化合物的给药时间 顺序。因此,“初始剂量”是在治疗方案开始时给药的剂量(也称为“基线剂量”);“二次剂量” 是在所述初始剂量给药后施用的剂量;和“三次剂量”是在所述二次剂量给药后施用的剂 量。所述初始、二次和三次剂量均可含有相同量的本发明所述化合物,但通常可在给药频率 方面彼此不同。在一些实施方案,在治疗过程中,所述初始、二次和/或三次剂量中所含的化 合物的量彼此变化(例如,酌情上调或下调)。在一些实施方案,在治疗方案开始时,将两种 或更多种(例如,2、3、4或5种)剂量施用为“负荷剂量”,随后以较不频繁的方式施用后续剂 量(例如“维持剂量”)。 [0329] 在本发明所述的一些示例性实施方案中,每个二次和/或三次剂量在紧随前述剂 量之后进行给药1至26周(例如,1、11/2、2、21/2、3、31/2、4、41/ 1 1 1 12、5、5 /2、6、6 /2、7、7 /2、8、8 /2、9、91/2、10、101/2、11、111/2、12、121/2、13、131/2、14、141/ 、15、1512 /2、16、161/2、17、171/2、 18、181/2、19、191/2、20、201/2、21、211/ 1 1 1 1 12、22、22 /2、23、23 /2、24、24 /2、25、25 /2、26、26 /2、或 更多)。本发明使用的短语“紧随前述剂量”是指在多次给药的序列中,在施用紧邻下一个剂 量之前,对患者施用本发明化合物的剂量,在所述给药序列中不存在干预剂量。 [0330] 本发明此方面的方法可包含向患者施用任何数量的二次和/或三次剂量的本发明 化合物。譬如,在一些实施方案,仅向患者施用单次二次剂量。在其他实施方案,向患者施用 两次或更多次(例如,2、3、4、5、6、7、8或更多次)二次剂量。同理,在一些实施方案,仅向患者 施用单次的三次剂量。在其他实施方案,向患者施用两次或更多次(例如,2、3、4、5、6、7、8或 更多次)三次剂量。给药方案可在特定受试者的寿命期内无限期地进行,或者直至此种治疗 不再是治疗需要或有利的。 [0331] 在涉及多个二次剂量的实施方案中,每个二次剂量可以与其他二次剂量相同的频 率施用/给药。譬如,每个二次剂量可在紧随前述剂量之后,对患者进行给药1至2周或1至2 个月。同理,在涉及多个三次剂量的实施方案中,每个三次剂量可以与其他三次剂量相同的 频率施用/给药。譬如,每个三次剂量可在紧随前述剂量之后,对患者进行给药2至12周。在 本发明的一些实施方案中,向患者施用二次和/或三次剂量的频率可在治疗方案的过程中 变化。也可根据临床检查后的个体患者的需要,由医师在治疗过程中调整给药频率。 [0332] 本发明包括其中以第一频率(例如,每周一次,每两周一次,每三周一次,每月一 395 CN 111601619 A 说 明 书 243/306 页 次,每两个月一次等)向患者施用2至6次负荷剂量,然后以较不频繁的方式向患者施用两次 或更多次维持剂量的给药方案。例如,根据本发明的此方面,如果以每月一次的频率施用负 荷剂量,那么维持剂量可以每6周施用一次,每两个月施用一次,每三个月施用一次等。 [0333] 本发明包括本发明所述化合物和/或偶联物(例如式(I)、式(II)、式(III)、式 (IV)、式(IVa)、式(IVb)、式(IVc)、式(Va)、式(Vb)、式(Vc)、或式(Vd)所示化合物)的药物组 合物,譬如,组合物包含本发明所述化合物、其盐、立体异构体、多晶型物,和药学上可接受 的载体、稀释剂、和/或辅料。合适的载体、稀释剂和辅料的实例包括,但不限于:用于维持适 当组合物pH值的缓冲剂类(例如,柠檬酸盐缓冲液、琥珀酸盐缓冲液、乙酸盐缓冲液、磷酸盐 缓冲液、乳酸盐缓冲液、草酸盐缓冲液等),载体蛋白类(如人血清白蛋白),盐水,多元醇类 (例如,海藻糖、蔗糖、木糖醇、山梨糖醇等),表面活性剂类(例如,聚山梨醇酯20、聚山梨醇 酯80、聚氧乙烯酸酯(polyoxolate)等),抗微生物剂类,和抗氧化剂类。 [0334] 在一些实施例,本发明提供了治疗疾病、病症或病况的方法,包括向患有所述病症 的患者施用治疗有效量的式(I)、式(II)、式(III)、式(IV)、式(IVa)、式(IVb)、式(IVc)、式 (Va)、式(Vb)、式(Vc)、或式(Vd)的化合物或其药物组合物。 [0335] 在一些实施例,本发明提供了预防疾病、病症或病况的方法,包括向患有所述病症 的患者施用预防有效量的式(I)、式(II)、式(III)、式(IV)、式(IVa)、式(IVb)、式(IVc)、式 (Va)、式(Vb)、式(Vc)、或式(Vd)的化合物或其药物组合物。 [0336] 在一些实施例,本发明提供了治疗或预防选自由以下组成的组的疾病、病症、或病 况的方法:增殖性疾病,神经退行性疾病,免疫性疾病,自身免疫性疾病,炎性疾病,皮肤病, 代谢性疾病,心血管疾病,和胃肠道疾病。 [0337] 本发明提供了调节细胞中LDLR(低密度脂蛋白受体)蛋白表达或胆固醇外排的方 法,其包含使所述细胞与抗体药物偶联物(ADC)接触,其中所述ADC包含靶向所述细胞的抗 体,亲水性残基,和LXR激动剂。 [0338] 所述增殖性疾病可以是技术人员已知的任何增殖性疾病。在某些实施方案,所述 增殖性疾病包括但不限于肿瘤学疾病,其中所述肿瘤学疾病可以是技术人员已知的任何癌 症疾病。在某些实施方案,本发明提供了治疗或预防黑素瘤的方法。在某些实施方案,本发 明提供了治疗或预防转移性黑素瘤的方法。在某些实施方案,本发明提供了治疗或预防肺 癌的方法。在某些实施方案,本发明提供了治疗或预防对EGFR-酪氨酸激酶抑制剂耐药的肺 癌的方法。在某些实施方案,本发明提供了治疗或预防口腔癌的方法。在某些实施方案,本 发明提供了治疗或预防口腔鳞状细胞癌的方法。在某些实施方案,本发明提供了治疗或预 防前列腺癌的方法。在某些实施方案,本发明提供了治疗或预防霍奇金淋巴瘤的方法。在某 些实施方案,本发明提供了治疗或预防乳腺癌的方法。 [0339] 所述神经退行性疾病可以是技术人员已知的任何神经退行性疾病。在某些实施方 案,本发明提供了治疗或预防阿尔茨海默病的方法。在某些实施方案,本发明提供了治疗或 预防帕金森病的方法。在某些实施方案,本发明提供了治疗或预防亨廷顿病的方法。在某些 实施方案,本发明提供了治疗或预防肌萎缩性侧索硬化症的方法。在某些实施方案,本发明 提供了治疗或预防髓磷脂基因表达的方法。在某些实施方案,本发明提供了治疗或预防髓 鞘化和再髓鞘化病况、疾病或病症的方法。 [0340] 所述免疫疾病可以是技术人员已知的任何免疫疾病。在某些实施方案,本发明提 396 CN 111601619 A 说 明 书 244/306 页 供了治疗或预防炎症性肠病的方法。在某些实施方案,本发明提供了治疗或预防溃疡性结 肠炎的方法。在某些实施方案,本发明提供了治疗或预防克罗恩病的方法。 [0341] 所述炎性疾病可以是技术人员已知的任何炎性疾病。在某些实施方案,本发明提 供了治疗或预防关节炎的方法。在某些实施方案,本发明提供了治疗或预防类风湿性关节 炎的方法。 [0342] 所述代谢性疾病可以是技术人员已知的任何代谢性疾病。在某些实施方案,血脂 异常选自由以下组成的组:高脂血症,高胆固醇血症,高甘油三酯血症,高脂蛋白血症,HDL 缺乏症,ApoA-I缺乏症,和心血管疾病例如冠状动脉疾病(包括,例如,治疗和预防心绞痛、 心肌梗塞、和心源性猝死);动脉粥样硬化(包括,例如,治疗和预防动脉粥样硬化);和再狭 窄(包括,例如,预防或治疗由于诸如气囊血管成形术之类的医疗程序而形成的动脉粥样硬 化斑块)。在某些实施方案,本发明提供了治疗或预防糖尿病的方法。 [0343] 所述心血管疾病可以是技术人员已知的任何心血管疾病。在某些实施方案,本发 明提供了治疗或预防动脉粥样硬化的方法。在某些实施方案,本发明提供了治疗或预防源 自异常巨噬细胞加工的动脉粥样硬化的方法。在某些实施方案,本发明提供了治疗或预防 源自氧化的低密度脂蛋白(oxLDL)形成的动脉粥样硬化的方法,其中巨噬细胞不能加工氧 化的低密度脂蛋白(oxLDL)。在某些实施方案,本发明提供了治疗或预防缺血性心脏病的方 法。在某些实施方案,本发明提供了治疗或预防中风的方法。在某些实施方案,本发明提供 了治疗或预防高血压性心脏病的方法。在某些实施方案,本发明提供了治疗或预防主动脉 瘤的方法。在某些实施方案,本发明提供了治疗或预防心内膜炎的方法。在某些实施方案, 本发明提供了治疗或预防外周动脉疾病的方法。在某些实施方案,本发明提供了治疗或预 防本段提供的任何疾病的组合的方法。 [0344] 在一些实施例,本发明阐述了调节核受体功能的方法。通过非限制性实例,所述功 能可选自炎性介质(例如细胞因子、趋化因子)的表达/分泌,胆固醇调节,胆固醇摄入,胆固 醇外排,胆固醇氧化、迁移、趋化性,细胞凋亡和坏死,炎性活性,脂质调节,细胞凋亡、迁移、 趋化性,基因转录,和蛋白质表达。 [0345] 在一些实施例,本发明阐述了治疗有需要的患者的疾病或病症的方法,所述方法 包含向患者施用本发明所述的化合物或药物组合物。在一些实施例,所施用的化合物是本 发明所述的抗体-药物偶联物。 [0346] 在一些实施例,本发明阐述了抗体-药物偶联物的方法,所述方法包含以下步骤: 在适于在结合剂与化合物之间形成键的条件下,使所述结合剂与连接体-有效负载化合物 接触。 [0347] 在一些实施例,本发明阐述了治疗受试者增殖性疾病、代谢性疾病、炎症或神经退 行性疾病的方法,所述方法包含向所述受试者施用有效治疗量的本发明所述化合物或药物 组合物。在一些实施例,所施用的化合物是本发明所述的抗体-药物偶联物。 [0348] 在一些实施例,本发明阐述了治疗受试者的疾病、病症、或病况的方法,所述方法 包含向所述受试者施用有效治疗量的本发明所述化合物或药物组合物。在一些实施例,所 施用的化合物是本发明所述的抗体-药物偶联物。 [0349] 在一些实施例,本发明阐述了治疗受试者增殖性疾病的方法,所述方法包含向所 述受试者施用有效治疗量的本发明所述化合物或药物组合物。在一些实施例,所施用的化 397 CN 111601619 A 说 明 书 245/306 页 合物是本发明所述的抗体-药物偶联物。 [0350] 在一些实施例,本发明阐述了治疗受试者代谢性疾病的方法,所述方法包含向所 述受试者施用有效治疗量的本发明所述化合物或药物组合物。在一些实施例,所施用的化 合物是本发明所述的抗体-药物偶联物。 [0351] 在一些实施例,本发明阐述了治疗受试者炎症的方法,所述方法包含向所述受试 者施用有效治疗量的本发明所述化合物或药物组合物。在一些实施例,所施用的化合物是 本发明所述的抗体-药物偶联物。 [0352] 在一些实施例,本发明阐述了治疗受试者神经退行性疾病的方法,所述方法包含 向所述受试者施用有效治疗量的本发明所述化合物或药物组合物。在一些实施例,所施用 的化合物是本发明所述的抗体-药物偶联物。 实施例 [0353] 除非另有明确说明,否则试剂和溶剂均得自商业来源,例如国药集团化学试剂有 限公司(Sinopharm Chemical ReagentCo.(SCRC))、Sigma-Aldrich、Alfa或其他供应商。 [0354] 在Bruker AVIII 400或Bruker AVIII 500上记录1H NMR和其他NMR光谱。用Nuts 软件或MestReNova软件处理数据,测定内标(例如四甲基硅烷(TMS))低磁场的质子位移百 万分率(ppm)。 [0355] HPLC-MS测定在Agilent 1200HPLC/6100SQ系统上运行,使用以下条件: [0356] 用于HPLC-MS测定的方法A包括作为流动相:A:水(0.01%三氟乙酸(TFA))和B:乙 腈(0.01%TFA);梯度相:5%的B,其在15分钟(min)内增加至95%的B;流速:1.0mL/min;色 谱柱SunFire C18,4.6x50mm,3.5μm;柱温:50℃。检测器:模数转换器(ADC)蒸发光散射检测 器(ELSD),二极管阵列检测器(DAD)(214nm和254nm),电喷雾电离-大气压电离(ES-API)。 [0357] 用于HPLC-MS测定的方法B包括作为流动相:A:水(10mM NH4HCO3)和B:乙腈;梯度 相:在15分钟(min)内由5%的B增加至95%的B;流速:1.0mL/min;色谱柱:XBridge C18, 4.6x50mm,3.5μm;柱温:50℃。检测器:ADC ELSD,DAD(214nm和254nm),质量选择检测器 (MSD)(ES-API)。 [0358] LC-MS测定在Agilent 1200HPLC/6100SQ系统上运行,使用以下条件: [0359] 用于LC-MS测定的方法A包含作为仪器:WATERS 2767;色谱柱:Shimadzu Shim- Pack,PRC-ODS,20x250mm,15μm,两个串联连接;流动相:A:水(0.01%TFA),B:乙腈(0.01% TFA);梯度相:在3分钟内由5%的B增加至95%的B;流速:1.8-2.3mL/min;色谱柱:SunFire C18,4.6x50mm,3.5μm;柱温:50℃;检测器:ADC ELSD,DAD(214nm和254nm),ES-API。 [0360] 用于LC-MS测定的方法B包括作为仪器:Gilson GX-281;色谱柱:Xbridge Prep C18 10μm OBD,19x250mm;流动相:A:水(10mM NH4HCO3),B:乙腈;梯度相:在3分钟内由5%的 B增加至95%的B;流速:1.8-2.3mL/min;色谱柱:XBridge C18,4.6x50mm,3.5μm;柱温:50 ℃。检测器:ADC ELSD,DAD(214nm和254nm),MSD(ES-API)。 [0361] 在Gilson GX-281仪器上以酸性(方法A)或碱性(方法B)溶剂体系进行制备型高压 液相色谱(制备型HPLC)。所述酸性溶剂体系采用Waters SunFire 10μm C18柱( 250x 19mm),和用于制备型HPLC的溶剂A是水/0.05%TFA,和溶剂B是乙腈。洗脱条件是线性梯度, 其在20分钟的时间段内以30mL/min的流速,从5%的溶剂B增至100%的溶剂B。所述碱性溶 398 CN 111601619 A 说 明 书 246/306 页 剂体系包括Waters Xbridge 10μm C18柱( 250x 19mm),和用于制备型HPLC的溶剂A是 水/10mM碳酸氢铵(NH4HCO3),和溶剂B是乙腈。洗脱条件是线性梯度,其在20分钟的时间段内 以30mL/min的流速,从5%的溶剂B增至100%的溶剂B。 [0362] 使用Agela Flash Column silica-CS柱在Biotage仪器上进行快速色谱法;在 Biotage仪器上使用Boston ODS或Agela C18柱进行反相快速色谱法。 [0363] 分析型手性HPLC方法-SFC条件 [0364] 仪器:SFC方法(SFC Method Station)(Thar,Waters) [0365] 柱子:CHIRALPAKAD-H/AS-H/OJ-H/OD-H 4.6×100mm,5μm(Daicel) [0366] 柱温:40℃ [0367] 流动相:CO2/IPA(0.1%DEA)=55/45 [0368] 流速:4.0mL/min [0369] 背压:120Bar [0370] 进样量:2μL [0371] 制备型手性HPLC方法-SFC条件 [0372] 仪器:SFC-80(Thar,Waters) [0373] 柱子:CHIRALPAKAD-H/AS-H/OJ-H/OD-H 20×250mm,10μm(Daicel) [0374] 柱温:35℃ [0375] 流动相:CO2/IPA(0.2%甲醇氨)=30/70 [0376] 流速:80g/min [0377] 背压:100bar [0378] 检测波长:214nm [0379] 循环时间:6.0min [0380] 样品溶液:将1500mg溶于70mL甲醇 [0381] 进样量:2mL(载量:42.86mg/针) [0382] 如本发明使用的,无论是否具体定义了特定缩写,在所述方法、方案和实施例中使 用的符号和惯例均与当代科学文献(例如《,美国化学学会杂志》或《生物化学杂志》)中使用 的那些一致。具体但不限于,以下缩写可用于实施例和整个说明书。 [0383] 具体但不限于,以下缩写可用于实施例和整个说明书: 399 CN 111601619 A 说 明 书 247/306 页 400 CN 111601619 A 说 明 书 248/306 页 401 CN 111601619 A 说 明 书 249/306 页 制备方法 表1 有效负载列表 402 CN 111601619 A 说 明 书 250/306 页 表2 带电的连接体有效负载列表 403 CN 111601619 A 说 明 书 251/306 页 404 CN 111601619 A 说 明 书 252/306 页 405 CN 111601619 A 说 明 书 253/306 页 实施例1 连接体有效负载的一般制备方法(参见图2) [0384] 由Fmoc-vcPAB-PNP(2a)、Fmoc-Val-Ala-OH(2b)和Fmoc-Val-Cit-OH(2c)与有效负 载A-D开始得到氨基甲酸酯类化合物(3a-g)来合成连接体-有效负载1(1h和1l除外)。由3a- f与Fmoc-D-Lys-COT(4a)来合成得到酰胺类化合物(5a-h)。将5a-f与叠氮化物(6a-d)环合 得到7。最后,将7与酸8a或其活化酯8b反应,得到连接体-有效负载1(1h和1l除外)。 [0385] 由Fmoc-vcPAB-PNP(2a)、Fmoc-Val-Ala-OH(2b)和Fmoc-Val-Cit-OH(2c)与有效负 载A-E开始得到氨基甲酸酯类化合物(3a-g)来合成连接体-有效负载I、II、III和IV(Ig-1、 Ih-1、1h和1l除外)。由3a-g与Fmoc-D-Lys-COT(4a)来合成得到酰胺类化合物(5a-g)。将5a- g与叠氮化物(6a-g)环合得到7。最后,将7与酸8a或其活化酯8b-e反应,得到连接体-有效负 载I、II、III和IV(Ig-1、Ih-1除外)。 实施例2 有效负载1h和1l的制备(参见图3) [0386] 在EDCI的缩合条件下,由3b和3e分别与Fmoc-dGlu-牛磺酸(4b)开始缩合反应,随 406 CN 111601619 A 说 明 书 254/306 页 后进行脱Fmoc反应,最后用活化酯8b进行酰胺化,来合成连接体-有效负载1h和1l。由3b和 3e分别与Fmoc-dGlu-牛磺酸(4b)开始缩合反应,随后进行脱Fmoc反应,最后用活化酯8b进 行酰胺化,来合成连接体-有效负载1h和1l。 [0387] 由3a与Fmoc-dGlu-乙缩醛葡糖酰胺(4c)开始进行酰胺偶联反应,随后与8e进行缩 合,最后用TFA脱保护,并随后与8b进行缩合,来合成连接体-有效负载Ig-1和Ih-1。 实施例3 连接体有效负载B和C的制备(参见图4) [0388] MMAE(A)可商购得到,CAS号为474645-27-7。根据图4,由商购的醋酸氟轻松9(CAS: 67-73-2)开始制备得到甾族有效负载B和C。将通过在高氯酸存在下与丁醛进行缩酮交换, 由9得到的化合物10转化为甲磺酸酯11,然后用叠氮化物基团部分替换甲磺酸酯基团以形 成12,将其进一步还原为胺B。另外,11中的甲磺酸酯基团部分也将被4-氨基苯酚替换,得到 苯胺C。 [0389] (1S,2S,4R,8S,9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-8-(2-羟基乙酰基)- 9,13-二甲基-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-16-酮 (10) [0390] 在10℃下,向醋酸氟轻松(9,0.90g,2.0mmol)和硅胶(18g)的庚烷混合物中加入丁 醛(0.27mL,3.0mmol),所得悬浮液在10-20℃下搅拌10分钟。在0℃下,向混合物中滴加高氯 酸(70%,0.68mL,8.3mmol)。然后将反应混合物在10-20℃下搅拌过夜。根据TLC和LCMS监 测,大部分醋酸氟轻松9耗尽。将反应混合物用石油醚稀释,然后用饱和Na2CO3水溶液淬灭。 将悬浮液过滤,所得固体用DCM/甲醇(v/v=1)洗。合并的滤液真空浓缩。所得残余物经硅胶 快速色谱法纯化(0-100%乙酸乙酯的石油醚溶液),得到化合物10(0.15g,16%收率)为白 色固体。ESI m/z:467.1(M H) 。 [0391] 2-[(1S,2S,4R ,8S,9S,11S,12R ,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基- 16-氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-8-基]-2-氧 乙基甲磺酸酯(11) [0392] 在0℃下,向化合物10(0.28g,0.65mmol)和三乙胺(0.13g,1.3mmol)的DCM(3mL)溶 液中加入甲磺酰氯(89mg,0.78mmol)。混合物在0℃下搅拌0.5小时后,将反应混合物用DCM (20mL)稀释。混合物用水(20mL×2)洗,经无水Na2SO4干燥,过滤,真空浓缩。所得残余物经硅 胶柱色谱在硅胶上纯化(0-50%乙酸乙酯的石油醚溶液),得到化合物11(0.26g,>99%收 率)为白色固体。ESI m/z:545(M H) 。 407 CN 111601619 A 说 明 书 255/306 页 [0393] (1S,2S,4R,8S,9S,11S,12R,13S,19S)-8-(2-叠氮基乙酰基)-12,19-二氟-11-羟 基-9,13-二甲基-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04 ,8.013,18]二十烷-14,17-二烯- 16-酮(12) [0394] 在50℃下,将化合物11(1.0g,1.8mmol)和叠氮化钠(1.2g,18mmol)的丙酮(15mL) 悬浮液搅拌过夜。将混合物冷却至室温,然后倒入水(80mL)中。含水混合物用乙酸乙酯 (50mL×3)萃取。合并的有机层用盐水(30mL)洗,经无水Na2SO4干燥,过滤,真空浓缩,得到粗 制化合物12(0.90g,>99%收率)为黄色固体,其无需进一步纯化直接用于下一步骤。ESI m/z:492(M H) 。 有效负载B [0395] (1S,2S,4R,6R,8S,9S,11S,12R,13S,19S)-8-(2-氨基乙酰基)-12,19-二氟-11-羟 基-9,13-二甲基-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04 ,8.013,18]二十烷-14,17-二烯- 16-酮;三氟乙酸盐(化合物B) [0396] 向化合物12(0.85g,1.7mmol)的THF(20mL)溶液中加入盐酸水溶液(1N,10mL)。混 合物在28-32℃下搅拌直至变澄清,然后向混合物中加入三苯膦(0.68g,2.6mmol)。所得黄 色澄清溶液在室温下搅拌18小时。将混合物真空浓缩,残余物经反相快速色谱法纯化(0- 50%乙腈的TFA(0.05%)水溶液),得到化合物B(0.56g,57%收率,TFA盐)为类白色固体。 ESI m/z:466(M H) 。1H NMR(400MHz,MeODd4)δ7.33(d ,J=9.9Hz,1H) ,6.40-6.29(m ,2H) , 5.69-5.45(m,1H) ,4.93-4.92(m,1H) ,4.71(t,J=4.3Hz,1H) ,4.35-4.27(m,2H) ,3.90-3.84 (m,1H) ,2.81-2.54(m,1H) ,2.42-2.06(m,3H) ,1.82-1.32(m,11H) ,1.09-0.87(m,6H)ppm。19F NMR(376MHz,CD3OD)δ-77.01,-166.24,-166.92,-188.81,-188.83ppm。分析型HPLC:100%, 保留时间:6.86min(方法A)。 有效负载C [0397] (1S,2S,4R,8S,9S,11S,12R,13S,19S)-8-[2-(4-氨基苯氧基)乙酰基]-12,19-二 氟-11-羟基-9,13-二甲基-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04 ,8.013 ,18]二十烷-14, 17-二烯-16-酮(C) 408 CN 111601619 A 说 明 书 256/306 页 [0398] 将化合物11(93mg,0.17mmol)、4-氨基苯酚(37mg,0.34mmol)和碳酸铯(0.11g, 0.34mmol)的丙酮(0.5mL)混合物回流2小时。将混合物冷却至室温,并用H2O(10mL)稀释。混 合物用乙酸乙酯(10mL×3)萃取。合并的有机层用水(20mL)和盐水(20mL)洗,经Na2SO4干燥, 过滤,真空浓缩。所得残余物经制备型HPLC纯化,得到有效负载C(6.0mg,6.3%收率)为白色 固体。ESI m/z:298(M/2 H) ,558(M H) (10%)。1H NMR(500MHz ,MeODd4)δ7 .34(d ,J= 10.0Hz,1H) ,6.78-6.71(m,4H) ,6.37-6.33(m,2H) ,5.63-5.49(m,1H) ,5.10-4.99(m,1H) , 4.77-4.63(m,2H) ,4.33(d,J=9.1Hz,1H) ,2.74-2.57(m,1H) ,2.39-2.13(m,3H) ,1.98-1.31 (m,12H) ,1.03-0.93(m,6H)ppm。分析型HPLC:纯度97.4%,保留时间:7.55min(方法B)。 实施例4 有效负载D的制备(参见图5) [0399] (1S,4aS,10aR)-6-羟基-1,4a-二甲基-1,2,3,4,4a ,9,10,10a-八氢菲-1-甲酸甲 酯(14) [0400] 向罗汉松酸(13,90g,0.33mol)的甲醇(200mL)和甲苯(600mL)溶液中加入(三甲基 硅烷基)重氮甲烷(2M的己烷溶液,200mL)。反应混合物在室温下搅拌2小时。然后根据LCMS 监测,罗汉松酸完全耗尽。真空除去挥发物,将残余物在石油醚(2L)中研磨,得到化合物14 (91g,96%收率)为白色固体。ESI m/z:289(M H) 。1H NMR(400MHz,DMSOd6)δ8.95(s ,1H) , 6.79(d ,J=8.2Hz,1H) ,6.63(d ,J=2.4Hz,1H) ,6.48(dd ,J=8.2,2.4Hz,1H) ,3.58(s,3H) , 2.80-2.55(m ,2H) ,2.20-2.02(m ,3H) ,1 .96-1 .71(m ,2H) ,1 .56-1 .45(m ,2H) ,1 .27(t,J= 13.5Hz,1H) ,1.21(s,3H) ,1.09(td,J=13.5,4.1Hz,1H) ,0.91(s,3H)ppm。 [0401] (1S,4aS,10aR)-6-(苄氧基)-1,4a-二甲基-1,2,3,4,4a ,9,10,10a-八氢菲-1-甲 酸甲酯(20) [0402] 将化合物14(12g,40mmol)和碳酸铯(14g,44mmol)的DMF(100mL)混合物在20-25℃ 409 CN 111601619 A 说 明 书 257/306 页 下搅拌15分钟。在室温下,向所得混合物中加入苄基溴(7.1mL,60mmol)。混合物在室温下搅 拌4小时后,将所得混合物倒入冷水中,然后用乙酸乙酯萃取。合并的有机溶液用水和盐水 洗,经硫酸钠干燥,真空浓缩。粗产物经快速色谱法纯化(0-10%乙酸乙酯的石油醚溶液), 得到标题化合物20(13g,89%收率)为白色固体。ESI m/z:379(M H) 。1H NMR(500MHz , MeODd4)δ7.60-7.20(m,5H) ,7.00-6.82(m,2H) ,6.73(d,J=7.1Hz,1H) ,5.03(s,2H) ,3.66(s, 3H) ,2.95-2.58(m,2H) ,2.36-2.10(m,3H) ,2.10-1.85(m,2H) ,1.70-1.48(m,2H) ,1.44-1.21 (m,4H) ,1.15(t,J=17.2Hz,1H) ,1.01(s,3H)ppm。 [0403] (1S,4aS,10aR)-6-(苄氧基)-1,4a-二甲基-1,2,3,4,4a ,9,10,10a-八氢菲-1-羧 酸(21) [0404] 将化合物20(11g,29mmol)和叔丁醇钾(33g,0.29mol)的DMSO(0.19L)混合物在100 ℃下搅拌1小时,直至完全脱去甲基,通过LCMS和TLC进行监测。混合物冷却至25℃后,将混 合物用盐酸水溶液(1N)淬灭,然后用乙酸乙酯萃取。合并的有机溶液用盐水洗,经硫酸钠干 燥,真空浓缩。所得残余物经硅胶柱色谱法纯化(0-24%乙酸乙酯的石油醚溶液),得到化合 物21(7.5g,71%收率)为白色固体。ESI m/z:365(M H) 。1H NMR(500MHz,MeODd4)δ7.42(d,J =7.4Hz,2H) ,7.36(t,J=7.5Hz,2H) ,7.30(t,J=7.3Hz,1H) ,6.92(d ,J=8.4Hz,1H) ,6.87 (d ,J=2.5Hz,1H) ,6.72(dd ,J=8.4,2.5Hz,1H) ,5.02(s ,2H) ,2.82(dd ,J=16.3,4.4Hz, 1H) ,2.77-2.65(m,1H) ,2.24(d ,J=13.2Hz,2H) ,2.19(dd ,J=13.8,6.0Hz,1H) ,2.11-1.96 (m,2H) ,1.64-1.56(m,1H) ,1.53(d,J=11.0Hz,1H) ,1.35(td,J=13.3,3.7Hz,1H) ,1.30(s, 3H) ,1.13(s,3H) ,1.11-1.05(m,1H)ppm。 [0405] (1S,4aS,10aR)-6-(苄氧基)-1,4a-二甲基-1,2,3,4,4a ,9,10,10a-八氢菲-1-甲 酸五氟苯酯(22) [0406] 向21(9.6g,26mmol)的DMF(100mL)溶液中加入DIPEA(14mL,79mmol)和2,2,2-三氟 乙酸全氟苯酯(15g,53mmol)。所得混合物在室温下搅拌过夜,通过LCMS进行监测。然后将反 应混合物用乙醚(200mL)稀释,并用水(300mL)和盐水(200mL)洗。有机溶液经硫酸钠干燥, 真空浓缩。所得残余物经快速色谱法纯化(0-10%乙酸乙酯的石油醚溶液),得到化合物22 (12g,88%收率)为白色固体。ESI m/z:531(M H) 。1H NMR(500MHz ,DMSOd6)δ7.43(d ,J= 7.1Hz,2H) ,7.38(t,J=7.4Hz,2H) ,7.31(t,J=7.2Hz,1H) ,6.93(dd ,J=10.2,5.5Hz,2H) , 6.76(dd ,J=8.4,2.5Hz,1H) ,5.05(s ,2H) ,2.81(dd ,J=16.3,4.5Hz,1H) ,2.77-2.68(m , 1H) ,2 .28-2 .19(m ,2H) ,2 .18(dd ,J=13 .4 ,5 .6Hz ,1H) ,2 .00-1 .83(m ,2H) ,1 .74(d ,J= 11.8Hz,1H) ,1.65(d,J=14.1Hz,1H) ,1.47(s,3H) ,1.38-1.27(m,2H) ,1.08(s,3H)ppm。 [0407] N-[(4bS,8S,8aR)-8-({[(1S,4aS,10aR)-6-(苄氧基)-1,4a-二甲基-1,2,3,4,4a, 410 CN 111601619 A 说 明 书 258/306 页 9,10,10a-八氢菲-1-基]甲酰胺基}羰基)-4b,8-二甲基-4b,5,6,7,8,8a ,9,10-八氢菲-3- 基]氨基甲酸叔丁酯(23) [0408] 在-78℃下,向化合物18(2.3g,6.2mmol)的THF(20mL)溶液中滴加n-BuLi(2.5M的 己烷溶液,5.5mL,14mmol)。反应在此温度下搅拌1小时。向混合物中加入22(3.0g,5.6mmol) 的THF(20mL)溶液,然后将所得混合物在10-20℃下搅拌过夜,直至化合物22耗尽,通过LCMS 进行监测。反应用饱和氯化铵水溶液淬灭,然后用乙酸乙酯萃取。合并的有机溶液用水和盐 水洗,经硫酸钠干燥,真空浓缩。所得残余物经快速色谱法纯化(0-30%乙酸乙酯的石油醚 溶液),得到化合物23(1.59g,51%收率)为白色固体。ESI m/z:719(M 1) 。 [0409] N-[(4bS,8S,8aR)-8-({[(1S,4aS,10aR)-6-羟基-1 ,4a-二甲基-1 ,2,3,4,4a ,9, 10,10a-八氢菲-1-基]甲酰胺基}羰基)-4b,8-二甲基-4b,5,6,7,8,8a,9,10-八氢菲-3-基] 氨基甲酸叔丁酯(24) [0410] 在氮气保护下,向23(2.0g,2.78mmol)的乙酸乙酯(40mL)溶液中加入湿的钯/碳 (10%Pd,0.9g)。将混合物脱气并用氢气充满,然后在室温下、在氢气球下搅拌过夜,直至23 完全耗尽,通过LCMS进行监测。混合物通过硅藻土过滤,滤液真空浓缩。所得残余物经硅胶 柱色谱法纯化(0-55%乙酸乙酯的石油醚溶液),得到24(1.06g,61%收率)为白色固体。ESI m/z:629(M H) 。1H NMR(500MHz,DMSOd6)δ9.10(s,1H) ,8.98(s,1H) ,8.11(s ,1H) ,7.40(s, 1H) ,7 .15(d ,J=7.5Hz,1H) ,6.90(d ,J=8.4Hz,1H) ,6.81(d ,J=8.3Hz,1H) ,6.63(d ,J= 2.3Hz,1H) ,6.50(dd,J=8.2,2.4Hz,1H) ,2.84(td,J=16.3,3.8Hz,2H) ,2.77-2.64(m,2H) , 2.30-2.22(m,2H) ,2.14(t,J=10.9Hz,4H) ,2.00-1.80(m,4H) ,1.65-1.54(m,4H) ,1.45(s, 9H) ,1.34-1.28(m,2H) ,1.27(d,J=2.5Hz,6H) ,1.15-1.08(m,2H) ,0.99(s,6H)ppm。 有效负载D [0411] (1S,4aS,10aR)-N-[(1S,4aS,10aR)-6-氨基-1 ,4a-二甲基-1 ,2 ,3 ,4 ,4a ,9 ,10 , 10a-八氢菲-1-羰基]-6-羟基-1,4a-二甲基-1,2,3,4,4a,9,10,10a-八氢菲-1-甲酰胺(D) 411 CN 111601619 A 说 明 书 259/306 页 [0412] 在室温下,向化合物24(0.17g,0.27mmol)的DCM(10mL)溶液中滴加TFA(3mL)。反应 混合物在室温下搅拌1小时,直至根据LCMS监测已脱去Boc。真空浓缩除去挥发物,所得残余 物经制备型HPLC(方法B)纯化,得到D(0.10g,70%收率)为白色固体。 [0413] ESI m/z:529.3(M 1) 。 [0414] 1H NMR(400MHz,CDCl3)δ8.14(s,1H) ,6.92(d ,J=8.3Hz,1H) ,6.86(d ,J=8.1Hz, 1H) ,6.73(d ,J=2.5Hz,1H) ,6.65-6.57(m,2H) ,6.50(dd ,J=8.1,2.3Hz,1H) ,4.75(s,1H) , 3.49(s ,1H) ,2.99-2.85(m ,2H) ,2.79(tt,J=11.6,5.8Hz,2H) ,2.34-2.14(m ,6H) ,2.15- 1.95(m,4H) ,1.74-1.51(m,5H) ,1.46-1.34(m,2H) ,1.30(s,6H) ,1.21-1.06(m,8H)ppm。 [0415] 1H NMR(400MHz,DMSOd6)δ8.99(s ,1H) ,8.09(s ,1H) ,6.81(d ,J=8.0Hz,1H) ,6.68 (d,J=8.0Hz,1H) ,6.63(d,J=2.5Hz,1H) ,6.50(dd,J=8.0,2.5Hz,1H) ,6.48(d,J=2.5Hz, 1H) ,6.34(dd,J=8.0,2.5Hz,1H) ,4.69(s,2H) ,2.86-2.60(m,4H) ,2.28-2.10(m,6H) ,1.94- 1.75(m,4H) ,1.65-1.53(m,4H) ,1.35-1.20(m,8H) ,1.20-1.06(m,2H) ,0.98(s,6H)ppm。 [0416] 13C NMR(100MHz ,DMSOd6)δ174 .03 ,173 .92 ,155 .34 ,148 .39 ,147 .63 ,146 .43 , 129.56,129.09,124.60,121 .65,113.23,112.58,111 .81 ,110.77 ,52.32,52.09,45.56, 45 .52 ,39 .20 ,39 .36 ,38 .23 ,38 .17 ,37 .18 ,37 .12 ,31 .08 ,31 .00 ,27 .65 ,27 .64 ,23 .08 , 23.03,21.43,21.27,19.64,19.61ppm。 [0417] HPLC(方法B):保留时间:8.92min,纯度:99.4%。手性HPLC:>99.9%(在柱AD、AS、 OD和OJ中)。 [0418] 旋光度(α): 2.53°(1.7g/100mL THF,25℃)。 有效负载E [0419] (1S,4aS,10aR)-6-((S)-2-氨基-3-羟基丙酰胺基)-N-((1S,4aS,10aR)-6-羟基- 1 ,4a-二甲基-1 ,2,3,4,4a ,9,10,10a-八氢菲-1-羰基)-1 ,4a-二甲基-1 ,2,3,4,4a ,9,10, 10a-八氢菲-1-甲酰胺(E) [0420] 在25℃下,向Fmoc-Ser-OH(30mg,0.1mmol)的DMF(1mL)溶液中加入HATU(38mg, 0.1mmol)和DIPEA(39mg,0.3mmol)。所得混合物在此温度下搅拌1小时。然后向混合物中加 入D(30mg,0.06mmol),将反应混合物在25℃下搅拌16h。向混合物中加入哌啶(0.2mL),所得 混合物在室温下再搅拌30分钟。真空除去挥发物,所得残余物经制备型HPLC(方法B)直接纯 化,得到所需产物(18mg,51%收率)为白色固体。ESI m/z:616(M 1) 。1H NMR(500MHz , DMSO-d6)δ9.74(br s,1H,CONH-Ph) ,9.00(s,1H,OH) ,8.11(s,1H,酰亚胺啶(imidine)的NH) , 7.58(s,1H) ,7.41(dd ,J=8.2,2.0Hz,1H) ,6.96(d ,J=8.4Hz,1H) ,6.82(d ,J=8.3Hz,1H) , 6.63(d ,J=2.3Hz,1H) ,6.50(dd ,J=8.2,2.4Hz,1H) ,4.82(t,J=5.5Hz,1H,Ser上的OH) , 412 CN 111601619 A 说 明 书 260/306 页 3.62-3.45(m,3H) ,2.97-2.61(m,4H) ,2.33-2.21(m,2H) ,2.21-2.03(m,4H) ,1.96-1.77(m, 4H) ,1.70-1.50(m,4H) ,1.36-1.20(m,8H) ,1.23-1.06(m,2H) ,1.06-0.93(m,6H)ppm。 实施例5 中间体3a-c、3g的制备(参见图6) [0421] 一般方法A:室温下,向有效负载(A、B、C或E,1.0当量)的DMF(0.3mL/10mg有效负 载)溶液中加入Fmoc-vcPAB-PNP 2a(1.1当量)、HOBt(1.5当量)和DIPEA(2.0当量)。混合物 在室温下搅拌3小时,直至有效负载完全耗尽,通过LCMS进行监测。向反应混合物中加入二 乙胺(0.03mL/10mg有效负载),混合物在室温(18-30℃)下搅拌1小时,直至脱去Fmoc。将混 合物过滤,滤液真空浓缩。所得残余物经反相快速色谱法或制备型HPLC纯化,得到标题化合 物(3a、3b、3c或3g)。 [0422] 4-((S)-2-((S)-2-氨基-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基(S)-1-((S)-1- (((3R,4S,5S)-1-((S)-2-((1R,2R)-3-((1S,2R)-1-羟基-1-苯基丙烷-2-基氨基)-1-甲氧 基-2-甲基-3-氧丙基)吡咯烷-1-基)-3-甲氧基-5-甲基-1-氧庚烷-4-基)(甲基)氨基)-3- 甲基-1-氧丁烷-2-基氨基)-3-甲基-1-氧丁烷-2-基(甲基)氨基甲酸酯(3a)(vcPAB-MMAE) [0423] [参考文献:WO2012/166560]根据一般方法A,由化合物2a(90mg,纯度75%,88μ mol)和有效负载A(45mg,63μmol)得到化合物3a(28mg,40%收率)为白色粉状物。ESI m/z: 1123.5(M H) 。1H NMR(DMSOd6,500MHz):δ10.12(br s,1H) ,8.25-8.05(m,2H) ,7.89-7.58 (m,3H) ,7.34-7.16(m,7H) ,5.98(t,J=5.5Hz,1H) ,5.42-5.34(m,3H) ,5.06-4.95(m,2H) , 4.78-4.57(m,1H) ,4.51-4.26(m,3H) ,3.80-3.40(m,2H) ,3.28-3.18(m,7H) ,3.12-2.84(m, 10H) ,2.43-2.40(m ,1H) ,2.30-2.27(m ,1H) ,2.15-1 .91(m ,5H) ,1 .96-1 .68(m ,4H) ,1 .59- 1.34(m,6H) ,1.06-0.93(m,6H) ,0.90-0.70(m,26H)ppm。 [0424] {4-[(2S)-2-[(2S)-2-氨基-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯 基}甲基N-{2-[(1S,2S,4R,8S,9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基- 16-氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-8-基]-2-氧 乙基}氨基甲酸酯(3b) [0425] 根据一般方法A,由化合物2a(93mg,0.20mmol)和有效负载B,并通过反相快速色谱 法(50-80%乙腈的碳酸氢铵水溶液(10mM))纯化后得到化合物3b为白色固体。ESI m/z:871 (M H) 。 413 CN 111601619 A 说 明 书 261/306 页 [0426] {4-[(2S)-2-[(2S)-2-氨基-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯 基}甲基N-(4-{2-[(1S,2S,4R,8S,9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-9,13-二甲 基-16-氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-8-基]-2- 氧乙氧基}苯基)氨基甲酸酯(3c) [0427] 根据一般方法A,由化合物2a(0.10g,0.22mmol)和有效负载C,并通过反相快速色 谱法(50-80%乙腈的碳酸氢铵水溶液(10mM))纯化后得到化合物3c(160mg,76%收率)为白 色固体。ESI m/z:963.4(M H) 。 [0428] {4-[(2S)-2-[(2S)-2-氨基-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯 基}甲基N-[(1S)-1-{[(4bS,8S,8aR)-8-({[(1S,4aS,10aR)-6-羟基-1,4a-二甲基-1,2,3, 4,4a ,9,10,10a-八氢菲-1-基]甲酰胺基}羰基)-4b,8-二甲基-4b,5,6,7,8,8a ,9,10-八氢 菲-3-基]氨基甲酰基}-2-羟基乙基]氨基甲酸酯(3g) [0429] 向Fmoc-vc-PAB-PNP(58mg,76μmol)和E(36mg,58μmol)的DMF(3mL)溶液中加入 HOBt(7 .9mg,58μmol)和DIPEA(15mg,0.12mmol),混合物在30℃下搅拌16小时。然后根据 LCMS监测,化合物E完全耗尽。向所得混合物中加入二乙胺(0.1mL),将其在室温搅拌1小时 直至脱去Fmoc,通过LCMS进行监测。反应混合物过滤后,将滤液直接经制备型HPLC(方法B) 纯化,得到化合物3g(36mg,48%收率)为浅黄色固体。ESI m/z:1021(M 1) 。1H NMR(400MHz, DMSOd6)δ10.02(s ,1H) ,9.82(s ,1H) ,9.00(s ,1H) ,8.69-8.65(m ,1H) ,8.11-8.00(m ,4H) , 7.65-7.53(m,3H) ,7.40-7.30(m,3H) ,7.30-7.20(m,1H) ,6.96(d ,J=8.0Hz,1H) ,6.81(d ,J =8.0Hz,1H) ,6.65-6.61(m,1H) ,6.50(dd ,J=8.0Hz,2.0Hz,1H) ,6.00-5.95(m,1H) ,5.48 (s,2H) ,5.00-4.95(m,3H) ,4.60-4.40(m,1H) ,4.25-4.20(m,1H) ,3.65-3.55(m,4H) ,3.15- 2.55(m,10H) ,2.40-2.20(m,3H) ,2.20-2.00(m,5H) ,2.00-1.80(m,4H) ,1.86-1.55(m,6H) , 1.27(d,J=4.8Hz,9H) ,1.20-1.10(m,2H) ,0.97-0.90(m,6H)ppm。 实施例6 中间体3d和3f的制备(参见图7) [0430] 一般方法B:在室温下,向Fmoc-Val-Ala-OH(2b,1.2当量)的DMF(25mL/g有效负载) 溶液中加入HATU(1.5当量)和DIPEA(3.0当量)。混合物在室温下搅拌5分钟,然后加入有效 负载(C或D,1.0当量)。将混合物再搅拌2小时,LCMS显示反应完成。向反应混合物中加入二 414 CN 111601619 A 说 明 书 262/306 页 乙胺(5当量)。将混合物在室温下搅拌2小时,直至根据LCMS监测已完全脱去Fmoc。将混合物 过滤,滤液真空浓缩。所得残留物经反相快速色谱法纯化(0-100%乙腈的碳酸氢铵水溶液 (10mM))或制备型HPLC(方法B)纯化,得到所需产物(3d或3f,从有效负载开始的收率为64- 72%)。 (2S)-2-氨基-N-[(1S)-1-[(4-{2-[(1S,2S,4R,8S,9S,11S,12R,13S,19S)-12,19-二 氟-11-羟基-9,13-二甲基-16-氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04 ,8.013 ,18]二十 烷-14,17-二烯-8-基]-2-氧乙氧基}苯基)氨基甲酰基]乙基]-3-甲基丁酰胺(3d) [0431] 根据一般方法B,由化合物2b(0.50g,0.90mmol)和有效负载C,并通过反相快速色 谱法(0-100%乙腈的碳酸氢铵水溶液(10mM))纯化后得到化合物3d(0.69g,72%收率)为粘 稠黄色油状物。ESI m/z:728(M H) 。 (1S,4aS,10aR)-6-((S)-2-((S)-2-氨基-3-甲基丁酰胺基)丙酰胺基)-N-((1S,4aS, 10aR)-6-羟基-1,4a-二甲基-1,2,3,4,4a,9,10,10a-八氢菲-1-羰基)-1,4a-二甲基-1,2, 3,4,4a,9,10,10a-八氢菲-1-甲酰胺(3f) [0432] 根据一般方法B,由化合物2b和有效负载D(53mg,0.10mmol),并通过制备型HPLC (方法B)纯化后得到化合物3f(45mg,64%收率)为白色固体。ESI m/z:699(M 1) 。1H NMR (500MHz,MeODd4)δ8.40(s,1H) ,7.47(s,1H) ,7.32(d,J=8.0Hz,1H) ,7.03(d,J=8.3Hz,1H) , 6.88(d,J=8.2Hz,1H) ,6.72(d,J=2.4Hz,1H) ,6.56(dd,J=8.3,2.4Hz,1H) ,4.60-4.48(m, 1H) ,3.22-3.11(m,1H) ,3.02-2.93(m,1H) ,2.92-2.76(m,3H) ,2.74-2.70(m,1H) ,2.43-2.31 (m,3H) ,2.28(d ,J=14.1Hz,3H) ,2.16-1.96(m,3H) ,1.81(s,1H) ,1.78-1.65(m,4H) ,1.53- 1.42(m,4H) ,1.38(d,J=5.3Hz,6H) ,1.33-1.22(m,2H) ,1.14(d,J=6.6Hz,6H) ,1.09(d,J= 18.6Hz,6H)ppm。 实施例7 中间体3e的制备(参见图8) (2S)-2-[(2S)-2-氨基-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)-N-(4-{2-[(1S,2S, 4R,8S,9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙基-5,7-二 氧杂五环[10.8.0.02,9.04 ,8.013 ,18]二十烷-14,17-二烯-8-基]-2-氧乙氧基}苯基)戊酰胺 (3e) 415 CN 111601619 A 说 明 书 263/306 页 [0433] 在室温下,向Fmoc-Val-Cit-OH(0 .23g,0.43mmol)的DMF(5mL)溶液中加入HATU (0.38g,0.43mmol)和DIPEA(93mg,0.72mmol)。混合物在室温下搅拌5分钟,然后加入有效负 载C(0.20g,0.36mmol)。将混合物再搅拌2小时,LCMS显示反应完成。向反应混合物中加入二 乙胺(0.5mL)。混合物在室温下搅拌1小时,直至根据LCMS监测Fmoc完全脱去。将混合物过 滤,滤液真空浓缩。所得残余物经反相快速色谱法纯化(0-100%乙腈的碳酸氢铵水溶液 (10mM),然后是甲醇),得到化合物3e(从有效负载C开始的收率为38%)。ESI m/z:814(M 1) 。 实施例8 中间体4的制备(参见图9) [0434] 中间体4a是通过将Fmoc-(D)-Lys-OH用市售活化酯25进行酰胺化合成得到。 (2R)-6-[2-(环辛-2-炔-1-基氧基)乙酰胺基]-2-{[(9H-芴-9-基甲氧基)羰基]氨基} 己酸(4a) [0435] 向化合物25(65mg,0.23mmol,CAS:1425803-45-7)的DMF(2mL)混合物中加入Fmoc- D-Lys-OH(85mg,0.23mmol)和三乙胺(52mg,0.51mmol)。反应混合物在室温下搅拌30分钟。 混合物通过反相快速色谱法(0-100%乙腈的水溶液(0.05%TFA))直接分离,得到中间体4a (85mg,收率70%)为白色固体。ESI m/z:533(M H) 。1H NMR(MeODd4,500MHz):δ7.70(d ,J= 7.5Hz,2H) ,7.59(t,J=8.0Hz,2H) ,7.30(t,J=7.5Hz,2H) ,7.22(t,J=7.4Hz,2H) ,4.35- 4.22(m,2H) ,4.22-4.09(m,2H) ,4.09-3.99(m,1H) ,3.94-3.81(m,1H) ,3.79-3.67(m,1H) , 3.15(t,J=6.9Hz,2H) ,2.17-1.96(m,3H) ,1.96-1.86(m,1H) ,1.85-1.66(m,4H) ,1.66-1.41 (m,5H) ,1.41-1.25(m,3H)ppm。 实施例9 中间体4b的制备(参见图10) [0436] 中间体4b是由Fmoc-(D)-Glu-OtBu(26)合成得到。化合物26用HOSu活化,然后用牛 磺酸进行酰胺化,得到化合物27,继而将其用TFA水解,得到中间体4b。 [0437] 2-[(4R)-5-(叔丁氧基)-4-{[(9H-芴-9-基甲氧基)羰基]氨基}-5-氧戊酰胺基]乙 烷-1-磺酸(27) [0438] 在室温下,向Fmoc-(D)-Glu-OtBu(26)(2.0g,4.7mmol)的DCM(20mL)溶液中加入 416 CN 111601619 A 说 明 书 264/306 页 HOSu(1.1g,9.6mmol)和EDCI(1.8g,9.4mmol)。混合物在RT下搅拌过夜,通过LCMS进行监测。 将反应混合物用DCM(100mL)稀释,然后用水(50mL×2)和盐水(50mL)洗,经无水硫酸钠干 燥,真空浓缩。将残余物溶于DMF(2mL),并向此溶液中加入牛磺酸(1.2g,9.6mmol)和DIPEA (1.4g,14mmol)。所得混合物在室温下搅拌过夜,直至根据LCMS监测反应完成。反应混合物 经制备型HPLC(方法B)直接纯化,得到化合物27(2.0g,81%收率)为白色固体。ESI m/z:477 (M–55 H) 。 (2R)-2-{[(9H-芴-9-基甲氧基)羰基]氨基}-4-[(2-磺乙基)氨基甲酰基]丁酸(4b) [0439] 向化合物27(0.52g,0.98mmol)的DCM(2mL)溶液中加入TFA(2mL)。反应混合物在室 温下搅拌3小时,直至根据LCMS监测水解完成。真空除去挥发物,所得残余物经反相快速色 谱法纯化(0-100%乙腈的碳酸氢铵水溶液(10mM)),得到中间体4b(0.45g,97%收率)为白 色固体。ESI m/z:477(M H) 。1H NMR(DMSOd6,500MHz)δ7.89(d ,J=7.5Hz,2H) ,7.72(d ,J= 7.5Hz,2H) ,7 .42(t,J=7.5Hz,2H) ,7 .34(t,J=7.5Hz,2H) ,7 .21-7 .17(br s ,1H) ,4.27- 4.23(m,2H) ,3.82-3.79(m,1H) ,3.27-3.19(m,1H) ,2.71-2.67(m,1H) ,2.54(t,J=7.5Hz, 2H) ,2.13-1.89(m,2H) ,1.80-1.75(m,1H) ,1.07-1.06(m,4H)ppm(质子COOH未示出)。 [0440] 化合物4c是通过J.Org.Chem.2010,75,3685-3691中概述的合成方法制备得到,并 以25%的总收率得到化合物4c。ESI m/z:613.3(M H) 。 实施例10 中间体5a-g的制备(参见图11) [0441] 一般方法D:在室温下,向化合物4a(1.2当量)的DMF溶液(0.2mL/10mg 4a)中加入 HATU(1 .4当量)和DIPEA(3当量)。将混合物在室温下搅拌5分钟,然后加入化合物3(1.0当 量)。将反应混合物在室温下搅拌2小时,直至化合物3a-g完全耗尽,通过LCMS进行监测。向 反应混合物中加入二乙胺(5.0当量)。混合物在室温下搅拌2小时。将混合物过滤,滤液浓 缩。所得残余物经反相快速色谱法(0-100%乙腈的碳酸氢铵水溶液(10mM))或制备型HPLC (方法B)纯化,得到化合物5a-g。 4-((2S)-2-((2S)-2-((2R)-2-氨基-6-(2-(环辛-2-炔基氧基)乙酰胺基)己酰胺基)- 3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基(S)-1-((S)-1-(((3R ,4S,5S)-1-((S)-2-((1R , 2R)-3-((1S,2R)-1-羟基-1-苯基丙烷-2-基氨基)-1-甲氧基-2-甲基-3-氧丙基)吡咯烷-1- 基)-3-甲氧基-5-甲基-1-氧庚烷-4-基)(甲基)氨基)-3-甲基-1-氧丁烷-2-基氨基)-3-甲 基-1-氧丁烷-2-基(甲基)氨基甲酸酯(5a) 417 CN 111601619 A 说 明 书 265/306 页 [0442] 根据一般方法D,由化合物3a(38mg,34μmol)和化合物4(34mg,64μmol)得到化合物 5a(17mg,35%收率)为白色固体。ESI m/z:1415(M 1) 。1H NMR(DMSOd6 ,400MHz)δ10.09- 10.02(m,1H) ,8.54(d ,J=8.4Hz,1H) ,8.38(d ,J=7.5Hz,1H) ,8.35-8.26(m,0.5H) ,8.12- 8.02(m,3H) ,7.94-7.85(m,0.5H) ,7.66-7.54(m,3H) ,7.34-7.23(m,6H) ,7.20-7.13(m,1H) , 6.08-5.97(m,1H) ,5.54-5.37(m,3H) ,5.13-4.94(m,2H) ,4.52-4.21(m,6H) ,4.03-3.70(m, 4H) ,3.63-3.51(m,1H) ,3.25-3.17(m,8H) ,3.13-2.82(m,10H) ,2.31-1.91(m,10H) ,1.85- 1.64(m,9H) ,1.64-1.25(m,15H) ,1.07-0.96(m,6H) ,0.90-0.74(m,26H)ppm。 {4-[(2S)-2-[(2S)-2-[(2S)-2-氨基-6-[2-(环辛-2-炔-1-基氧基)乙酰胺基]己酰胺 基]-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲基N-{2-[(1S,2S,4R ,8S, 9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙基-5,7-二氧杂五 环[10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-8-基]-2-氧乙基}氨基甲酸酯(5b) [0443] 根据一般方法D,由化合物3b(0.20g,0.23mmol)开始,并通过制备型HPLC(方法B) 分离后得到化合物5b(0.12g,45%收率)为白色固体。ESI m/z:1385(M 1) 。1H NMR(400MHz, MeODd4)δ7.65-7.55(m,2H) ,7.40-7.26(m,3H) ,6.39-6.27(m,2H) ,5.65-5.45(m,1H) ,5.13- 5.01(m,2H) ,4.71-4.50(m,2H) ,4.40-4.14(m,4H) ,4.11-3.82(m,3H) ,3.46-3.39(m,1H) , 3.29-3.09(m,4H) ,2.76-2.54(m,1H) ,2.41-2.10(m,7H) ,2.09-1.99(m,1H) ,1.96-1.80(m, 5H) ,1.78-1.21(m,23H) ,1.06-0.82(m,12H)ppm。 {4-[(2S)-2-[(2S)-2-[(2R)-2-氨基-6-[2-(环辛-2-炔-1-基氧基)乙酰胺基]己酰胺 基]-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲基N-(4-{2-[(1S,2S,4R , 8S,9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙基-5,7-二氧杂 五环[10.8.0.02,9.04 ,8.013 ,18]二十烷-14,17-二烯-8-基]-2-氧乙氧基}苯基)氨基甲酸酯 (5c) [0444] 根据一般方法D,由化合物3c(55mg,54μmol)和4a,得到化合物5c(0.10g,57%收 率)为白色固体。ESI m/z:1255.5(M 1) 。1H NMR(400MHz,MeODd4)δ7.61(d ,J=8.4Hz,2H) , 7.32-7.39(m,5H) ,6.84-6.88(m,2H) ,6.31-6.36(m,2H) ,5.05-5.16(m,3H) ,4.71-4.83(m, 1H) ,4.50-4.54(m,1H) ,4.18-4.33(m3H) ,3.00-2.85(m,2H) ,3.40-3.51(m,1H) ,3.00-3.29 418 CN 111601619 A 说 明 书 266/306 页 (m,6H) ,1.31-2.35(m,34H) ,1.29(t,J=7.2Hz,2H) ,0.93-1.02(m,12H)ppm。 (2R)-2-氨基-6-[2-(环辛-2-炔-1-基氧基)乙酰胺基]-N-[(1S)-1-{[(1S)-1-[(4-{2- [(1S,2S,4R ,8S,9S,11S,12R ,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙 基-5,7-二氧杂五环[10.8.0.02,9.04 ,8.013 ,18]二十烷-14,17-二烯-8-基]-2-氧乙氧基}苯 基)氨基甲酰基]乙基]氨基甲酰基}-2-甲基丙基]己酰胺(5d) [0445] 根据一般方法D,由化合物3d(0.28g,0.38mmol)开始,并通过制备型HPLC(方法B) 分离后得到化合物5d(0 .21g,46%收率)为白色固体。ESI m/z:1021 .5(M 1) 。1H NMR (400MHz,MeODd4)δ7.33-7.60(m,3H) ,6.87-6.91(m,2H) ,6.32-6.37(m,2H) ,5.47-5.65(m, 1H) ,5.07-5.30(m,1H) ,4.72-4.86(m,3H) ,4.34-4.51(m,3H) ,3.83-4.20(m,3H) ,3.33-3.49 (m,1H) ,3.14-3.27(m,3H) ,2.59-2.75(m,1H) ,1.31-2.39(m,33H) ,0.93-1.05(m,12H)ppm。 (2R)-2-氨基-N-[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-[(4-{2-[(1S,2S,4R ,8S, 9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙基-5,7-二氧杂五 环[10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-8-基]-2-氧乙氧基}苯基)氨基甲酰基]丁 基]氨基甲酰基}-2-甲基丙基]-6-[2-(环辛-2-炔-1-基氧基)乙酰胺基]己酰胺(5e) [0446] 根据一般方法D,由化合物3e(0.10g,0.12mmol)开始,并通过反相快速色谱法(0- 100%乙腈的碳酸氢铵水溶液(10mM))纯化后得到化合物5d(0.12g,88%收率)为白色固体。 ESI m/z:553.7(M/2 1) 。 (1S,4aS,10aR)-6-((2S)-2-((2S)-2-((2R)-2-氨基-6-(2-(环辛-2-炔基氧基)乙酰胺 基)己酰胺基)-3-甲基丁酰胺基)丙酰胺基)-N-((1S,4aS,10aR)-6-羟基-1,4a-二甲基-1, 2,3,4,4a,9,10,10a-八氢菲-1-羰基)-1,4a-二甲基-1,2,3,4,4a ,9,10,10a-八氢菲-1-甲 酰胺(5f) [0447] 根据一般方法D,由化合物3f(80mg,0.11mmol)开始,并通过制备型HPLC(方法B)分 离后得到化合物5f(48mg,84%收率)为白色固体。ESI m/z:991.5(M 1) 。 {4-[(2S)-2-[(2S)-2-[(2R)-2-氨基-6-[2-(环辛-2-炔-1-基氧基)乙酰胺基]己酰胺 419 CN 111601619 A 说 明 书 267/306 页 基]-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲基N-[(1S)-1-{[(4bS,8S, 8aR)-8-({[(1S,4aS,10aR)-6-羟基-1,4a-二甲基-1,2,3,4,4a,9,10,10a-八氢菲-1-基]甲 酰胺基}羰基)-4b,8-二甲基-4b,5,6,7,8,8a ,9,10-八氢菲-3-基]氨基甲酰基}-2-羟基乙 基]氨基甲酸酯(5g) [0448] 在室温下,向化合物4a(24mg,44μmol)的DMF(2mL)溶液中依次加入HATU(17mg,44μ mol)和化合物3g(35mg,34μmol)。混合物在室温下搅拌几分钟,直至混合物均匀。在室温下 通过注射器向此混合物中加入DIPEA(8.8mg,68μmol)。所得混合物在室温下搅拌2小时,直 至根据LCMS监测3g已大部分耗尽。然后在室温下向此反应混合物中滴加二乙胺或哌啶 (0.1mL,过量)[1],将混合物搅拌1小时,直至脱去Fmoc基团,通过LCMS进行监测。反应混合物 经制备型HPLC(方法B)直接纯化,得到化合物5g(15mg,33%收率)为白色固体。ESI m/z: 1313.6(M H) 。1H NMR(500MHz,MeODd4)δ7.59(d,J=8.5Hz,2H) ,7.51(s,1H) ,7.36-7.26(m, 3H) ,7.01(d ,J=8.5Hz,1H) ,6.88(d ,J=8.0Hz,1H) ,6.72-6.71(m,1H) ,6.57-6.54(m,1H) , 5.09(s,2H) ,4.64-4.52(m,1H) ,4.35-4.28(m,2H) ,4.21(d ,J=7.0Hz,1H) ,4.01-3.98(m, 1H) ,3.88-3.84(m,3H) ,3.43(t,J=6.5Hz,1H) ,3.26-3.10(m,4H) ,3.00-2.76(m,3H) ,2.38- 2.24(m,7H) ,2.19-2.02(m,9H) ,1.98-1.78(m,4H) ,1.74-1.54(m,12H) ,1.45-1.26(m,14H) , 1.13(s,6H) ,1.00(t,J=7.5Hz,6H)ppm。 实施例10-1 [0449] 化合物10a-d的制备(图11C) [0450] 化合物10a-d根据图11C所示的酰胺偶联方法制备得到。 [0451] 化合物10a-d的一般方法D2:在室温下,向DIBAC-suc-PEG4-酸8a(1.1-1.3当量)的 DMF溶液(1mL/5-10mg8a)中加入HATU(1.5当量)和DIPEA(5.0当量)。混合物在室温下搅拌半 小时,然后加入化合物3(1 .0当量)。所得混合物在室温下搅拌直至化合物3被耗尽,通过 LCMS进行监测。将反应化合物过滤后,滤液直接经制备型HPLC纯化,得到化合物10a-d。 实施例10A 化合物10a的制备(参见图11A) {4-[(2S)-2-[(2S)-2-氨基-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基} 甲基N-{2-[(1S,2S,4R,8S,9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16- 氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04 ,8.013,18]二十烷-14,17-二烯-8-基]-2-氧乙 基}氨基甲酸酯10a 420 CN 111601619 A 说 明 书 268/306 页 [0452] 在室温下,通过注射器向Fmoc-VC-PAB-PNP(10-1,0.17g,0.22mmol)和化合物B (93mg,0.20mmol)的DMF(3mL)溶液中加入DIPEA(51mg,0.40mmol)。混合物在室温下搅拌3小 时,并根据LCMS监测大部分物料耗尽。向所得混合物中加入哌啶(0.3mL,过量),并将反应混 合物在室温下搅拌1小时,直至完全脱去Fmoc,通过LCMS进行监测。混合物通过膜过滤后,将 滤液直接经制备型HPLC(方法B)纯化,得到化合物3b(0.13g,73%收率)为白色固体。ESI m/ z:871(M 1) 。 {4-[(2S)-2-[(2S)-2-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5,7 , 13,15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-3-甲基 丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲基N-{2-[(1S,2S,4R,8S,9S,11S,12R, 13S ,19S)-12 ,19-二氟-11-羟基-9 ,13-二甲基-16-氧-6-丙基-5 ,7-二氧杂五环 [10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-8-基]-2-氧乙基}氨基甲酸酯10a [0453] 在室温下,向酸8a(30mg,54μmol)的DMF(5mL)溶液中依次加入DIPEA(13mg, 0.10mmol)和HATU(31mg,81μmol)。所得混合物在此温度下搅拌0.5小时,然后加入胺3b (43mg,50μmol)。反应混合物在室温下搅拌3小时,直至胺完全耗尽,通过LCMS进行监测。反 应混合物通过膜过滤,然后将滤液经制备型HPLC(方法B)进行分离,得到化合物10a(16mg, 23%收率)为白色固体。ESI m/z:1406(M H) 。1H NMR(500MHz,DMSOd6)δ9.99(s ,1H) ,8.11 (d,J=7.5Hz,1H) ,7.88(d,J=8.5Hz,1H) ,7.80-7.75(m,1H) ,7.70-7.66(m,1H) ,7.65-7.60 (m ,3H) ,7 .53-7 .33(m ,6H) ,7 .33-7 .28(m ,3H) ,6.30(dd ,J=10.0Hz,1 .5Hz,1H) ,6.11(s , 1H) ,6.10-6.00(m ,1H) ,5.72-5.55(m ,2H) ,5.41(s ,2H) ,5.05-5.01(m ,1H) ,4.97(s ,2H) , 4.80-4.72(m,1H) ,4.60-4.58(m,1H) ,4.43-4.33(m,1H) ,4.25-4.10(m,3H) ,3.88-3.80(m, 1H) ,3.65-3.55(m ,3H) ,3.50-3.40(m ,12H) ,3.30-3.25(m ,2H) ,3.12-2.90(m ,4H) ,2.70- 2.55(m,2H) ,2.48-2.35(m,2H) ,2.30-2.20(m,2H) ,2.15-1.95(m,4H) ,1.86-1.65(m,3H) , 1 .64-1 .54(m ,5H) ,1 .49(s ,4H) ,1 .46-1 .34(m ,5H) ,0.90-0.80(m ,12H)ppm。分析型HPLC: 100%,保留时间:7.40min(方法B)。溶解度:0.02mg/mL水。 实施例10B 1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5,7,13,15-六烯-10-炔-2-基}- 4-氧丁酰胺基)-N-[(1S)-1-{[(1S)-1-{[(4bS,8S,8aR)-8-{[(1S,4aS,10aR)-6-羟基-1 , 421 CN 111601619 A 说 明 书 269/306 页 4a-二甲基-1,2,3,4,4a,9,10,10a-八氢菲-1-羰基]氨基甲酰基}-4b,8-二甲基-4b,5,6,7, 8,8a,9,10-八氢菲-3-基]氨基甲酰基}乙基]氨基甲酰基}-2-甲基丙基]-3,6,9,12-四氧杂 十五烷-15-酰胺10b的制备(参见图11B) [0454] 根据图11B所示的酰胺偶联方法进行制备。根据一般方法D2,将胺3f(20mg,29μ mol)、酸8a(18mg,33μmol)、HATU(33mg,87μmol)和DIPEA(33mg,87μmol)在15-20℃下、于1mL DMF中搅拌16小时,反应混合物经制备型HPLC(方法B)进行纯化。10b的收率:10mg,28%。ESI m/z:1234(M H) 。 [0455] 1H NMR(500MHz,CH3ODd4)δ7.65(d ,J=7.4Hz,1H) ,7.62-7.51(m ,2H) ,7.48-7.28 (m ,6H) ,7 .27-7 .21(m ,1H) ,7 .00(d ,J=8.5Hz ,1H) ,6 .88(d ,J=8.0Hz ,1H) ,6 .72(d ,J= 2.4Hz,1H) ,6.56(dd,J=8.3,2.4Hz,1H) ,5.15-5.10(m,1H) ,4.52-4.43(m,1H) ,4.20(d,J= 6.5Hz,0.5H) ,4.04(d ,J=7.9Hz,0.5H) ,3.77-3.64(m,3H) ,3.63-3.49(m,12H) ,3.47-3.39 (m,2H) ,3.24(t,J=5.5Hz,2H) ,2.99-2.66(m,5H) ,2.57-2.42(m,2H) ,2.42-1.94(m,14H) , 1.76-1.63(m,4H) ,1.48-1.21(m,13H) ,1.14-1.10(m,6H) ,1.05-0.97(m,6H)ppm。 [0456] 分析型HPLC:>99%,保留时间:9.21min(方法B)。 [0457] 溶解度:<0.1mg/mL水。 实施例10C [0458] {4-[(2S)-2-[(2S)-2-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5, 7,13,15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-3-甲 基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲基N-(4-{2-[(1S,2S,4R,8S,9S,11S, 12R ,13S ,19S)-12 ,19-二氟-11-羟基-9 ,13-二甲基-16-氧-6-丙基-5 ,7-二氧杂五环 [10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-8-基]-2-氧乙氧基}苯基)氨基甲酸酯(10c) [0459] 根据一般方法D2,由化合物3c(58mg,60μmol)和化合物8a,得到化合物10c(20mg, 22%收率)为白色固体。ESI m/z:1499(M H) 。1H NMR(400MHz,DMSOd6)δ10.02(s,1H) ,9.59 (s,1H) ,8.14(d ,J=7.6Hz,1H) ,7.88(d ,J=8.8Hz,1H) ,7.80-7.75(m,1H) ,7.70-7.66(m, 1H) ,7.65-7.60(m,3H) ,7.53-7.45(m,3H) ,7.40-7.28(m,7H) ,6.84(d ,J=9.2Hz,2H) ,6.30 (dd ,J=10.4Hz,1 .6Hz,1H) ,6.11(s ,1H) ,6.10-6.00(m ,1H) ,5.72-5.55(m ,1H) ,5.52(s , 422 CN 111601619 A 说 明 书 270/306 页 1H) ,5.43(s,2H) ,5.16-5.05(m,4H) ,4.88-4.70(m,3H) ,4.43-4.33(m,1H) ,4.25-4.20(m, 2H) ,3.65-3.55(m ,3H) ,3.50-3.40(m ,12H) ,3.30-3.25(m ,2H) ,3.12-2.90(m ,4H) ,2.70- 2.55(m,2H) ,2.48-2.43(m,1H) ,2.40-2.35(m,1H) ,2.30-2.20(m,2H) ,2.15-1.95(m,4H) , 1.86-1.75(m,2H) ,1.64-1.54(m,5H) ,1.49(s,4H) ,1.46-1.34(m,4H) ,1.23(s,2H) ,0.90- 0.80(m,12H)ppm。溶解度:<0.01mg/mL水。 实施例10D [0460] {4-[(2S)-2-[(2S)-2-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5, 7,13,15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-3-甲 基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲基N-[(1S)-1-{[(1S)-1-{[(3R,4S, 5S)-1-[(2S)-2-[(1R,2R)-2-{[(1S,2R)-1-羟基-1-苯基丙烷-2-基]氨基甲酰基}-1-甲氧 基-2-甲基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1-氧庚烷-4-基](甲基)氨基甲酰基}-2- 甲基丙基]氨基甲酰基}-2-甲基丙基]-N-甲基氨基甲酸酯(10d) [0461] 根据一般方法D2,由vcPAB-MMAE 3a(6.9mg,6.1μmol)和化合物8a,得到化合物10d (2.0mg,20%收率)为白色固体。ESI m/z:830(M/2 H) 。1H NMR(500MHz,DMSOd6)δ9.98(s , 1H) ,8 .29(s ,1H) ,8 .11(d ,J=7.3Hz ,1H) ,8 .04(s ,1H) ,7 .92-7 .82(m ,2H) ,7 .75(t ,J= 5.1Hz,1H) ,7 .68(d ,J=7.2Hz,1H) ,7 .65-7 .53(m ,3H) ,7 .53-7 .42(m ,3H) ,7 .41-7 .22(m , 9H) ,7 .22-7 .10(m ,1H) ,6.06-5.91(m ,1H) ,5.75(s ,1H) ,5.40(s ,2H) ,5.33(d ,J=4.8Hz, 1H) ,5.15-4.91(m,3H) ,4.79-4.57(m,1H) ,4.54-4.46(m,1H) ,4.46-4.32(m,2H) ,4.32-4.17 (m,2H) ,4.08-3.88(m,2H) ,3.67-3.53(m,4H) ,3.50-3.40(m,12H) ,3.27-3.15(m,8H) ,3.14- 2.91(m,8H) ,2.91-2.80(m,3H) ,2.62-2.53(m,1H) ,2.41-2.33(m,2H) ,2.32-2.19(m,2H) , 2.17-2.05(m,2H) ,2.05-1.90(m,4H) ,1.86-1.65(m,5H) ,1.64-1.52(m,2H) ,1.52-1.40(m, 2H) ,1.39-1.27(m,2H) ,1.07-0.95(m,6H) ,0.90-0.67(m,26H)ppm。 实施例11 中间体6c的制备(参见图12) [0462] 如图12所示,通过将牛磺酸与活化酯30进行酰胺化来合成叠氮基中间体6c。 1-叠氮基-15-氧-3,6,9,12-四氧杂-16-氮杂十八烷-18-磺酸(6c) [0463] 向2,5-二氧吡咯烷-1-基1-叠氮基-3,6,9,12-四氧杂十五烷-15-酸酯30(0.10g, 0.26mmol)和牛磺酸(39mg,0.31mmol)的无水DMF(4mL)溶液中加入二异丙基乙胺(15mg, 0.52mmol)。混合物在25℃下搅拌过夜。将反应混合物过滤,所得溶液经制备型HPLC(方法A) 纯化,得到中间体6c(0 .80g,收率78%)为无色油状物。ESI m/z:399 .1(M H) 。1H NMR (500MHz,D2O)δ3.69(t,J=6.0Hz,2H) ,3.64-3.59(m,14H) ,3.49(t,J=6.5Hz,2H) ,3.41(t, J=4.5Hz,2H) ,3.00(t,J=7.0Hz,2H) ,2.45(t,J=6.0Hz,2H)ppm。 实施例11A [0464] 如图13A所示,通过将化合物6b-1与活化酯30进行酰胺化来合成叠氮基中间体6b。 423 CN 111601619 A 说 明 书 271/306 页 [0465] [2-(1-叠氮基-3,6,9,12-四氧杂十五烷-15-酰胺基)乙基]三甲基氯化铵(6b) [0466] 向叠氮基-PEG4-NHS 30(0.19g,0.50mmol)的无水DMF(4mL)溶液中加入化合物6b- 1(83mg,0.60mmol)和DIPEA(19g,1.5mmol)。混合物在25℃下搅拌过夜。将混合物过滤,所得 滤液经制备型HPLC(方法A)纯化,得到化合物6b(0.13g,64%收率)为无色油状物。ESI m/z: 376(M H) 。1H NMR(500MHz,DMSOd6)δ3.65-3.58(m,4H) ,3.58-3.45(m,16H) ,3.45-3.30(m, 12H) ,2.35(t,J=6.5Hz,2H)ppm。 实施例11B [0467] 叠氮基中间体6a通过商购得到,CAS号为86770-69-6。 实施例11C [0468] [2-(1-叠氮基-3,6,9,12-四氧杂十五烷-15 [0469] 通过用叠氮化物基团部分置换溴,然后水解,由化合物6d-1合成得到叠氮基中间 体6f。 [0470] 17-叠氮基-3,6,9,12,15-五氧杂十七烷基膦酸(6f)(参见图13B) [0471] 向10mL圆底烧瓶中加入6d-1(50mg,0.11mmol)、叠氮化钠(28mg,0.43mmol)、乙腈 (2mL)和水(2mL)。混合物在80℃下搅拌16小时。LCMS显示6d-1完全耗尽。将反应冷却至室 温,真空除去乙腈。将所得残余物在乙酸乙酯(20mL)和水(20mL)之间分层。有机层用H2O (15mL×2)和盐水(15mL)洗,经无水Na2SO4干燥,过滤,浓缩,得到6d-2(35mg,收率76%,ESI m/z:428.2(M H) )为红色油状物,将其溶于无水DMF(2mL)。在0℃下,向此溶液中加入三甲 基溴硅烷(TMSBr,0.12g,0.32mmol)。混合物在0℃下搅拌30分钟,然后在室温下搅拌16小 时。真空除去挥发物,将残余物与干燥的甲苯共蒸发(3次)。将残余物溶于水并进行冻干,得 到粗制的6f(粗品收率>100%)为油状物,其无需进一步纯化即可用于下一步骤。 实施例11E [0472] 叠氮基中间体6e通过商购得到,CAS号为35899-89-9。 实施例11F [0473] 叠氮基中间体麦芽糖-N3(6g)是根据Tetrahedron Letters ,2001 ,42(7) ,1325- 1328中所述方法合成得到。 实施例12 中间体6d的制备(参见图13) [0474] 如图13所示方法来合成具有双磺酸的叠氮基中间体6d。叠氮基乙胺31与2当量的 溴乙酸酯32反应,然后水解,得到双酸33,将其与五氟苯酚34反应转化为活化酯35。将化合 物35用牛磺酸进行酰胺化,得到中间体6d。 2-{2-[(2-叠氮基乙基)({[(2-磺乙基)氨基甲酰基]甲基})氨基]乙酰胺基}乙烷-1-磺 酸(6d) 424 CN 111601619 A 说 明 书 272/306 页 [0475] 向2-叠氮基乙胺31(0.52g,6.0mmol)的乙腈(50mL)溶液中加入2-溴乙酸叔丁酯32 (2.6g,13mmol)和碳酸钠(3.2g,30mmol)。所得悬浮液回流16小时。冷却至室温后,将混合物 过滤,滤液真空浓缩,得到黄色油状物(1.6g,ESI m/z:315(M H) )。将0.62g油状产物溶于 盐酸的二氧六环溶液(4N,10mL)。混合物在25℃下搅拌过夜,LCMS显示反应完成。真空除去 挥发物,得到化合物33(0.39g,ESI m/z:203(M H) )的盐酸盐,将其0.20g溶于DCM(5mL),无 需进一步纯化即可用于下一步骤。向溶液中加入DIC(0 .38g,3 .0mmol)、DIPEA(0 .77g, 6.0mmol)和五氟苯酚34(0.55g,3.0mol)。反应混合物在室温下搅拌过夜。LCMS显示反应完 成。将混合物真空浓缩,得到粗品35(ESI m/z:289(M/2 Na) ),将其溶于DMF(5mL)。向所得 溶液中加入牛磺酸(0.38g,3.0mmol)和DIPEA(0.52g,4.0mmol)。混合物在25℃下搅拌过夜, 所得混合物直接经反相快速色谱法纯化(0-10%乙腈的水溶液(含0.01%TFA)),得到化合 物6d(0.18g,从2-叠氮基乙胺开始的收率为34%)为白色固体。ESI m/z:417(M H) 。 实施例13 中间体7a、7c、7e、7f、7j、7k、7l、7m、7q、7ab、7ad、7ae、7bb、7cb、7fb的制备(参见图14) [0476] 一般方法E:在室温下,向化合物5的DMF溶液(0.5mL/10mg 5)中加入叠氮基中间体 6(1.5当量)和DIPEA(0.1mL/10mg 5)。反应在室温下搅拌24小时,LCMS显示反应完成。反应 混合物经制备型HPLC直接纯化,得到化合物7为白色固体。 {4-[(2S)-2-[(2S)-2-[(2R)-2-氨基-6-(2-{[1-(17-羟基-3,6,9,12,15-五氧杂十七 烷-1-基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-4-基]氧基}乙酰胺基)己酰胺 基]-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲基N-[(1S)-1-{[(1S)-1- {[(3R ,4S,5S)-1-[(2S)-2-[(1R ,2R)-2-{[(1S,2R)-1-羟基-1-苯基丙烷-2-基]氨基甲酰 基}-1-甲氧基-2-甲基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1-氧庚烷-4-基](甲基)氨基 甲酰基}-2-甲基丙基]氨基甲酰基}-2-甲基丙基]-N-甲基氨基甲酸酯(7a) [0477] 根据一般方法E,由化合物5a(30mg,21μmol)与化合物6a(20mg,64μmol),得到化合 物7a(30mg,74%收率)为白色固体。ESI m/z:862(M/2 H) 。1H NMR(MeODd4,500MHz):δ7.66- 7.57(m,2H) ,7.44-7.29(m,6H) ,7.26-7.18(m,1H) ,5.25-5.04(m,2H) ,4.88-4.74(m,2H) , 4.70-4.47(m,2H) ,4.59-4.48(m,4H) ,4.29-4.17(m,4H) ,4.00-3.95(m,2H) ,3.93-3.88(m, 2H) ,3.76-3.70(m ,1H) ,3.69-3.64(m ,10H) ,3.62-3.59(m ,2H) ,3.59-3.55(m ,8H) ,3.49- 3.42(m,2H) ,3.38-3.36(m,4H) ,3.31-3.28(m,3H) ,3.27-3.17(m,3H) ,3.15-3.06(m,3H) , 3.00-2.87(m,4H) ,2.57-2.46(m,2H) ,2.41-2.18(m,2H) ,2.17-1.99(m,5H) ,1.98-1.86(m, 425 CN 111601619 A 说 明 书 273/306 页 3H) ,1.85-1.68(m,6H) ,1.67-1.54(m,9H) ,1.50-1.36(m,4H) ,1.34-1.25(m,1H) ,1.22-1.12 (m,6H) ,1.06-0.98(m,11H) ,0.96-0.93(m,3H) ,0.92-0.84(m,9H) ,0.79(m,2H) .ppm。 2-{1-[4-({[(5R)-5-氨基-5-{[(1S)-1-{[(1S)-4-(氨基甲酰基氨 基)-1-({4-[({[(1S)-1-{[(1S)-1-{[(3R ,4S,5S)-1-[(2S)-2-[(1R ,2R)-2-{[(1S, 2R)-1-羟基-1-苯基丙烷-2-基]氨基甲酰基}-1-甲氧基-2-甲基乙基]吡咯烷-1-基]-3-甲 氧基-5-甲基-1-氧庚烷-4-基](甲基)氨基甲酰基}-2-甲基丙基]氨基甲酰基}-2-甲基丙 基](甲基)氨基甲酰基}氧基)甲基]苯基}氨基甲酰基)丁基]氨基甲酰基}-2-甲基丙基]氨 基甲酰基}戊基]氨基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-1- 基]-3,6,9,12-四氧杂十五烷-15-酰胺基}乙烷-1-磺酸(7c) [0478] 根据一般方法E,由化合物5a(28mg,20μmol)与化合物6c(20mg,50μmol),得到化合 物7c(20mg,56%收率)为白色固体。ESI m/z:907.3(M/2 H) 。 2-{1-[4-({[(5R)-5-氨基-5-{[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-[(4-{[({2- [(1S,2S,4R ,8S,9S,11S,12R ,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙 基-5,7-二氧杂五环[10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-8-基]-2-氧乙基}氨基甲 酰基)氧基]甲基}苯基)氨基甲酰基]丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰基}戊基]氨 基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-1-基]-3,6,9,12-四 氧杂十五烷-15-酰胺基}乙烷-1-磺酸(7e) [0479] 根据一般方法E,由化合物5b(60mg,52μmol)与化合物6c,得到化合物7e(60mg, 74%收率)为白色固体。ESI m/z:781(M/2 H) 。1H NMR(400MHz,MeODd4)δ7.61(d,J=8.5Hz, 2H) ,7.39-7.28(m,3H) ,6.39-6.30(m,2H) ,5.66-5.46(m,1H) ,5.29-5.13(m,1H) ,5.12-5.04 (m,3H) ,4.72-4.60(m,2H) ,4.56-4.49(m,2H) ,4.36-3.84(m,8H) ,3.76-3.70(m,2H) ,3.66- 3.54(m,14H) ,3.30-3.23(m,2H) ,3.21-3.04(m,3H) ,3.03-2.97(m,2H) ,2.96-2.84(m,1H) , 2.75-2.52(m,1H) ,2.50-2.42(m,2H) ,2.39-2.01(m,6H) ,1.99-1.78(m,6H) ,1.74-1.22(m, 22H) ,1.03-0.87(m,12H)ppm。 426 CN 111601619 A 说 明 书 274/306 页 2-[2-({2-[4-({[(5R)-5-氨基-5-{[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-[(4- {[({2-[(1S,2S,4R,8S,9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧- 6-丙基-5,7-二氧杂五环[10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-8-基]-2-氧乙基}氨 基甲酰基)氧基]甲基}苯基)氨基甲酰基]丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰基}戊 基]氨基甲酰基}甲氧基)-1H ,4H ,5H ,6H ,7H ,8H ,9H-环辛并[d][1 ,2 ,3]三唑-1-基]乙基} ({[(2-磺乙基)氨基甲酰基]甲基})氨基)乙酰胺基]乙烷-1-磺酸(7f) [0480] 根据一般方法E,由化合物5b(0.10g,86μmol)与化合物6d,得到化合物7f(65mg, 48%收率)为白色固体。ESI m/z:790(M/2 H) 。1H NMR(500MHz,DMSOd6)δ10.1-10.0(m,1H) , 8.60-8.50(m,1H) ,8.40-8.30(m,1H) ,8.30-8.20(m,2H) ,8.15-8.00(m,4H) ,7.60-7.55(m, 2H) ,7 .50-7 .40(m ,1H) ,7 .30-7 .20(m ,4H) ,6 .30(d ,J=10.5Hz ,1H) ,6 .15-6 .00(m ,2H) , 5.70-5.55(m,3H) ,4.98(s,2H) ,4.80-4.70(m,1H) ,4.59(t,J=4.0Hz,1H) ,4.50-4.45(m, 1H) ,4.40-4.35(m ,2H) ,4.25-4.10(m ,2H) ,3.95-3.80(m ,4H) ,3.20-2.90(m ,10H) ,2.85- 2.75(m,2H) ,2.70-2.60(m,4H) ,2.31-2.10(m,3H) ,2.10-1.95(m,6H) ,1.80-1.65(m,6H) , 1 .65-1 .55(m ,7H) ,1 .40-1 .20(m ,12H) ,1 .20-1 .10(m ,1H) ,1 .06(t,J=7.0Hz,1H) ,1 .02- 1.00(m,1H) ,0.90-0.80(m,16H)ppm。 2-{1-[4-({[(5R)-5-氨基-5-{[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-{[4-({[(4- {2-[(1S,2S,4R,8S,9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧-6- 丙基-5,7-二氧杂五环[10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-8-基]-2-氧乙氧基}苯 基)氨基甲酰基]氧基}甲基)苯基]氨基甲酰基}丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰 基}戊基]氨基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-1-基]-3, 6,9,12-四氧杂十五烷-15-酰胺基}乙烷-1-磺酸(7i) [0481] 根据一般方法E,由化合物5c(55mg,54μmol)与化合物6c,得到化合物7i(53mg,收 427 CN 111601619 A 说 明 书 275/306 页 率43%)为白色固体。ESI m/z:827.6(m/2 H) 。1HNMR(400MHz,MeODd4)δ7.63-7.61(m,2H) , 7.40-7.29(m,5H) ,6.89-6.85(m,2H) ,6.38-6.33(m,2H) ,5.65-5.48(m,1H) ,5.31-5.06(m, 4H) ,4.91-4.70(m ,4H) ,4.65-4.22(m ,5H) ,4.07-3.86(m ,5H) ,3.74-3.63(m ,16H) ,3.33- 2.82(m,4H) ,2.76-1.21(m,39H) ,1.06-0.93(m,12H)ppm。 2-{1-[4-({[(5R)-5-氨基-5-{[(1S)-1-{[(1S)-1-[(4-{2-[(1S,2S,4R,8S,9S,11S, 12R ,13S ,19S)-12 ,19-二氟-11-羟基-9 ,13-二甲基-16-氧-6-丙基-5 ,7-二氧杂五环 [10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-8-基]-2-氧乙氧基}苯基)氨基甲酰基]乙基] 氨基甲酰基}-2-甲基丙基]氨基甲酰基}戊基]氨基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H, 9H-环辛并[d][1,2,3]三唑-1-基]-3,6,9,12-四氧杂十五烷-15-酰胺基}乙烷-1-磺酸(7j) [0482] 根据一般方法E,由化合物5d(55mg,54μmol)与化合物6c,得到化合物7j(70mg, 67%收率)为白色固体。ESI m/z:709.9(M/2 H) 。1H NMR(400MHz,MeODd4)δ7.58-7.48(m , 2H) ,7.35(d ,J=8.8Hz,1H) ,6.92-6.88(m,2H) ,6.38-6.34(m,1H) ,6.33(s,1H) ,5.65-5.46 (m,1H) ,5.31-5.07(m,2H) ,4.87-4.44(m,7H) ,4.36-4.13(m,2H) ,4.06-3.87(m,5H) ,3.75- 3.55(m ,16H) ,3.33-2.60(m ,6H) ,2.47-1 .79(m ,13H) ,1 .72-1 .43(m ,21H) ,1 .03-0.94(m , 12H)ppm。 2-{1-[4-({[(5R)-5-氨基-5-{[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-[(4-{2- [(1S,2S,4R ,8S,9S,11S,12R ,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙 基-5,7-二氧杂五环[10.8.0.02,9.04 ,8.013 ,18]二十烷-14,17-二烯-8-基]-2-氧乙氧基}苯 基)氨基甲酰基]丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰基}戊基]氨基甲酰基}甲氧基)- 1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-1-基]-3,6,9,12-四氧杂十五烷-15-酰胺 基}乙烷-1-磺酸(7k) [0483] 根据一般方法E,由化合物5e(60mg,54μmol)与化合物6c,得到化合物7k(50mg, 428 CN 111601619 A 说 明 书 276/306 页 61%收率)为白色固体。ESI m/z:753(M/2 H) 。 1-(4-(2-((R)-5-氨基-6-((S)-1-((S)-1-((4bS,8S,8aR)-8-((1S,4aS,10aR)-6-羟 基-1,4a-二甲基-1,2,3,4,4a,9,10,10a-八氢菲-1-羰基氨基甲酰基)-4b,8-二甲基-4b,5, 6,7,8,8a ,9,10-八氢菲-3-基氨基)-1-氧丙烷-2-基氨基)-3-甲基-1-氧丁烷-2-基氨基)- 6-氧己基氨基)-2-氧乙氧基)-4,5,6,7,8,9-六氢-1H-环辛并[d][1,2,3]三唑-1-基)-15- 氧-3,6,9,12-四氧杂-16-氮杂十八烷-18-磺酸(7m) [0484] 根据一般方法E,由化合物5f(40mg,40μmol)与化合物6c,得到化合物7m(52mg, 77%收率)为白色固体。ESI m/z:695.4(M/2 H) 。 2-{1-[4-({[(5R)-5-氨基-5-{[(1S)-1-{[(1S)-1-({4-[({[(1S)-1-{[(4bS,8S,8aR)- 8-({[(1S,4aS,10aR)-6-羟基-1,4a-二甲基-1,2,3,4,4a ,9,10,10a-八氢菲-1-基]甲酰胺 基}羰基)-4b,8-二甲基-4b,5,6,7,8,8a,9,10-八氢菲-3-基]氨基甲酰基}-2-羟基乙基]氨 基甲酰基}氧基)甲基]苯基}氨基甲酰基)-4-(氨基甲酰基氨基)丁基]氨基甲酰基}-2-甲基 丙基]氨基甲酰基}戊基]氨基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3] 三唑-1-基]-3,6,9,12-四氧杂十五烷-15-酰胺基}乙烷-1-磺酸(7q) [0485] 在0℃下,向化合物6c(20mg,50μmol)的水(1mL)溶液中滴加饱和NaHCO3水溶液直 至pH~7。然后通过注射器向所述搅拌溶液中加入化合物5?(28mg,21μmol)的乙腈(1mL)溶 液。混合物在25℃下搅拌过夜。反应混合物用LCMS监测,直至化合物5?完全耗尽。将反应混 合物过滤,并经制备型HPLC(方法A)纯化,得到化合物7q(15mg,41%收率)为白色固体。ESI m/z:856.5(M/2 1) 。 [0486] (2-{1-[4-({[(5R)-5-氨基-5-{[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-({4- [({[(1S)-1-{[(1S)-1-{[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-2-{[(1S,2R)-1-羟基-1-苯基 丙烷-2-基]氨基甲酰基}-1-甲氧基-2-甲基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1-氧庚 烷-4-基](甲基)氨基甲酰基}-2-甲基丙基]氨基甲酰基}-2-甲基丙基](甲基)氨基甲酰基} 氧基)甲基]苯基}氨基甲酰基)丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰基}戊基]氨基甲 429 CN 111601619 A 说 明 书 277/306 页 酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-1-基]-3,6,9,12-四氧杂 十五烷-15-酰胺基}乙基)三甲基氯化铵(7ab) [0487] 根据一般方法,由化合物5a(55mg,39μmol)与化合物6b,除了在50℃下搅拌过夜, 得到化合物7ab(50mg,70%收率)为白色固体。ESI m/z:896[(M H)/2] 。1H NMR(400MHz , DMSOd4)δ9.35(s,1H) ,8.95(s,1H) ,8.43-8.34(m,1H) ,8.07-8.00(m,1H) ,7.91-7.83(m,1H) , 7.79-7.60(m,4H) ,7.33-7.23(m,6H) ,7.20-7.13(m,1H) ,6.30-5.80(m,1H) ,5.49-5.34(m, 1H) ,5 .12-4 .83(m ,3H) ,4 .77-4 .71(m ,1H) ,4 .54-4 .38(m ,4H) ,4 .27(t ,J=11 .6Hz ,1H) , 4.03-3.93(m ,4H) ,3.85-3.75(m ,5H) ,3.59(t,J=6.2Hz,3H) ,3.50-3.40(m ,15H) ,3.38- 3.35(m,2H) ,3.26-3.16(m,7H) ,3.13-3.03(m,14H) ,2.99-2.92(m,4H) ,2.89-2.78(m,4H) , 2.44-2.38(m,1H) ,2.34(t,J=6.2Hz,2H) ,2.30-2.22(m,2H) ,2.15-1.93(m,6H) ,1.85-1.42 (m,19H) ,1.37-1.23(m,3H) ,1.06-0.96(m,7H) ,0.94-0.71(m,27H)ppm。 [0488] {17-[4-({[(5R)-5-氨基-5-{[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-({4- [({[(1S)-1-{[(1S)-1-{[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-2-{[(1S,2R)-1-羟基-1-苯基 丙烷-2-基]氨基甲酰基}-1-甲氧基-2-甲基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1-氧庚 烷-4-基](甲基)氨基甲酰基}-2-甲基丙基]氨基甲酰基}-2-甲基丙基](甲基)氨基甲酰基} 氧基)甲基]苯基}氨基甲酰基)丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰基}戊基]氨基甲 酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-1-基]-3,6,9,12,15-五氧 杂十七烷-1-基}膦酸(7ad) [0489] 根据一般方法,由化合物5a(18mg,13μmol)与化合物6f(14mg,38μmol),得到化合 物7ad(15mg,58%收率)为白色固体。ESI m/z:893.9(M/2 H) 。1H NMR(MeODd4,500MHz):δ 7.98-7.91(m,1H) ,7.79-7.59(m,2H) ,7.41-7.20(m,6H) ,5.51-5.06(m,2H) ,4.78-4.53(m, 6H) ,4.29-3.88(m ,9H) ,3.78-3.75(m ,3H) ,3.64-3.58(m ,16H) ,3.47-3.36(m ,6H) ,3.29- 3.07(m,8H) ,3.01-2.80(m,4H) ,2.58-2.05(m,10H) ,1.96-1.32(m,26H) ,1.21-1.14(m,6H) , 1.02-0.71(m,25H)ppm。 430 CN 111601619 A 说 明 书 278/306 页 [0490] {4-[(2S)-2-[(2S)-2-[(2R)-2-氨基-6-[2-({1-[(2R,3R,4S,5R,6R)-3,4,5-三羟 基-6-(羟基甲基)四氢吡喃-2-基]-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-4-基} 氧基)乙酰胺基]己酰胺基]-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲基 N-[(1S)-1-{[(1S)-1-{[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-2-{[(1S,2R)-1-羟基-1- 苯基丙烷-2-基]氨基甲酰基}-1-甲氧基-2-甲基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1- 氧庚烷-4-基](甲基)氨基甲酰基}-2-甲基丙基]氨基甲酰基}-2-甲基丙基]-N-甲基氨基甲 酸酯(7ae) [0491] 根据一般方法,由化合物5a(6.0mg,4.2μmol)与化合物6e(3.0mg,15μmol),得到化 合物7ae的反应溶液,并直接用于下一步骤。ESI m/z:811(M/2 H) 。 [0492] (2-{1-[4-({[(5R)-5-氨基-5-{[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-[(4- {[({2-[(1S,2S,4R,8S,9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧- 6-丙基-5,7-二氧杂五环[10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-8-基]-2-氧乙基} 氨基甲酰基)氧基]甲基}苯基)氨基甲酰基]丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰基} 戊基]氨基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-1-基]-3,6, 9,12-四氧杂十五烷-15-酰胺基}乙基)三甲基氯化铵(7bb) [0493] 根据一般方法E,由5b(40mg,34μmol)和6b,除了在50℃下搅拌过夜,并通过制备型 HPLC(方法B)纯化后,得到化合物7bb(40mg,76%收率)为白色固体。ESI m/z:770[(M 18)/ 2] 。1H NMR(400MHz ,DMSOd6)δ10.13-8.87(m ,2H) ,8.58-8.21(m ,2H) ,8.09-7 .85(m ,2H) , 7.82-7.64(m,3H) ,7.63-7.55(m,1H) ,7.49-7.37(m,1H) ,7.34-7.16(m,3H) ,6.34-6.21(m, 1H) ,6.15-5.99(m,2H) ,5.78-5.42(m,3H) ,5.01-4.83(m,3H) ,4.81-4.69(m,2H) ,4.63-4.47 (m,2H) ,4.45-4.34(m,2H) ,4.27-4.07(m,3H) ,4.04-3.96(m,1H) ,3.91-3.70(m,6H) ,3.60 (t,J=6.2Hz,2H) ,3.53-3.40(m,14H) ,3.15-3.01(m,11H) ,3.00-2.88(m,3H) ,2.83-2.73 431 CN 111601619 A 说 明 书 279/306 页 (m,1H) ,2.68-2.56(m,1H) ,2.38-2.19(m,4H) ,2.13-1.93(m,4H) ,1.87-1.74(m,2H) ,1.71- 1.64(m,2H) ,1.62-1.18(m,22H) ,1.14-1.02(m,1H) ,0.97-0.70(m,12H)ppm。 [0494] (2-{1-[4-({[(5R)-5-氨基-5-{[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-{[4- ({[(4-{2-[(1S,2S,4R,8S,9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16- 氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-8-基]-2-氧乙氧 基}苯基)氨基甲酰基]氧基}甲基)苯基]氨基甲酰基}丁基]氨基甲酰基}-2-甲基丙基]氨基 甲酰基}戊基]氨基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1 ,2,3]三唑-1- 基]-3,6,9,12-四氧杂十五烷-15-酰胺基}乙基)三甲基铵(7cb) [0495] 根据一般方法,由6b(44mg,35μmol)在室温下搅拌24小时,并通过反相快速色谱法 (0-100%乙腈的TFA水溶液(0.03%))纯化后,得到化合物7cb(44mg,收率77%)为白色固 体。ESI m/z:816.0(m/2 H) ;544.5(M/3 H) 。 [0496] 1-(4-(2-(((R)-5-氨基-6-(((S)-1-(((S)-1-(((4bS,8S,8aR)-8-(((1S,4aS, 10aR)-6-羟基-1,4a-二甲基-1,2,3,4,4a ,9,10,10a-八氢菲-1-羰基)氨基甲酰基)-4b,8- 二甲基-4b,5,6,7,8,8a,9,10-八氢菲-3-基)氨基)-1-氧丙烷-2-基)氨基)-3-甲基-1-氧丁 烷-2-基)氨基)-6-氧己基)氨基)-2-氧乙氧基)-4,5,6,7,8,9-六氢-1H-环辛并[d][1,2,3] 三唑-1-基)-N,N,N-三甲基-15-氧-3,6,9,12-四氧杂-16-氮杂十八烷-18-铵(7fb) [0497] 根据一般方法,由6b(50mg,50μmol)在室温下搅拌24小时,并通过反相快速色谱法 (0-30%乙腈的TFA水溶液(0.03%))纯化后,得到化合物7fb(50mg,73%收率)为白色固体。 ESI m/z:684(M/2 H) 。 实施例14 中间体7h、7l的制备(参见图15) [0498] 一般方法F:在室温下,向化合物4b(1.2当量)的DMF(40mL/g化合物3)溶液中依次 加入EDCI(1.5当量)、HOBt(2.0当量)、化合物3(3b或3e,1.0当量)和三乙胺(3.0当量)。将所 得混合物在室温下搅拌过夜。LCMS显示化合物4b完全耗尽(化合物3未耗尽)。向反应中加入 二乙胺(6mL/g化合物3,过量)。反应混合物在室温下搅拌2小时,直至根据LCMS监测已脱去 Fmoc。将反应混合物直接经反相快速色谱法纯化(0-100%乙腈的碳酸氢铵水溶液(10mM)), 432 CN 111601619 A 说 明 书 280/306 页 得到化合物7(7h或7l,25-26%收率)为白色固体,未反应的化合物3可回收。 2-[(4R)-4-氨基-4-{[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-[(4-{[({2-[(1S,2S, 4R,8S,9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙基-5,7-二 氧杂五环[10.8.0.02,9.04 ,8.013 ,18]二十烷-14,17-二烯-8-基]-2-氧乙基}氨基甲酰基)氧 基]甲基}苯基)氨基甲酰基]丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰基}丁酰胺基]乙烷- 1-磺酸(7h) [0499] 根据一般方法F,由3b(50mg,57μmol)与4b,并经反相快速色谱法(0-100%乙腈的 水溶液),回收得到17mg化合物3b(回收收率为34%)纯化后,得到化合物7h(17mg,26%收 率)为白色固体。ESI m/z:1107(M H) 。1H NMR(500MHz,DMSOd6)δ10.07(s,1H) ,8.31(d ,J= 7.0Hz,2H) ,7 .81(t,J=5.5Hz,1H) ,7 .61-7 .60(m ,2H) ,7 .45-7 .42(m ,1H) ,7 .30-7 .27(m , 3H) ,6.30(d ,J=10Hz,1H) ,6.11-6.03(m,2H) ,5.86-5.82(m,1H) ,5.70-5.57(m,2H) ,5.46 (s,2H) ,4.97(s,2H) ,4.78-4.76(m,1H) ,4.59(t,J=4.5Hz,1H) ,4.41-4.12(m,4H) ,3.86- 3.80(m,1H) ,3.64-3.58(m,1H) ,3.21-3.16(m,1H) ,3.01-2.90(m,6H) ,2.56(t,J=7.5Hz, 2H) ,2.35-2.32(m,2H) ,2.17-2.14(m,2H) ,2.09-1.28(m,18H) ,1.17-1.14(m,1H) ,0.97(t,J =6.5Hz,2H) ,0.89-0.84(m,10H)ppm。 2-[(4R)-4-氨基-4-{[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-[(4-{2-[(1S,2S,4R, 8S,9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙基-5,7-二氧杂 五环[10.8.0.02,9.04,8.013,18]二十烷-14,17-二烯-8-基]-2-氧乙氧基}苯基)氨基甲酰基] 丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰基}丁酰胺基]乙烷-1-磺酸(7l) [0500] 根据一般方法F,由3e(80mg,98μmol)与4b,并经反相快速色谱法(0-100%乙腈的 水溶液)纯化后,得到化合物7l(26mg,25%收率)为白色固体。ESI m/z:525.8(M/2 H) 。 中间体7ah的制备(参见图15A) [0501] {4-[(2S)-2-[(2S)-2-[(2R)-2-氨基-4-{[(2S)-2-[(4R,5R)-5-[(4R)-2,2-二甲 基-1,3-二氧杂环戊烷-4-基]-2,2-二甲基-1,3-二氧杂环戊烷-4-基]-2-羟基乙基]氨基甲 酰基}丁酰胺基]-3-甲基丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲基N-[(1S)-1- {[(1S)-1-{[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-2-{[(1S,2R)-1-羟基-1-苯基丙烷-2-基] 433 CN 111601619 A 说 明 书 281/306 页 氨基甲酰基}-1-甲氧基-2-甲基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1-氧庚烷-4-基] (甲基)氨基甲酰基}-2-甲基丙基]氨基甲酰基}-2-甲基丙基]-N-甲基氨基甲酸酯(7ah) [0502] 在室温下,向中间体4c(25mg,41μmol)的DMF(1mL)溶液中加入HATU(23mg,61μ mol)。所得溶液在室温下搅拌1小时。向此悬浮液中加入vcPAB-MMAE 3a(28mg,25μmol)的 DMF(1mL)溶液,然后加入NMM(1滴,过量)。反应混合物在室温下搅拌3小时,使其变澄清。反 应通过LCMS进行监测,直至化合物3a完全耗尽。然后向反应混合物中加入二乙胺(过量),然 后所得混合物在室温下搅拌过夜。根据LCMS监测反应完成。真空除去挥发物,所得残余物经 反相快速色谱法纯化(0-100%乙腈的TFA水溶液(0.5%)),得到化合物7ah(25mg,67%收 率)为白色固体。ESI m/z:1495(M H) 。1H NMR(MeODd4,500MHz):δ7.65-7.55(m,2H) ,7.46- 7.28(m,6H) ,7.23(t,J=7.1Hz,1H) ,5.27-5.02(m,2H) ,4.72-4.47(m,4H) ,4.30-4.05(m, 6H) ,4.03-3.78(m,4H) ,3.78-3.65(m,1H) ,3.61-3.40(m,4H) ,3.39-3.27(m,5H) ,3.26-3.16 (m,2H) ,3.17-3.08(m,3H) ,3.00-2.91(m,3H) ,2.58-2.11(m,7H) ,2.10-1.52(m,12H) ,1.50- 1.25(m,15H) ,1.24-1.11(m,6H) ,1.05-0.69(m,26H)ppm。 实施例14A [0503] 中间体8c的制备(参见图15B) [0504] 1-[2-(环辛-2-炔-1-基氧基)乙酰胺基]-3,6,9,12-四氧杂十五烷-15-羧酸(8c) [0505] 在室温下,向化合物36(0.50g,1.8mmol)和37(0.65g,1.8mmol)的DMF(3mL)混合物 中加入DIPEA(1 .2g,9.0mmol)。混合物在室温下搅拌30分钟。将反应混合物直接经制备型 HPLC(方法A)纯化,得到OCT-PEG4-酸(8c)(0.70g,91%收率)为浅黄色油状物。ESI m/z:430 (M H) 。 [0506] 使用类似于制备8c的方法,使用本领域技术人员已知的合适的起始物料来制备得 到8d和8e。 实施例15 1a的制备(参见图16) [0507] 在室温下,向DIBAC-suc-PEG4-酸8a(1.2-1.3当量)的DMF溶液(1mL/10mg 8a)中加 入HATU(1.3当量)和DIPEA(5.0当量)。混合物在室温下搅拌半小时,然后加入化合物7a(1.0 434 CN 111601619 A 说 明 书 282/306 页 当量)的DMF溶液(0.6mg/10mg 7a)。所得混合物在室温下搅拌直至化合物7耗尽,通过LCMS 进行监测。将反应混合物过滤后,滤液直接经制备型HPLC纯化,得到化合物1a。 [0508] 一般方法G(由8a、8c或8d开始):在室温下,向酸8(8a、8c或8d,1.2-1.3当量)的DMF 溶液(1mL/10mg 8)中加入HATU(1.3当量)和DIPEA(5.0当量)。混合物在室温下搅拌半小时, 然后加入化合物7(1.0当量)的DMF溶液(0.6mg/10mg 7)。所得混合物在室温下搅拌直至化 合物7耗尽,通过LCMS进行监测。将反应混合物过滤后,滤液直接经制备型HPLC纯化,得到连 接体-有效负载1和II-V。 实施例16 1a、1c、1e、1f、1h、1i、1j、1k、1l、1m、1q的制备(参见图17) [0509] 一般方法H(由8b或8e开始):在室温下,向化合物7(1 .0当量)的DMF溶液(1mL/ 50mg)中加入化合物DIBAC-PEG4-NHS 8b(1.1-1.2当量)和DIPEA(5.0当量)。反应混合物在 室温下搅拌3小时。反应混合物经制备型HPLC直接纯化,得到化合物1。 实施例17 1a的制备(参见图17) {4-[(2S)-2-[(2S)-2-[(2R)-2-[1-(4-{2-氮杂三环[10.4.0.04 ,9]十六碳-1(12) ,4 (9) ,5 ,7 ,13 ,15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3 ,6 ,9 ,12-四氧杂十五烷-15-酰胺 基]-6-(2-{[1-(17-羟基-3,6,9,12,15-五氧杂十七烷-1-基)-1H,4H,5H,6H,7H,8H,9H-环 辛并[d][1,2,3]三唑-4-基]氧基}乙酰胺基)己酰胺基]-3-甲基丁酰胺基]-5-(氨基甲酰基 氨基)戊酰胺基]苯基}甲基N-[(1S)-1-{[(1S)-1-{[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-2- {[(1S ,2R)-1-羟基-1-苯基丙烷-2-基]氨基甲酰基}-1-甲氧基-2-甲基乙基]吡咯烷-1- 基]-3-甲氧基-5-甲基-1-氧庚烷-4-基](甲基)氨基甲酰基}-2-甲基丙基]氨基甲酰基}-2- 甲基丙基]-N-甲基氨基甲酸酯(1a) [0510] 根据一般方法G,由化合物7a(25mg,15μmol)与化合物8a(10mg,18μmol),得到连接 体-有效负载1a(24mg,73%收率)为白色固体。ESI:753(M/3 H) 。1H NMR(500MHz,MeODd4)δ 7.74-7.69(m,2H) ,7.67-7.64(m,1H) ,7.63-7.59(m,1H) ,7.53-7.45(m,3H) ,7.42-7.29(m, 9H) ,7.25-7.20(m,1H) ,5.22-5.05(m,3H) ,4.70-4.49(m,4H) ,4.47-4.43(m,1H) ,4.33-4.29 (m,1H) ,4.27-4.16(m,4H) ,4.00-3.95(m,2H) ,3.92-3.87(m,2H) ,3.77-3.69(m,2H) ,3.68- 3.63(m,10H) ,3.61-3.52(m,21H) ,3.49-3.41(m,5H) ,3.38-3.36(m,4H) ,3.30-3.27(m,3H) , 3.27-3.22(m,3H) ,3.20-3.14(m,2H) ,3.12(s,1H) ,3.10-3.03(m,1H) ,2.99-2.86(m,4H) , 2.82-2.68(m,2H) ,2.56-2.12(m,10H) ,2.11-1.97(m,5H) ,1.91-1.79(m,5H) ,1.76-1.53(m, 10H) ,1.48-1.37(m,3H) ,1.34-1.26(m,1H) ,1.21-1.12(m,14H) ,1.06-0.93(m,14H) ,0.92- 0.81(m,10H)ppm。 实施例17A 435 CN 111601619 A 说 明 书 283/306 页 Ib的制备(参见图17) [0511] (2-{1-[4-({[(5R)-5-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5, 7 ,13 ,15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3 ,6 ,9 ,12-四氧杂十五烷-15-酰胺基]-5- {[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-({4-[({[(1S)-1-{[(1S)-1-{[(3R,4S,5S)-1- [(2S)-2-[(1R,2R)-2-{[(1S,2R)-1-羟基-1-苯基丙烷-2-基]氨基甲酰基}-1-甲氧基-2-甲 基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1-氧庚烷-4-基](甲基)氨基甲酰基}-2-甲基丙 基]氨基甲酰基}-2-甲基丙基](甲基)氨基甲酰基}氧基)甲基]苯基}氨基甲酰基)丁基]氨 基甲酰基}-2-甲基丙基]氨基甲酰基}戊基]氨基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H- 环辛并[d][1,2,3]三唑-1-基]-3,6,9,12-四氧杂十五烷-15-酰胺基}乙基)三甲基铵(Ib) [0512] 根据一般方法G,由化合物7ab(45mg,25μmol)与化合物8a(16mg,29μmol),得到连 接体-有效负载Ib(16mg,27%收率)为白色固体。ESI m/z:766[(M H)/3] 。1H NMR(500MHz, DMSOd6):δ9.78(s,1H) ,8.34-8.04(m,5H) ,7.95-7.83(m,2H) ,7.79-7.74(m,1H) ,7.70-7.56 (m ,5H) ,7 .52-7 .43(m ,3H) ,7 .40-7 .11(m ,12H) ,6.08(s ,1H) ,5.43(s ,2H) ,5.06-5.00(m , 2H) ,4.76-4.71(m,1H) ,4.54-4.39(m,4H) ,4.35-4.15(m,4H) ,4.03-3.92(m,2H) ,3.85-3.73 (m ,5H) ,3.64-3.55(m ,5H) ,3.46-3.43(m ,20H) ,3.25-3.16(m ,11H) ,3.13-3.05(m ,15H) , 3.00-2.93(m,5H) ,2.89-2.82(m,4H) ,2.80-2.73(m,2H) ,2.61-2.55(m,1H) ,2.42-2.32(m, 5H) ,2.31-2.20(m,4H) ,2.15-2.04(m,4H) ,2.03-1.95(m,4H) ,1.83-1.65(m,8H) ,1.57-1.38 (m,11H) ,1.30-1.19(m,10H) ,1.06-0.96(m,7H) ,0.87-0.76(m,20H)ppm。 实施例18 1c的制备(参见图17) [0513] 2-{1-[4-({[(5R)-5-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5,7, 13 ,15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3 ,6 ,9 ,12-四氧杂十五烷-15-酰胺基]-5- {[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-({4-[({[(1S)-1-{[(1S)-1-{[(3R,4S,5S)-1- [(2S)-2-[(1R,2R)-2-{[(1S,2R)-1-羟基-1-苯基丙烷-2-基]氨基甲酰基}-1-甲氧基-2-甲 基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1-氧庚烷-4-基](甲基)氨基甲酰基}-2-甲基丙 基]氨基甲酰基}-2-甲基丙基](甲基)氨基甲酰基}氧基)甲基]苯基}氨基甲酰基)丁基]氨 基甲酰基}-2-甲基丙基]氨基甲酰基}戊基]氨基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H- 环辛并[d][1,2,3]三唑-1-基]-3,6,9,12-四氧杂十五烷-15-酰胺基}乙烷-1-磺酸(1c) 436 CN 111601619 A 说 明 书 284/306 页 [0514] 根据一般方法H,由化合物7c(20mg,11μmol)与化合物8b(7.1mg,11μmol),得到1c (5.0mg,19%收率)为白色固体。ESI m/z:1174.7(M/2 H) 。1H NMR(MeODd4,500MHz):δ8.38- 8.17(m,2H) ,7.99-7.87(m,2H) ,7.77-7.56(m,4H) ,7.49-7.20(m,9H) ,5.36(t,J=4.5Hz, 1H) ,5.21-5.07(m ,4H) ,4.71-4.18(m ,9H) ,3.98-3.88(m ,5H) ,3.74-3.43(m ,37H) ,3.37- 3.36(m,6H) ,3.29-3.12(m,6H) ,3.00-2.88(m,6H) ,2.75-2.33(m,5H) ,2.32-1.78(m,17H) , 1.64-1.34(m,15H) ,1.20-1.13(m,6H) ,1.03-0.76(m,30H)ppm。 实施例18A Id的制备(图17) [0515] {4-[(2S)-2-[(2S)-2-[(2R)-2-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) , 4(9) ,5,7 ,13,15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺 基]-6-(2-{[1-(14-{[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-({4-[({[(1S)-1-{[(1S)- 1-{[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-2-{[(1S,2R)-1-羟基-1-苯基丙烷-2-基]氨基甲酰 基}-1-甲氧基-2-甲基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1-氧庚烷-4-基](甲基)氨基 甲酰基}-2-甲基丙基]氨基甲酰基}-2-甲基丙基](甲基)氨基甲酰基}氧基)甲基]苯基}氨 基甲酰基)丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰基}-3,6,9,12-四氧杂十四烷-1-基)- 1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-4-基]氧基}乙酰胺基)己酰胺基]-3-甲基 丁酰胺基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲基 N-[(1S)-1-{[(1S)-1-{[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-2-{[(1S,2R)-1-羟基-1- 苯基丙烷-2-基]氨基甲酰基}-1-甲氧基-2-甲基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1- 氧庚烷-4-基](甲基)氨基甲酰基}-2-甲基丙基]氨基甲酰基}-2-甲基丙基]-N-甲基氨基甲 酸酯(Id) [0516] 根据一般方法G,由化合物7ad(12mg,6.7μmol)与化合物8a(4.4mg,8.0μmol),得到 连接体-有效负载Id(3 .0mg,19%收率)为白色固体。ESI m/z:774 .7(M/3 H) 。1H NMR (MeODd4,500MHz):δ8.00-7.90(m,1H) ,7.94-7.61(m,4H) ,7.49-7.47(m,3H) ,7.41-7.14(m, 9H) ,5.37-5.03(m ,5H) ,4.70-4.44(m ,6H) ,4.34-3.90(m ,7H) ,3.77-3.42(m ,38H) ,3.37- 3.35(m,4H) ,3.29(s,3H) ,3.27-3.01(m,9H) ,2.97-2.87(m,6H) ,2.75-2.59(m,2H) ,2.53- 2.16(m,9H) ,2.06-1.81(m,12H) ,1.64-1.32(m,19H) ,1.20-1.13(m,6H) ,1.03-0.79(m,21H) 437 CN 111601619 A 说 明 书 285/306 页 ppm。分析型HPLC:95%,保留时间:5.56和6.64min(方法B)。 实施例18B Ie-1的制备(图17) [0517] {4-[(2S)-2-[(2S)-2-[(2R)-2-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) , 4(9) ,5,7 ,13,15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺 基]-6-[2-({1-[(2R,3R,4S,5R,6R)-3,4,5-三羟基-6-(羟基甲基)四氢吡喃-2-基]-1H,4H, 5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-4-基}氧基)乙酰胺基]己酰胺基]-3-甲基丁酰胺 基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲基 N-[(1S)-1-{[(1S)-1-{[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-2-{[(1S,2R)-1-羟基-1- 苯基丙烷-2-基]氨基甲酰基}-1-甲氧基-2-甲基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1- 氧庚烷-4-基](甲基)氨基甲酰基}-2-甲基丙基]氨基甲酰基}-2-甲基丙基]-N-甲基氨基甲 酸酯(Ie-1)(含三唑异构体) [0518] 根据一般方法H,由7ae(反应溶液)和8b,并通过制备型HPLC(方法B)纯化后,得到 含三唑异构体的化合物Ie-1(通过HPLC测定的比率为3/2)(13mg,由5a开始的收率为30%) 为白色固体。ESI m/z:1078(M/2 H) (100%) ,2156 .9(M H) (10%)。1H NMR(DMSOd6 , 500MHz):δ9.69(m,1H) ,8.08-8.30(m,4H) ,7.84-7.89(m,1H) ,7.61-7.75(m,6H) ,7.45-7.49 (m,2H) ,7.16-7.37(m,10H) ,5.96(m,1H) ,5.34-5.51(m,4H) ,4.97-5.16(m,5H) ,4.62-4.75 (m ,4H) ,3.92-4.49(m ,9H) ,3.77-3.80(m ,3H) ,3.40-3.72(m ,18H) ,3.24(s ,3H) ,3.23(s , 2H) ,3.18-3.20(m ,4H) ,2.88-3.17(m ,17H) ,2.54-2.83(m ,2H) ,2.35-2.42(m ,2H) ,2.22- 2.29(m,3H) ,1.96-2.15(m,7H) ,1.72-1.82(m,5H) ,1.28-1.65(m,16H) ,0.87-1.05(m,6H) , 0.75-0.87(m,27H)。分析型HPLC:异构体1:60.3%,保留时间:7.34min;异构体2:39.7%,保 留时间:7.41min(方法B)。 实施例18C If-1的制备(图17) [0519] {4-[(2S)-5-(氨基甲酰基氨基)-2-[(2S)-2-[(2R)-2-[1-(2,5-二氧-2,5-二氢- 1H-吡咯-1-基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-6-[2-({1-[(2R,3R,4S,5R,6R)-3, 4,5-三羟基-6-(羟基甲基)四氢吡喃-2-基]-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三 唑-4-基}氧基)乙酰胺基]己酰胺基]-3-甲基丁酰胺基]戊酰胺基]苯基}甲基N-[(1S)-1- {[(1S)-1-{[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-2-{[(1S,2R)-1-羟基-1-苯基丙烷-2-基] 氨基甲酰基}-1-甲氧基-2-甲基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1-氧庚烷-4-基] (甲基)氨基甲酰基}-2-甲基丙基]氨基甲酰基}-2-甲基丙基]-N-甲基氨基甲酸酯(If-1) 438 CN 111601619 A 说 明 书 286/306 页 [0520] 根据一般方法H,由7ae(反应溶液)和8e,并通过制备型HPLC(方法A)纯化后,得到 含三唑异构体的化合物If-1(通过HPLC测定的比率为3/2)(1.5mg,由5a开始的收率为18%) 为白色固体。ESI m/z:974 .7(M/2 H) (100%) ,1972(M Na) (20%)。1H NMR(DMSOd6 , 500MHz):δ9.69(s,1H) ,8.19-7.97(m,4H) ,7.92-7.83(m,1H) ,7.66-7.54(m,3H) ,7.36-7.23 (m,6H) ,7.22-7.12(m,2H) ,7.01(s,2H) ,6.87(s,2H) ,6.68-6.59(m,2H) ,6.03-5.93(m,1H) , 5.47-5.26(m,5H) ,5.20-5.11(m,1H) ,5.07-4.95(m,2H) ,4.80-4.58(m,3H) ,4.53-4.38(m, 2H) ,4.36-4.12(m ,5H) ,4.04-3.94(m ,2H) ,3.84-3.76(m ,3H) ,3.68-3.37(m ,21H) ,3.26- 3.17(m,7H) ,3.13-2.96(m,7H) ,2.90-2.81(m,3H) ,2.44-2.34(m,2H) ,2.31-2.21(m,2H) , 2.18(s,3H) ,2.15-1.94(m,9H) ,1.77-1.74(m,2H) ,1.69-1.59(m,4H) ,1.56-1.42(m,9H) , 1 .32-1 .27(m ,2H) ,1 .06-0 .96(m ,6H) ,0 .90-0 .72(m ,26H)ppm。分析型HPLC:异构体1: 76.0%,保留时间:7.19min;异构体2:24.0%,保留时间:7.28min(方法A)。 实施例18D Ig的制备(图18) [0521] {4-[(2S)-2-[(2S)-2-[(2R)-2-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) , 4(9) ,5,7 ,13,15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺 基]-4-{[(2S,3R,4R,5R)-2,3,4,5,6-五羟基己基]氨基甲酰基}丁酰胺基]-3-甲基丁酰胺 基]-5-(氨基甲酰基氨基)戊酰胺基]苯基}甲基N-[(1S)-1-{[(1S)-1-{[(3R ,4S,5S)-1- [(2S)-2-[(1R,2R)-2-{[(1S,2R)-1-羟基-1-苯基丙烷-2-基]氨基甲酰基}-1-甲氧基-2-甲 基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1-氧庚烷-4-基](甲基)氨基甲酰基}-2-甲基丙 基]氨基甲酰基}-2-甲基丙基]-N-甲基氨基甲酸酯(Ig) [0522] 在0℃下,向中间体7ah(40mg,27μmol)的DCM(3mL)混合物中滴加TFA(0.25mL)。混 合物在室温下搅拌1小时直至7ah耗尽。根据LCMS监测完成脱保护。真空除去挥发物,将所得 残余物(ESI m/z:708(M/2 H) )溶于DMF(2mL)。向溶液中加入中间体8b(17mg,27μmol)和三 乙胺(8.2mg,81μmol)。混合物在室温下搅拌过夜。反应混合物经制备型HPLC(方法B)直接纯 化,得到Ig(8.0mg,从7ah开始的两步收率为15%)为白色固体。ESI m/z:650 .8(M/3 H) 439 CN 111601619 A 说 明 书 287/306 页 (100%) ,975(M/2 H) (40%)。1H NMR(DMSOd6,500MHz):δ9.75(s,1H) ,8.31-8.06(m,5H) , 7.91-7.88(m,1H) ,7.75-7.74(m,2H) ,7.68-7.61(m,5H) ,7.50-7.46(m,3H) ,7.39-7.24(m, 11H) ,7.17-7.15(m,1H) ,5.99(s,1H) ,5.41-5.34(m,3H) ,5.04-5.01(m,2H) ,4.77-4.75(m, 1H) ,4.48-4.18(m,11H) ,4.05-3.95(m,3H) ,3.62-3.55(m,7H) ,3.47-3.17(m,14H) ,3.12- 2.97(m,10H) ,2.88-2.83(m,3H) ,2.60-2.54(m,1H) ,2.53-2.51(m,2H) ,2.42-2.36(m,2H) , 2.29-2.21(m,3H) ,2.17-1.99(m,8H) ,1.79-1.71(m,7H) ,1.54-1.44(m,3H) ,1.36-1.28(m, 2H) ,1.05-0.97(m,8H) ,0.88-0.75(m,28H)ppm。分析型HPLC:96.9%,保留时间:7.58min(方 法B)。 实施例18E Ih-1的制备(图18) [0523] {4-[(2S)-5-(氨基甲酰基氨基)-2-[(2S)-2-[(2R)-2-[1-(2,5-二氧-2,5-二氢- 1H-吡咯-1-基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-4-{[(2R,3S,4S,5S)-2,3,4,5,6-五 羟基己基]氨基甲酰基}丁酰胺基]-3-甲基丁酰胺基]戊酰胺基]苯基}甲基N-[(1S)-1- {[(1S)-1-{[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-2-{[(1S,2R)-1-羟基-1-苯基丙烷-2-基] 氨基甲酰基}-1-甲氧基-2-甲基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1-氧庚烷-4-基] (甲基)氨基甲酰基}-2-甲基丙基]氨基甲酰基}-2-甲基丙基]-N-甲基氨基甲酸酯(Ih-1) [0524] 向中间体7ah(10mg,6.7μmol)的DMF(1mL)溶液中加入中间体8e(5.9mg,13μmol)和 DIPEA(1.7mg,13μmol)。混合物在室温下搅拌24小时,直至根据LCMS监测10a大部分耗尽。将 反应混合物通过膜过滤,所得过滤物经制备型HPLC(方法A)纯化(ESI m/z:912(M/2 H) )。 将冻干后的残余物溶于乙腈(2mL),并向溶液中加入脱水氯化铜(II)(19mg,0.12mmol)。混 合物在室温下搅拌两天。通过LCMS检测到所需的Ih质量为主要产物。过滤除去无机盐后,所 得溶液直接经制备型HPLC(方法A)纯化,得到Ih-1(2.0mg,从7ah开始的两步收率为17%)为 白色固体。ESI m/z:1742.7(M H) ,1764.8(M Na) 。1H NMR(DMSOd6,500MHz):δ9.75(s,1H) , 8.42-7.84(m,5H) ,7.79-7.70(m,1H) ,7.68-7.52(m,3H) ,7.44-7.11(m,8H) ,7.02(s,2H) , 6.04-5.93(m,1H) ,5.45-5.31(m,3H) ,5.15-4.57(m,5H) ,4.53-3.91(m,14H) ,3.84-3.74(m, 1H) ,3.63-3.53(m,8H) ,3.52-3.09(m,9H) ,3.04-2.92(m,4H) ,2.90-2.82(m,3H) ,2.42-2.36 (m,2H) ,2.32-2.21(m,2H) ,2.19-1.92(m,8H) ,1.90-1.15(m,23H) ,1.06-0.97(m,6H) ,0.90- 0.71(m,26H)ppm。分析型HPLC:99.4%,保留时间:6.09min(方法A)。 实施例19 1e的制备(参见图17) 2-{1-[4-({[(5R)-5-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5,7,13, 15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-5-{[(1S)- 440 CN 111601619 A 说 明 书 288/306 页 1-{[(1S)-4-(氨基甲酰基氨基)-1-[(4-{[({2-[(1S,2S,4R,8S,9S,11S,12R,13S,19S)-12, 19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04,8.013,18] 二十烷-14,17-二烯-8-基]-2-氧乙基}氨基甲酰基)氧基]甲基}苯基)氨基甲酰基]丁基]氨 基甲酰基}-2-甲基丙基]氨基甲酰基}戊基]氨基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H- 环辛并[d][1,2,3]三唑-1-基]-3,6,9,12-四氧杂十五烷-15-酰胺基}乙烷-1-磺酸(1e) [0525] 根据一般方法H,由化合物7e(47mg,30μmol)和8b,得到化合物1e(28mg,45%收率) 为白色固体。ESI m/z:1049(M/2 H) 。1H NMR(500MHz,MeODd4)δ7.75-7 .57(m ,4H) ,7.48- 7.43(m,3H) ,7.38-7.23(m,6H) ,6.37-6.28(m,2H) ,5.65-5.43(m,1H) ,5.17-5.03(m,3H) , 4.69-4.59(m,2H) ,4.52-4.47(m,1H) ,4.45-4.41(m,1H) ,4.34-4.25(m,2H) ,4.23-4.13(m, 2H) ,4.07-3.86(m ,5H) ,3.77-3.68(m ,4H) ,3.64-3.54(m ,22H) ,3.52-3.47(s ,3H) ,3.46- 3.40(m,4H) ,3.29-3.21(m,4H) ,3.20-3.14(m,2H) ,3.10-3.01(m,1H) ,3.00-2.95(m,2H) , 2.92-2.84(m,1H) ,2.76-2.60(m,2H) ,2.47-2.42(m,2H) ,2.40-2.25(m,5H) ,2.23-2.13(m, 3H) ,2.07-1 .97(m ,3H) ,1 .90-1 .79(m ,4H) ,1 .71-1 .55(m ,14H) ,1 .52-1 .42(m ,3H) ,1 .40- 1.29(m,8H) ,1.07-0.85(m,12H)ppm。分析型HPLC:98%,保留时间:5.88min(方法B)。 实施例19A IIb的制备(图17) [0526] (2-{1-[4-({[(5R)-5-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5, 7 ,13 ,15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3 ,6 ,9 ,12-四氧杂十五烷-15-酰胺基]-5- {[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-[(4-{[({2-[(1S,2S,4R,8S,9S,11S,12R,13S, 19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04 ,8.013 ,18]二十烷-14 ,17-二烯-8-基]-2-氧乙基}氨基甲酰基)氧基]甲基}苯基)氨基甲酰 基]丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰基}戊基]氨基甲酰基}甲氧基)-1H ,4H ,5H , 6H,7H,8H,9H-环辛并[d][1,2,3]三唑-1-基]-3,6,9,12-四氧杂十五烷-15-酰胺基}乙基) 三甲基氯化铵(IIb) 441 CN 111601619 A 说 明 书 289/306 页 [0527] 根据一般方法G,由化合物7bb(35mg,23μmol)和8a,并经反相快速色谱法(0-100% 乙腈的碳酸氢铵水溶液(10mM),然后100%甲醇)纯化后,得到化合物IIb(25mg,52%收率) 为白色固体。ESI m/z:1037[(M 18)/2] 。1H NMR(400MHz,DMSOd6)δ9.82-9.74(m,1H) ,8.30 (s,1H) ,8.21-8.08(m,2H) ,7.92-7.82(m,1H) ,7.76(t,J=5.5Hz,1H) ,7.69-7.58(m,3H) , 7.53-7.18(m,9H) ,6.34-6.26(m,1H) ,6.15-6.03(m,2H) ,5.71-5.53(m,1H) ,5.43(s,2H) , 5.31(t,J=12.4,7.8Hz,1H) ,5.10-4.90(m,3H) ,4.79-4.72(m,1H) ,4.58(t,J=4.2Hz,1H) , 4.52(t,1H) ,4.44-4.28(m,3H) ,4.25-4.11(m,3H) ,3.88-3.74(m,4H) ,3.64-3.55(m,3H) , 3.49-3.42(m,20H) ,3.13-3.02(m,12H) ,3.00-2.91(m,3H) ,2.81-2.73(m,1H) ,2.61-2.54 (m,1H) ,2.41-2.32(m,3H) ,2.29-2.19(m,3H) ,2.12-1.93(m,7H) ,1.83-1.73(m,3H) ,1.70- 1.62(m,3H) ,1.60-1.31(m,20H) ,1.31-1.19(m,17H) ,1.15-1.04(m,3H) ,0.89-0.79(m,12H) ppm。 实施例20 1f的制备(参见图17) 2-[2-({2-[4-({[(5R)-5-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5,7, 13 ,15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3 ,6 ,9 ,12-四氧杂十五烷-15-酰胺基]-5- {[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-[(4-{[({2-[(1S,2S,4R,8S,9S,11S,12R,13S, 19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04 ,8.013 ,18]二十烷-14 ,17-二烯-8-基]-2-氧乙基}氨基甲酰基)氧基]甲基}苯基)氨基甲酰 基]丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰基}戊基]氨基甲酰基}甲氧基)-1H ,4H ,5H , 6H,7H,8H,9H-环辛并[d][1 ,2,3]三唑-1-基]乙基}({[(2-磺乙基)氨基甲酰基]甲基})氨 基)乙酰胺基]乙烷-1-磺酸(1f) [0528] 根据一般方法H,由化合物7f(60mg,38μmol)和8b,得到化合物1f(25mg,31%收率) 为白色固体。ESI m/z:1058(M/2 H) 。1H NMR(500MHz ,DMSOd6)δ9.62-9.58(m ,1H) ,8.25- 8.00(m,6H) ,7.90-7.80(m,1H) ,7.77(t,J=5.5Hz,1H) ,7.70-7.60(m,4H) ,7.55-7.25(m, 12H) ,6.30(d ,J=10.5Hz,1H) ,6.10(s,1H) ,6.05-5.95(m,1H) ,5.70-5.55(m,2H) ,5.40(s, 2H) ,5.10-4.90(m,4H) ,4.80-4.70(m,1H) ,4.59(t,J=4.0Hz,1H) ,4.50-4.35(m,2H) ,4.35- 4.25(m,2H) ,4.25-4.10(m,3H) ,3.90-3.75(m,3H) ,3.65-3.50(m,5H) ,3.50-3.40(m,16H) , 3.20-3.05(m,12H) ,3.00-2.80(m,6H) ,2.65-2.55(m,6H) ,2.40-2.35(m,1H) ,2.30-2.20(m, 5H) ,2.10-1.95(m,5H) ,1.85-1.70(m,4H) ,1.65-1.30(m,18H) ,0.90-0.80(m,12H)ppm。分析 型HPLC:97%,保留时间:6.82min(方法B)。 实施例21 442 CN 111601619 A 说 明 书 290/306 页 1h的制备(参见图17) [0529] 2-[(4R)-4-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5,7,13,15-六 烯-10-炔-2-基}-4-氧丁酰胺基)-3 ,6 ,9 ,12-四氧杂十五烷-15-酰胺基]-4-{[(1S)-1- {[(1S)-4-(氨基甲酰基氨基)-1-[(4-{[({2-[(1S,2S,4R ,8S,9S,11S,12R ,13S,19S)-12, 19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04,8.013,18] 二十烷-14,17-二烯-8-基]-2-氧乙基}氨基甲酰基)氧基]甲基}苯基)氨基甲酰基]丁基]氨 基甲酰基}-2-甲基丙基]氨基甲酰基}丁酰胺基]乙烷-1-磺酸(1h) [0530] 根据一般方法H,由化合物7h(20mg,18μmol)和8b,并经反相快速色谱法(0-100% 乙腈的碳酸氢铵水溶液(10mM))纯化后,得到化合物1h(11mg,37%收率)为白色固体。ESI m/z:821.3(M/2 H) 。1H NMR(500MHz,DMSOd6)δ9.70(s,1H) ,8.22(d,J=7.0Hz,1H) ,8.10(d, J=7.0Hz,2H) ,7.95-7.61(m,7H) ,7.51-7.26(m,11H) ,6.30(d ,J=10Hz,1H) ,6.11(s,1H) , 6.01-5.99(m,1H) ,5.69-5.57(m,2H) ,5.41(s,2H) ,5.22-4.92(m,4H) ,4.78-4.58(m,1H) , 4.35-4.13(m,5H) ,3.86-3.80(m,1H) ,3.62-3.40(m,14H) ,3.30-3.28(m,4H) ,3.10-2.73(m, 5H) ,2.63-2.53(m,2H) ,2.41-2.20(m,3H) ,2.09-1.57(m,13H) ,1.48-1.12(m,15H) ,0.90- 0.84(m,10H)ppm。分析型HPLC:96%,保留时间:7.28min(方法B)。 实施例22 1i的制备(参见图17) 2-(1-{4-[({5-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5,7,13,15-六 烯-10-炔-2-基}-4-氧丁酰胺基)-3 ,6 ,9 ,12-四氧杂十五烷-15-酰胺基]-5-{[(1S)-1- {[(1S)-4-(氨基甲酰基氨基)-1-{[4-({[(4-{2-[(1S,2S,4R ,8S,9S,11S,12R ,13S,19S)- 12,19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04,8.013 ,18]二十烷-14,17-二烯-8-基]-2-氧乙氧基}苯基)氨基甲酰基]氧基}甲基)苯基]氨基甲酰 基}丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰基}戊基}氨基甲酰基)甲氧基]-1H ,4H ,5H , 6H,7H,8H,9H-环辛并[d][1,2,3]三唑-1-基}-3,6,9,12-四氧杂十五烷-15-酰胺基)乙烷- 1-磺酸(1i) 443 CN 111601619 A 说 明 书 291/306 页 [0531] 根据一般方法H,由化合物7i(46mg,28μmol)和8b,得到化合物1i(28mg,46%收率) 为白色固体。ESI m/z:1095.0(M/2 H) 。1H NMR(400MHz,MeODd4)δ7.42-7.23(m,15H) ,6.87- 6.83(m,2H) ,6.36-6.31(m,2H) ,5.64-5.47(m,1H) ,5.29-5.05(m,5H) ,4.94-4.90(m,1H) , 4.84-4.59(m,2H) ,4.49-4.41(m,2H) ,4.34-4.26(m,2H) ,4.16-4.13(m,1H) ,4.02-3.86(m, 4H) ,3.72-3.68(m ,3H) ,3.66-3.34(m ,31H) ,3.24-3.14(m ,5H) ,3.08-2.83(m ,4H) ,2.73- 2.60(m,2H) ,2.46-2.36(m,9H) ,2.12-1.19(m,32H) ,1.05-0.90(m,12H)ppm。分析型HPLC: 100%,保留时间:7.62min(方法B)。 实施例23 1j的制备(参见图17) [0532] 2-{1-[4-({[(5R)-5-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5,7, 13 ,15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3 ,6 ,9 ,12-四氧杂十五烷-15-酰胺基]-5- {[(1S)-1-{[(1S)-1-[(4-{2-[(1S,2S,4R,8S,9S,11S,12R ,13S,19S)-12,19-二氟-11-羟 基-9,13-二甲基-16-氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04,8.013,18]二十烷-14,17- 二烯-8-基]-2-氧乙氧基}苯基)氨基甲酰基]乙基]氨基甲酰基}-2-甲基丙基]氨基甲酰基} 戊基]氨基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-1-基]-3,6, 9,12-四氧杂十五烷-15-酰胺基}乙烷-1-磺酸(1j) [0533] 根据一般方法H,由化合物7j(66mg,47μmol)和8b,得到化合物1j(40mg,44%收率) 为白色固体。ESI m/z:977.5(M/2 H) 。1H NMR(400MHz,MeODd4)δ7.66-7.55(m ,4H) ,7.48- 7.24(m,7H) ,6.90-6.85(m,2H) ,6.35(d ,J=10.0Hz,1H) ,6.32(s,1H) ,5.64-5.47(m,1H) , 5.28-5.07(m,3H) ,4.85-4.60(m,3H) ,4.50-4.44(m,2H) ,4.34-4.25(m,2H) ,4.12-3.88(m, 5H) ,3.73-3.49(m ,29H) ,3.45-3.39(m ,3H) ,3.25-3.20(m ,3H) ,3.14-2.86(m ,5H) ,2.74- 2 .63(m ,2H) ,2 .46-1 .27(m ,41H) ,1 .05-0 .92(m ,12H)ppm。分析型HPLC:95%,保留时间: 7.55min(方法B)。 实施例24 1k的制备(参见图17) 2-{1-[4-({[(5R)-5-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5,7,13, 15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-5-{[(1S)- 1-{[(1S)-4-(氨基甲酰基氨基)-1-[(4-{2-[(1S,2S,4R,8S,9S,11S,12R,13S,19S)-12,19- 二氟-11-羟基-9,13-二甲基-16-氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04,8.013,18]二十 烷-14,17-二烯-8-基]-2-氧乙氧基}苯基)氨基甲酰基]丁基]氨基甲酰基}-2-甲基丙基]氨 基甲酰基}戊基]氨基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-1- 444 CN 111601619 A 说 明 书 292/306 页 基]-3,6,9,12-四氧杂十五烷-15-酰胺基}乙烷-1-磺酸(1k) [0534] 根据一般方法H,由化合物7k(50mg,33μmol)和8b,得到化合物1k(30mg,44%收率) 为白色固体。ESI m/z:680(M/3 H) 。1H NMR(500MHz,DMSOd6)δ9.51(s ,1H) ,8.30-7.97(m , 3H) ,7.92-7.84(m,1H) ,7.80-7.73(m,2H) ,7.68(d ,J=7.5Hz,1H) ,7.62(d ,J=7.9Hz,1H) , 7 .50-7 .45(m ,4H) ,7 .38-7 .26(m ,4H) ,7 .08(br s ,3H) ,6 .90-6 .78(m ,2H) ,6 .30(d ,J= 10.5Hz,1H) ,6.11(s,1H) ,6.01-5.94(m,1H) ,5.72-5.55(m,1H) ,5.52(s,1H) ,5.39(s,2H) , 5.12(d ,J=18.5Hz,1H) ,5.03(d ,J=14.5Hz,1H) ,4.84(d ,J=18.5Hz,1H) ,4.80-4.71(m, 2H) ,4.55-4.49(m,1H) ,4.42(t,J=5.5Hz,1H) ,4.38-4.12(m,4H) ,3.81-3.76(m,4H) ,3.62- 3.53(m,4H) ,3.46-3.39(m,21H) ,3.33-3.25(m,4H) ,3.09-2.93(m,7H) ,2.81-2.78(m,1H) , 2.64-2.52(m,8H) ,2.40-2.36(m,2H) ,2.27-2.20(m,5H) ,2.09-1.98(m,5H) ,1.61-1.35(m, 29H) ,0.89-0.83(m,11H)ppm。 实施例24A IIId的制备(图17) [0535] (2-{1-[4-({[(5R)-5-{[(1S)-1-{[(1S)-4-(氨基甲酰基氨基)-1-{[4-({[(4-{2- [(1S,2S,4R ,8S,9S,11S,12R ,13S,19S)-12,19-二氟-11-羟基-9,13-二甲基-16-氧-6-丙 基-5,7-二氧杂五环[10.8.0.02,9.04 ,8.013 ,18]二十烷-14,17-二烯-8-基]-2-氧乙氧基}苯 基)氨基甲酰基]氧基}甲基)苯基]氨基甲酰基}丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰 基}-5-{1-[2-(环辛-2-炔-1-基氧基)乙酰胺基]-3,6,9,12-四氧杂十五烷-15-酰胺基}戊 基]氨基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-1-基]-3,6,9, 12-四氧杂十五烷-15-酰胺基}乙基)三甲基铵(IIId) [0536] 根据一般方法G,由化合物7cb(20mg,12μmol)和8c(5.2mg,12μmol),并经反相快速 色谱法(0-100%乙腈的TFA(0.01%)水溶液)纯化后,得到化合物IIId(8mg,32%收率)为黄 445 CN 111601619 A 说 明 书 293/306 页 色固体。ESI m/z:681.7(M/3 H) ;1021.7(M/2 H) 。1H NMR(400MHz,DMSOd6)δ9.73-9.67(m, 1H) ,9.61-9.54(m,1H) ,8.26-8.20(m,1H) ,8.19-8.04(m,2H) ,7.91-7.77(m,1H) ,7.66-7.57 (m ,3H) ,7 .40-7 .26(m ,4H) ,6.84-6.78(m ,2H) ,6.30(d ,J=10Hz,1H) ,6.12(s ,1H) ,6.01- 5.99(m,1H) ,5.72-5.42(m,4H) ,5.24-5.06(m,3H) ,4.91-4.73(m,3H) ,4.55-4.16(m,7H) , 3.89-3.73(m,5H) ,3.58(t,J=10.4Hz,3H) ,3.49-3.41(m,29H) ,3.26-3.22(m,4H) ,3.08(s, 9H) ,3.04-2.93(m,4H) ,2.77-2.62(m,3H) ,2.40-1.98(m,13H) ,1.89-1.02(m,41H) ,0.89- 0.84(m,9H)ppm。 实施例24B IIIe的制备(图17) [0537] (2-{1-[4-({[(5R)-5-[1-({[(1R,8S,9S)-二环[6.1.0]壬-4-炔-9-基甲氧基]羰 基}氨基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-5-{[(1S)-1-{[(1S)-4-(氨基甲酰基氨 基)-1-{[4-({[(4-{2-[(1S,2S,4R,8S,9S,11S,12R,13S,19S)-12,19-二氟-11-羟基-9,13- 二甲基-16-氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04 ,8.013 ,18]二十烷-14,17-二烯-8- 基]-2-氧乙氧基}苯基)氨基甲酰基]氧基}甲基)苯基]氨基甲酰基}丁基]氨基甲酰基}-2- 甲基丙基]氨基甲酰基}戊基]氨基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1, 2,3]三唑-1-基]-3,6,9,12-四氧杂十五烷-15-酰胺基}乙基)三甲基铵(IIIe) [0538] 根据一般方法G,由化合物7cb(25mg,15μmol)和8d(6.8mg,15μmol),并经反相快速 色谱法(0-100%乙腈的TFA(0.01%)水溶液)纯化后,得到化合物IIIe(4mg,13%收率)为黄 色固体。ESI m/z:685.6(M/3 H) 。1H NMR(400MHz,MeODd4)δ7.77-7.71(m ,2H) ,7.40-7.34 (m,5H) ,6.90-6.86(m,2H) ,6.38-6.33(m,2H) ,5.66-5.47(m,1H) ,5.38-5.24(m,1H) ,5.14- 5.02(m,2H) ,4.76-4.58(m,4H) ,4.52-4.27(m,6H) ,4.19-4.11(m,3H) ,3.99-3.86(m,4H) , 3.75-3.42(m,37H) ,3.30-3.27(m,3H) ,3.17(s,9H) ,3.16-3.00(m,2H) ,3.0-2.84(m,1H) , 2.72-2.46(m,4H) ,2.38-2.04(m,15H) ,1.83-1.31(m,27H) ,1.06-0.90(m,13H)ppm。 实施例25 1l的制备(参见图17) 2-[(4R)-4-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5,7,13,15-六烯- 10-炔-2-基}-4-氧丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-4-{[(1S)-1-{[(1S)- 4-(氨基甲酰基氨基)-1-[(4-{2-[(1S,2S,4R,8S,9S,11S,12R,13S,19S)-12,19-二氟-11- 羟基-9,13-二甲基-16-氧-6-丙基-5,7-二氧杂五环[10.8.0.02,9.04 ,8.013 ,18]二十烷-14, 17-二烯-8-基]-2-氧乙氧基}苯基)氨基甲酰基]丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰 446 CN 111601619 A 说 明 书 294/306 页 基}丁酰胺基]乙烷-1-磺酸(1l) [0539] 根据一般方法H,由化合物7l(20mg,19μmol)和8b,得到化合物1l(6.0mg,20%收 率)为白色固体。ESI m/z:793(M/2 H) 。1H NMR(400MHz,DMSOd6)δ9.81-9.48(m,1H) ,8.32- 8.18(m,1H) ,8.12-7.96(m,2H) ,7.81-7.60(m,4H) ,7.58-7.43(m,5H) ,7.41-7.25(m,5H) , 7.18-6.98(m,2H) ,6.88-6.81(m,2H) ,6.30(d ,J=10.3Hz,1H) ,6.11(s,1H) ,6.02-5.95(m, 1H) ,5.71-5.52(m,2H) ,5.40(s,2H) ,5.15-5.00(m,2H) ,4.86-4.74(m,2H) ,4.34-4.13(m, 4H) ,3.63-3.54(m,2H) ,3.48-3.42(m,9H) ,3.30-3.28(m,2H) ,3.12-3.05(m,2H) ,3.01-2.92 (m,2H) ,2.62-2.56(m,1H) ,2.42-2.37(m,1H) ,2.29-2.20(m,3H) ,2.12-1.95(m,7H) ,1.86- 1.70(m,5H) ,1.64-1.56(m,4H) ,1.52-1.22(m,14H) ,0.92-0.81(m,14H)ppm。 实施例26 1m的制备(参见图17) 2-{1-[4-({[(5R)-5-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5,7,13, 15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-5-{[(1S)- 1-{[(1S)-1-{[(4bS,8S,8aR)-8-({[(1S,4aS,10aR)-6-羟基-1,4a-二甲基-1,2,3,4,4a,9, 10,10a-八氢菲-1-基]甲酰胺基}羰基)-4b,8-二甲基-4b,5,6,7,8,8a,9,10-八氢菲-3-基] 氨基甲酰基}乙基]氨基甲酰基}-2-甲基丙基]氨基甲酰基}戊基]氨基甲酰基}甲氧基)-1H, 4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-1-基]-3,6,9,12-四氧杂十五烷-15-酰胺基} 乙烷-1-磺酸(1m) [0540] 根据一般方法H,由化合物7m(30mg,22μmol)和8b,得到化合物1m(15mg,37%收率) 为白色固体。ESI m/z:642(M/3 H) 。1H NMR(400MHz,DMSOd6)δ9.68-9.27(m ,1H) ,8.99(s , 1H) ,8.23-7.85(m,4H) ,7.79-7.71(m,2H) ,7.76-7.42(m,6H) ,7.39-7.28(m,3H) ,7.21(s, 1H) ,7.09(s,1H) ,6.96-6.93(m,2H) ,6.81(d ,J=8.4Hz,1H) ,6.63(d ,J=2.4Hz,1H) ,6.50 (dd ,J=8.4Hz,2.4Hz,1H) ,5.02(d ,J=14.0Hz,1H) ,4.93-4.72(m,1H) ,4.53-4.09(m,5H) , 3.82-3.75(m,4H) ,3.62-3.53(m,3H) ,3.51-3.38(m,23H) ,3.30-3.27(m,6H) ,3.12-2.67(m, 10H) ,2.61-2.54(m,4H) ,2.39-1.52(m,31H) ,1.45-1.08(m,18H) ,1.01-0.98(m,6H) ,0.90- 0.82(m,6H)ppm。 实施例26A IVb的制备(图17) 447 CN 111601619 A 说 明 书 295/306 页 [0541] (2-{1-[4-({[(5R)-5-{[(1S)-1-{[(1S)-1-{[(4bS ,8S ,8aR)-8-({[(1S ,4aS , 10aR)-6-羟基-1,4a-二甲基-1,2,3,4,4a,9,10,10a-八氢菲-1-基]甲酰胺基}羰基)-4b,8- 二甲基-4b,5,6,7,8,8a,9,10-八氢菲-3-基]氨基甲酰基}乙基]氨基甲酰基}-2-甲基丙基] 氨基甲酰基}-5-{1-[2-(环辛-2-炔-1-基氧基)乙酰胺基]-3,6,9,12-四氧杂十五烷-15-酰 胺基}戊基]氨基甲酰基}甲氧基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1,2,3]三唑-1-基]- 3,6,9,12-四氧杂十五烷-15-酰胺基}乙基)三甲基铵(IVb) [0542] 根据一般方法G,由化合物7fb(20mg,15μmol)和8c,并经制备型HPLC(方法A)纯化 后,得到化合物IVb(6mg,23%收率)为黄色固体。ESIm/z:889.8(M/2 H) ,593.5(M/3 H) 。1H NMR(500MHz,DMSOd6)δ9.30(d ,J=8.5Hz,1H) ,9.02(s ,1H) ,8.76(d ,J=5.5Hz,1H) ,8.54- 8.48(m,1H) ,8.32-7.76(m,6H) ,7.62-7.60(m,2H) ,7.53-7.51(m,2H) ,7.44(d ,J=8.0Hz, 1H) ,6.95(d ,J=8.5Hz,1H) ,6.81(d ,J=8.5Hz,1H) ,6.63(s,1H) ,6.50(d ,J=8.0Hz,1H) , 5.33-4.71(m,2H) ,4.55-4.05(m,7H) ,3.88-3.74(m,6H) ,3.61-3.58(m,4H) ,3.50-3.42(m, 44H) ,3.26-3.24(m,4H) ,3.08(s,9H) ,2.84-2.65(m,3H) ,2.44(t,J=6.5Hz,2H) ,2.35-1.26 (m,35H) ,1.16-1.13(m,2H) ,1.02-0.98(m,6H) ,0.89-0.84(m,6H)ppm。 实施例27 1q的制备(参见图17) 2-{1-[4-({[(5R)-5-[1-(4-{2-氮杂三环[10.4.0.04,9]十六碳-1(12) ,4(9) ,5,7,13, 15-六烯-10-炔-2-基}-4-氧丁酰胺基)-3,6,9,12-四氧杂十五烷-15-酰胺基]-5-{[(1S)- 1-{[(1S)-1-({4-[({[(1S)-1-{[(4bS,8S,8aR)-8-({[(1S,4aS,10aR)-6-羟基-1,4a-二甲 基-1,2,3,4,4a,9,10,10a-八氢菲-1-基]甲酰胺基}羰基)-4b,8-二甲基-4b,5,6,7,8,8a , 9 ,10-八氢菲-3-基]氨基甲酰基}-2-羟基乙基]氨基甲酰基}氧基)甲基]苯基}氨基甲酰 基)-4-(氨基甲酰基氨基)丁基]氨基甲酰基}-2-甲基丙基]氨基甲酰基}戊基]氨基甲酰基} 甲氧基)-1H,4H,5H,6H,7H,8H,9H-环辛并[d][1 ,2,3]三唑-1-基]-3,6,9,12-四氧杂十五 烷-15-酰胺基}乙烷-1-磺酸(1q) 448 CN 111601619 A 说 明 书 296/306 页 [0543] 向化合物7q(15mg,8 .8μmol)和商购DIBAC-Suc-PEG4-OSu(5 .7mg,8 .8μmol, CAS1427004-19-0)的DMF(1mL)溶液中加入DIPEA(2.3mg,18μmol),混合物在室温下搅拌2小 时。真空除去大部分挥发物,所得残余物经制备型HPLC(方法B)纯化,得到1q(6.0mg,30%收 率)为白色固体。ESI m/z:1123.8(M/2 H) ,749.5(M/3 H) 。1H NMR(500MHz,MeODd4)δ7.76- 7.16(m,14H) ,7.06-7.00(m,1H) ,6.88(d ,J=8.5Hz,1H) ,6.72-6.71(m,1H) ,6.56-6.55(m, 1H) ,5.39-5.33(m,1H) ,5.14-5.09(m,5H) ,4.61(s,18H) ,4.50-4.43(m,2H) ,4.33-4.30(m, 1H) ,3.99(s ,2H) ,3.89-3.85(m ,3H) ,3.73-3.42(m ,28H) ,3.25-2.72(m ,8H) ,2.45(t,J= 7.5Hz,2H) ,2.36-1.96(m,18H) ,1.81-1.51(m,12H) ,1.45-1.32(m,15H) ,1.12-0.89(m,12H) ppm。 [0544] 表2B和表2B-1总结了连接体-有效负载的结果:HPLC纯度和HPLC上的LC保留时间, 来自质谱的M/Z。分析型HPLC和MS方法描述于一般方法中。 表2B.连接体-有效负载的化学物理性质 449 CN 111601619 A 说 明 书 297/306 页 1.可能存在COT-异构体。 表2B-1.连接体-有效负载的化学物理性质 450 CN 111601619 A 说 明 书 298/306 页 1.可能存在两个区域异构体。 实施例28 [0545] 本实施例示出了在体外脂多糖(LPS)介导的IL-1β释放测定试验中,包含SO3H基团 部分的抗MSR1抗体类固醇非细胞毒性ADC的活性。 [0546] 对于所述测定试验,将THP-1细胞以40,000个细胞/孔接种到96孔板的培养基(所 述培养基含有RPMI,补充有10%FBS和青霉素/链霉素)中,并用200nM佛波醇(Phorbol)肉豆 451 CN 111601619 A 说 明 书 299/306 页 蔻酸酯乙酸酯(PMA)分化3天。经过3天的分化之后,将抗体药物偶联物以及未偶联抗体新鲜 培养基的三倍连续稀释液以100nM至0.01nM的终浓度加至细胞中。板中的最后一个孔用作 仅包含培养基的空白对照。72小时后,将细胞用5μg/mL的LPS(InVivoGen,目录号tlrl- e k l ps)处理5小时。然后收集细胞培养基,并按照制造商的说明书使用V - P L E X Proinflammatory Panel 1人用试剂盒(Meso Scale Diagnostics,目录号15049D-2)来测 定IL-1β。随后在MSD读板仪(Meso Scale Discovery)上读取所述板。IC50值是通过10点响应 曲线上的四参数逻辑斯蒂方程(GraphPadPrism)进行确定。所有IC50值均以摩尔(M)浓度表 示。 [0547] 如表1A所示,与不含SO3H基团部分的类固醇连接体有效负载偶联的H1H21234N- N297Q(H1H21234N-N297Q-实施例10A)表现出对LPS介导的THP1细胞IL-1β释放的抑制,IC50 值为1.73nM,且释放的IL-1β降低至97.2pg/mL。与含SO3H基团部分的类固醇连接体有效负 载偶联的H1H21234N-N297Q(H1H21234N-N297Q-实施例19)表现出对LPS介导的THP1细胞IL- 1β释放的抑制,IC50值为1.97nM,且释放的IL-1β降低至97.17pg/mL。未偶联的抗体表现出对 LPS介导的THP1细胞IL-1β释放的抑制,IC50值为22.9nM,释放的IL-1β降低至343.7pg/mL,表 明与偶联的抗体相比缺乏功效。 表1A:抗MSR1 Ab-类固醇ncADC对LPS诱导的THP1细胞IL-1β释放的活性 pH稳定性 [0548] pH稳定性如下进行评估。将0.1mg的样品溶于0.2-0.3mL DMSO,然后将所得溶液逐 滴加至不同的pH缓冲液(1mL)中,同时在测试期间保持澄清溶液。从几个时间点(例如,72小 时内)收集样本,并通过LC-MS来测定pH稳定性。pH缓冲液制备如下:pH 8.0的硼酸钠缓冲 液:向900mL蒸馏水中加入9.534g十水合硼酸钠、1.461g氯化钠和0.393gDTPA,确保所有粉 状物完全溶解,然后通过加水使最终体积达到1L。pH 7.4的硼酸钠缓冲液:向900mL蒸馏水 中加入900ml Milli-Q水(超纯水)、9.534g十水合硼酸钠、1.461g氯化钠和0.393gDTPA,确 保所有粉状物完全溶解,然后通过加水使最终体积达到1L。pH 5 .0的琥珀酸缓冲液:向 150mL蒸馏水中加入10mM琥珀酸,然后通过添加0.5M NaOH调节pH值为pH 5.0,然后通过加 水使最终体积达到250mL。pH 7 .4的PBS缓冲液:市售得到。通过LCMS在72小时时评估稳定 性。 溶解性 [0549] 溶解度测试的方法:将1mg测试样品溶于1mL DMSO,并制备标准溶液A(4.5mL,100μ g/mL)、B(4.5mL,10μg/mL)、C(4.5mL,1μg/mL)、D(5mL,0.1μg/mL)。 标准溶液 样品量(mg) DMSO(%) 总体积(mL) 浓度(mg/mL) 452 CN 111601619 A 说 明 书 300/306 页 DMSO 1 100% 1 1 A 0.5 10% 5 0.1 B 0.05 1% 5 0.01 C 0.005 0.10% 5 0.001 D 0.0005 0.01% 5 0.0001 将DMSO溶液(1mg/mL,0.5mL)用水(4.5mL)稀释以生成溶液A(0.1mg/mL,5mL,0.5mg)。将 溶液A(0.1mg/mL,0.5mL)用水(4.5mL)稀释以生成溶液B(0.01mg/mL,5mL,0.05mg)。将溶液B (0.01mg/mL,0.5mL)用水(4.5mL)稀释以生成溶液C(1μg/mL,5mL,5μg)。将溶液C(1μg/mL, 0.5mL)用水(4.5mL)稀释以生成溶液D(0.1μg/mL,5mL,0.5μg)。将测试样品(0.05mg)悬浮于 水(1mL)中,并超声处理5-30分钟以使样品溶解。如果未观察到澄清溶液,则将所得悬浮液 离心并收集澄清的上清液用于分析。所有标准溶液A、B、C、D和试样溶液均使用同一方法在 同一台LC-MS仪器上进行测试。通过LCMS来评估溶解度并基于标准曲线进行计算。表3和表 3-1示出了来自这些实验的数据。 表3.连接体-有效负载的pH稳定性、溶解度数据 Y:在室温下于pH 7.4或8的缓冲液中可稳定3天以上; 表3-1.连接体-有效负载的pH稳定性、溶解度数据 453 CN 111601619 A 说 明 书 301/306 页 Y:在室温下于pH 7.4或8的缓冲液中可稳定3天以上。 实施例29 ADC偶联物(参见图19) [0550] 本实施例说明了将有效负载与抗体或其抗原结合片段进行位点特异性偶联的一 般方法。 [0551] 以下实施例说明了制备偶联物的方法。将具有人IgG1同种型的无糖基化抗体的 BupHTM溶液(pH7.6-7.8)与≥200摩尔当量的叠氮基-dPEG3-胺(MW.218.26g/mol)混合。将所 得溶液与转谷氨酰胺酶(25U/mL;5UMTG/mg抗体)混合,使抗体的终浓度为0.5–10mg/mL,然 后将溶液在37℃下孵育4-24小时,同时轻轻振荡。通过SDS-PAGE或ESI-MS监测反应。反应完 成后,通过体积排除色谱法(SEC)除去过量的胺和MTG,以生成叠氮基官能化的抗体(mAb- N3)。此产物在SDS-PAGE和ESI-MS上进行分析。将叠氮基-dPEG3-胺添加至抗体的两个位点- Q295和Q297-,使得所述4DAR无糖基化的抗体-PEG3-叠氮化物偶联物增加804Da。通过胰蛋 白酶消化的重链的肽序列作图,在EEQLinkerYQLinkerSTYR(EEQ连接体YQ连接体STYR)处鉴定和确证所 454 CN 111601619 A 说 明 书 302/306 页 述4DAR叠氮基官能化抗体的偶联位点。 [0552] 通过叠氮基官能化抗体(mAb-N3)与含有连接体-有效负载(LP)的炔之间的[2 3] 点击反应制备得到具有针对MSR1、HER2(或PRLR)的人IgG1或IgG4且含有N297Q突变的位点 特异性无糖基化抗体药物偶联物(ADC)。FeID1是非结合性对照抗体。 [0553] 如表5所示,将含有N297Q突变的位点特异性无糖基化抗体与胺-PEG3-N3偶联,生成 叠氮基官能化抗体偶联物(mAb-N3),包括抗MSR1 Ab–PEG3–N3、抗FelD1 Ab–PEG3–N3、抗HER2 Ab–PEG3–N3、抗PRLRAb–PEG3–N3。 [0554] 通过将mAb–PEG3–N3(1-12mg/mL)在溶于适当有机溶剂(如DMSO、DMF或DMA)(即,反 应混合物包含5-20%的有机溶剂,v/v)中的≥6摩尔当量LP的水性介质(例如PBS,含5%甘 油的PBS,HBS)中,在24℃至37℃下孵育30分钟至24小时,来制备具有连接体-有效负载(LP) 的位点特异性抗体偶联物。通过ESI-MS监测反应进程,若不存在mAb–PEG3–N3,表明偶联完 成。通过SEC用PBS进行洗脱,或通过蛋白A柱色谱用酸性缓冲液进行洗脱,然后用Tris(pH 8.0)中和,来除去过量的LP和有机溶剂。所述经纯化的偶联物通过SEC、SDS-PAGE和ESI-MS 进行分析。表5中列出了来自相应LP的MMAE抗体偶联物、类固醇抗体偶联物和LXR激动剂抗 体偶联物,它们的分子量和ESI-DAR值。 [0555] 在具体实施例中,在室温下,用6摩尔当量的来自表2的连接体有效负载(LP)(浓度 为10mg/mL的DMSO溶液)处理0.800mLPBSg(PBS,5%甘油,pH 7.4)中的叠氮基官能化抗体 (1mg)2小时,然后通过体积排除色谱法(SEC,Superdex200 HR,GE Healthcare)除去过量的 连接体有效负载(LP)。通过超速离心法浓缩最终产物,并通过UV、SEC、SDS-PAGE和ESI-MS进 行表征。 通过LC–ESI–MS对ADC进行表征 [0556] 通过LC-ESI-MS对ADC样品的完整质量进行测定,以确定药物-有效负载分布曲线 并计算平均DAR。将各个测试样品(20-50ng,5uL)上样至AcquityUPLC ProteinBEH C4色谱 柱(10Kpsi, 1.7μm,75μm×100mm;目录号186003810)。脱盐3分钟后,洗脱蛋白质,并通 过Waters SynaptG2-Si质谱仪得到质谱。表5列出了裸抗体、叠氮基官能化抗体偶联物 (mAb-N3)、LP和ADC的分子量(MW)。如表5所示,大多数位点特异性ADC的位点特异性偶联物 均具有3.9-4DAR。 表5.偶联物列表 455 CN 111601619 A 说 明 书 303/306 页 实施例30 [0557] 本实施例说明了使用组织蛋白酶B切割测定试验来评估当连接体上存在SO3H基团 部分、N Me3基团部分、膦酸基团部分、或半乳糖基团部分时,对类固醇有效负载或LXR激动剂 有效负载的切割效率的影响。 [0558] 对于所述测定试验,将连接体-有效负载储备溶液(10mM连接体-有效负载的DMSO 溶液)加至pH值为5的100mM NaOAc、10mM二硫苏糖醇溶液中,以得到50μM底物溶液。将pH值 为5的50mM NaOAc、1mM EDTA中的人肝组织蛋白酶B(Athens Research&Technology,目录号 16-12-030102)加至底物溶液中。将所述组织蛋白酶B和底物溶液与和不与10mM组织蛋白酶 B抑制剂(CA074;APE Bio,目录号A1926)混合,并在37℃下孵育4小时。孵育4小时后,加入乙 456 CN 111601619 A 说 明 书 304/306 页 酸,然后加入乙腈以终止反应。然后将淬灭的样品以14,000rpm进行离心。然后将等份的上 清液用等体积的水稀释,并通过LC/MS进行分析以确定释放的有效负载的量。组织蛋白酶B 的稳定性和活性通过与组织蛋白酶B的200μM荧光底物(Santa Cruz Biotechnology,目录 号207975)(激发波长为340nm/发射波长为425nm的荧光)一同孵育来确证。 [0559] 如表1B所示,不含SO3H基团部分的LXR激动剂连接体有效负载当用组织蛋白酶B处 理4小时时,释放了13.6%的游离有效负载,而含有SO3H基团部分的LXR激动剂连接体有效 负载当用组织蛋白酶B处理4小时时,释放了44.2%的游离有效负载。不含SO3H基团部分的 类固醇连接体有效负载当用组织蛋白酶B处理4小时时,释放了7.5%-17.2%的游离有效负 载,而含有SO3H基团部分的类固醇连接体有效负载当用组织蛋白酶B处理4小时时,释放了 79.6%的游离有效负载。表1C和表1D示出了使用组织蛋白酶B处理连接体有效负载时释放 游离有效负载的其他数据。 表1B:组织蛋白酶B测定试验中含有SO3H基团部分和不含SO3H基团部分的连接体-有效 负载释放的有效负载的量(参见图18) 表1C:组织蛋白酶B测定试验中含有不同SO3H连接体的连接体-有效负载释放的有效负 载的量(参见图18) 表1D:组织蛋白酶B测定试验中由连接体-有效负载(图19)释放的有效负载百分比(%) 457 CN 111601619 A 说 明 书 305/306 页 实施例31 [0560] 本实验通过测定随时间变化的溶酶体切割,来说明当抗MSR1抗体类固醇非细胞毒 性ADC(ncADC)中存在亲水性连接体时,对类固醇有效负载的切割效率的影响。 [0561] 对于所述测定试验,将ncADC加至新鲜制备的溶酶体工作溶液中,所述工作溶液含 有1倍量分解代谢缓冲液(Xenotech,目录号K5200)和0 .125mg/mL人肝溶酶体蛋白 (Xenotech,目录号H0610.L)。将含有0.25μM ncADC的200μL所得混合物于37℃下孵育24小 时,同时轻轻振荡。分别在0、0.5、1.0、2.0、4.0、8.0和24小时时取20μL等分试样,然后转移 至含有80μL冷乙腈的平板中以使溶酶体失活并使蛋白质沉淀。在2,000rpm下离心5分钟后, 将上清液的等分试样用等体积的水稀释,然后通过LC-MS进行分析以确定有效负载的释放 量。 [0562] 如表1E所示,不含亲水性连接体的ncADC类固醇偶联物(H1H21234N-N297Q-实施例 10A)在24小时时间点释放了548nM类固醇。而含有亲水性连接体的ncADC类固醇偶联物 (H1H21234N-N297Q-实施例19)在24小时时间点释放了760nM类固醇。 表1E:含有亲水性连接体和不含亲水性连接体的类固醇释放量 458 CN 111601619 A 说 明 书 306/306 页 [0563] 上述实施方案和实施例旨在仅是说明性的而非限制性的。本领域技术人员将认识 到或能够仅使用常规实验便可以确定具体化合物、材料/物料和程序/方法的许多等同物。 所有此类等同物均认为包含在本发明范围内,并被所附权利要求所涵盖。 459 CN 111601619 A 说 明 书 附 图 1/30 页 图1 460 CN 111601619 A 说 明 书 附 图 2/30 页 图2 461 CN 111601619 A 说 明 书 附 图 3/30 页 图2(续) 462 CN 111601619 A 说 明 书 附 图 4/30 页 图2(续1) 463 CN 111601619 A 说 明 书 附 图 5/30 页 图3 464 CN 111601619 A 说 明 书 附 图 6/30 页 图4 465 CN 111601619 A 说 明 书 附 图 7/30 页 图5 466 CN 111601619 A 说 明 书 附 图 8/30 页 图6 467 CN 111601619 A 说 明 书 附 图 9/30 页 图7 图8 图9 图10 468 CN 111601619 A 说 明 书 附 图 10/30 页 图11 图11A 469 CN 111601619 A 说 明 书 附 图 11/30 页 图11B 470 CN 111601619 A 说 明 书 附 图 12/30 页 图11C 图12 471 CN 111601619 A 说 明 书 附 图 13/30 页 图13 图13A 图13B 472 CN 111601619 A 说 明 书 附 图 14/30 页 图14 473 CN 111601619 A 说 明 书 附 图 15/30 页 图14(续) 474 CN 111601619 A 说 明 书 附 图 16/30 页 图14(续1) 475 CN 111601619 A 说 明 书 附 图 17/30 页 图15 图15A 476 CN 111601619 A 说 明 书 附 图 18/30 页 图15B 图16 477 CN 111601619 A 说 明 书 附 图 19/30 页 图17 478 CN 111601619 A 说 明 书 附 图 20/30 页 图17(续1) 479 CN 111601619 A 说 明 书 附 图 21/30 页 图17(续2) 480 CN 111601619 A 说 明 书 附 图 22/30 页 图17(续3) 481 CN 111601619 A 说 明 书 附 图 23/30 页 图17(续4) 482 CN 111601619 A 说 明 书 附 图 24/30 页 图18 483 CN 111601619 A 说 明 书 附 图 25/30 页 图18A 484 CN 111601619 A 说 明 书 附 图 26/30 页 图18B 485 CN 111601619 A 说 明 书 附 图 27/30 页 图18B(续) 486 CN 111601619 A 说 明 书 附 图 28/30 页 图19 487 CN 111601619 A 说 明 书 附 图 29/30 页 图20 488 CN 111601619 A 说 明 书 附 图 30/30 页 图20(续) 489












