技术摘要:
用于确定对象的至少一个样品中的至少一种免疫细胞类型的功能状态的方法包含基于对象的至少一个样品中至少一种免疫细胞类型中的至少一个信号传导途径的活性来确定所述至少一种免疫细胞类型的功能状态;以及任选地提供所述对象的至少一个样品中所述至少一种免疫细胞类型 全部
背景技术:
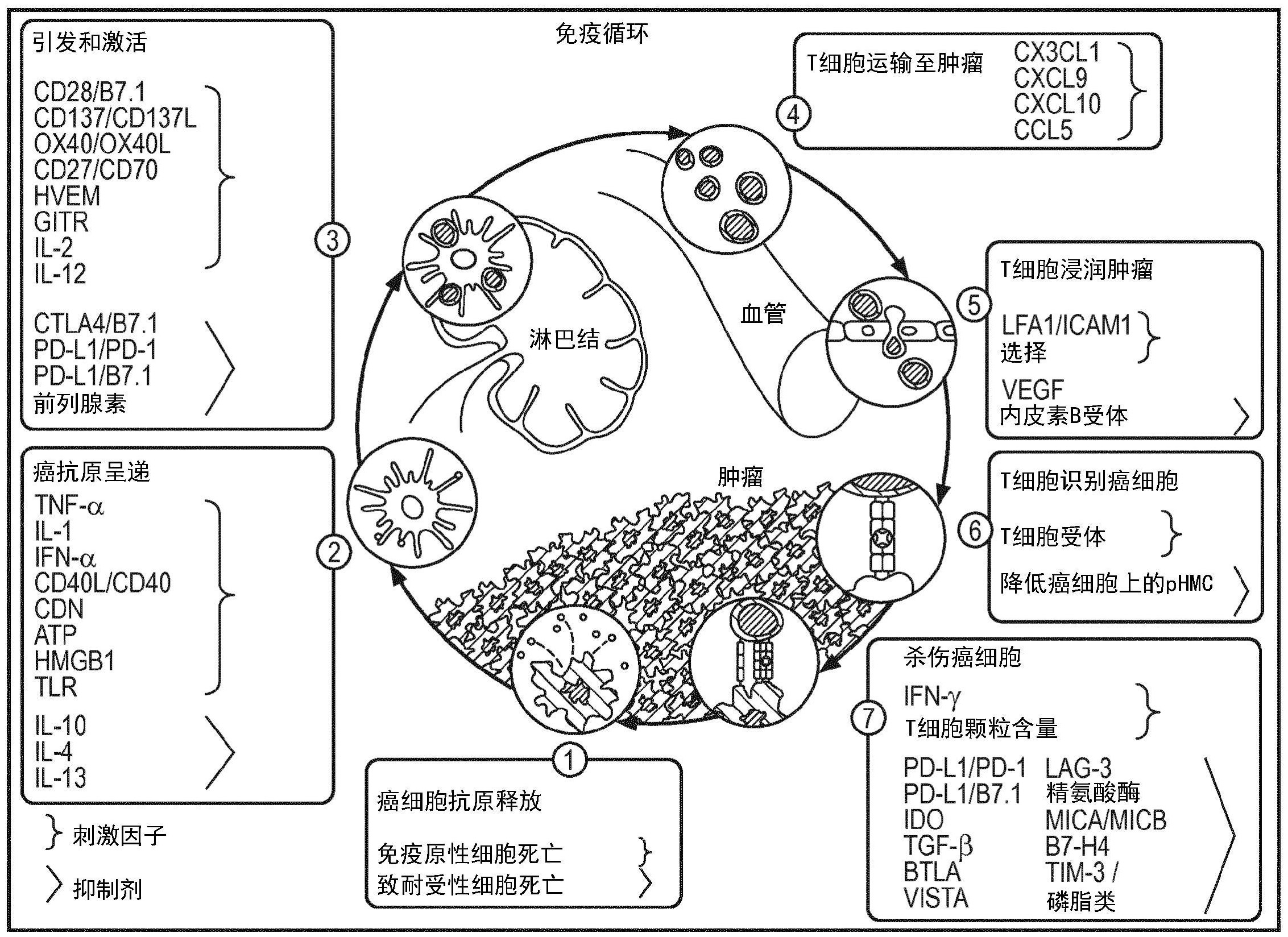
根据本发明的第一方面,通过一种用于确定对象的至少一个样品中至少一种免疫 细胞类型的功能状态的方法来解决上述问题,其中该方法包含:基于对象的至少一个样品 中至少一种免疫细胞类型中的至少一个信号传导途径的活性,确定所述至少一种免疫细胞 类型的功能状态。在一个实施方案中,该方法还包含提供所述至少一种免疫细胞类型的功 能状态,例如作为其他方法、特别是根据本发明第二方面、第三方面和第四方面的方法的输 入变量或输入值。 在另一个实施方案中,该方法还包含提供所述至少一种免疫细胞类型的功能状 态,用于本文公开的各种用途,诸如诊断等的目的。 在优选的实施方案中,所述至少一种免疫细胞类型的功能状态基于对象的至少一 个样品中所述至少一种免疫细胞类型中信号传导途径的活性谱。信号传导途径的活性谱可 以包括1、2、3、4、5、6、7或8个或甚至更多个不同的信号传导途径。 每种免疫细胞类型,如CD4 Th1和Th2细胞、CD8 T细胞、T-Reg细胞、B细胞、嗜中性 粒细胞、单核细胞、巨噬细胞和树突细胞,在免疫应答中具有特定功能,原则上它们可以通 过这些功能被表征和识别。对于每种免疫细胞类型,存在无活性(本文也称为“静息”)状态 和激活状态(本文也称为“支持型”状态),其中活性针对根除免疫靶标如癌抗原或病原体。 对于一些类型的免疫细胞(树突细胞、Treg细胞),还存在“抑制”状态,其中免疫细胞抑制其 他免疫细胞的功能。免疫细胞使用细胞-细胞相互作用并通过可溶性分子如细胞因子和趋 化因子彼此通讯以协调它们的活性。AR、ER、HH、JAK-STAT1/2(包含JAK-STAT1/2I型IFN(其 由干扰素I型细胞因子活化)和JAK-STAT1/2II型IFN(其由干扰素II型细胞因子活化)、JAK- STAT3、MAPK-AP-1、NFkB、Notch、PI3K、TGF-β和Wnt是介导细胞之间这种通讯并确定细胞中 作为通讯结果的功能活性的信号转导途径。这些信号传导途径在不同免疫细胞类型的功能 中也起重要作用。 本发明基于以下发现:信号转导途径活性的分析可用于表征免疫细胞的类型以及 在免疫应答中起作用的各种免疫细胞类型的功能状态。作为各种类型的免疫细胞之间通讯 的结果,所产生的免疫应答可以针对活性,例如抗肿瘤活性,或针对对抗抗原的免疫抑制或 耐受,如通常在体内针对自身抗原的情况,但也可以是当免疫系统不攻击癌细胞时在癌症 7 CN 111587293 A 说 明 书 4/36 页 中的情况。在后一种情况下,作为示例,一些干扰足够的抗肿瘤免疫细胞活性的膜蛋白是 CD8 淋巴细胞上的PD1和癌细胞上的PD-L1。根据功能已经描述了免疫细胞中的一些(有限 的)信号传导途径活性:PDI信号传导可以导致FOXO转录因子活性增加和PI3K途径活性降低 (这些是反向相关的),以及TGF-β途径活性增加;PD-L1信号传导(肿瘤和免疫细胞)可以活 化NFkB和MAPK-AP-1途径;有效的T细胞受体信号传导诱导PI3K途径活性;IL2通过活化JAK- STAT1/2途径激活树突细胞抗原递呈。这些途径活性在确定各种免疫细胞的功能状态中如 何彼此相关尚未知。 本发明首次提供了一种能够解释免疫细胞途径活性和确定免疫细胞功能状态的 方法。本发明人发现,可通过测量以免疫细胞类型特异性方式控制不同免疫细胞类型中免 疫细胞功能的一种或多种信号途径的活性来评估个体免疫细胞类型的功能状态(例如静息 型、支持型、抑制型、未致敏、记忆)。因此,本发明人推断了在具有已知功能状态的不同免疫 细胞类型中的不同信号途径(AR、ER、HH、JAK-STAT1/2、JAK-STAT3、MAPK-AP-1、NFkB、Notch、 PI3K、TGF-β和Wnt途径)的活性并且开发用于解释每个免疫细胞类型的所测得的途径活性 的计算模型以能够基于途径活性预测具有未知功能状态的免疫细胞类型的功能状态。除非 特别提及这些变体中的一种,JAK-STAT1/2途径用于指示其变体(JAK-STAT1/2干扰素I型 (IFN I型)和JAK-STAT1/2干扰素II型(IFN II型)中的一种或两种。 因此,一种或多种信号传导途径的活性可以用作表征免疫细胞(例如树突细胞)的 功能状态的生物标志物,其将对患有癌症或其中需要激活免疫应答的其他疾病的患者、以 及患有例如类风湿性关节炎或其中需要减弱免疫应答的其他疾病的患者的治疗选择有用。 如本文所用,术语“对象”是指任何生物。在一些实施方案中,对象是动物,优选哺 乳动物。在某些实施方案中,对象是人,优选医学对象,特别是患有癌症的对象。在其他实施 方案中,对象是细胞系、培养的细胞或组织。 术语“途径”、“信号转导途径”和“信号传导途径”在本文中可互换使用。所述至少 一种信号传导途径可以控制所述至少一种免疫细胞类型的免疫细胞功能。 术语“至少一个信号传导途径的活性”可指样品中信号传导途径相关转录因子 (TF)元件的活性,该TF元件控制靶基因的转录,驱动靶基因表达,即靶基因转录的速率,例 如,就高活性(即高速率)或低活性(即低速率)或与此类活性相关的相应评分、值或参数而 言。转录因子活性是相关途径活性的示值读数。途径活性可以通过例如活性水平来表示。这 种活性水平优选是代表该途径活性的数值。 术语“功能状态(functional status)”在本文中可与术语“功能状态(functional state)”、“功能活性状态”或“活性状态”互换使用,并且可描述免疫细胞的免疫功能的状 态,例如活性,例如免疫功能是活性的还是非活性的。该术语还可以指指示功能状态的分 数。“功能性”在本文中是指免疫细胞类型和/或免疫应答的活性状态。术语“指示功能状态 的分数”在本文中可与术语活性分数和免疫细胞活性分数互换使用。 根据本发明使用的样品通常可以是提取的样品,即已经从对象提取的样品。样品 的示例包括但不限于组织、细胞、血液和/或体液,例如支气管抽吸物、骨髓抽吸物或从对象 体腔抽取的样品。 根据本发明的第一方面、第二方面、第三方面和第四方面的优选实施方案及其各 种实施方案,所述至少一个样品可以源于存在所述至少一种免疫细胞类型的对象的位置。 8 CN 111587293 A 说 明 书 5/36 页 特别地,所述样品是含有免疫细胞类型的组织、淋巴结(例如引流淋巴结)和/或血液样品。 也可以从支气管抽吸物、骨髓抽吸物或体腔分离包含在样品中的细胞。因此,所述样品还可 以是含有免疫细胞类型的支气管抽吸物、骨髓抽吸物和/或体腔样品。在一些实施方案中, 评估来自所有组织、淋巴结和血液的免疫细胞。已经使用所谓的“免疫周期”总结和解释了 抗癌的功能性免疫应答(图8;参见Chen D .S .和Mellman I .,“Oncology meets immunology:The cancer-immunity cycle”,Immunity,第39卷,第1期,2013年7月,1-10 页)。简言之,所述周期显示对于有效的抗癌免疫应答,肿瘤组织中癌抗原被树突细胞摄取、 携带至引流淋巴结并呈递给活化的CD4 和CD8 T细胞;CD4 T细胞被活化成TH1细胞,其共同 活化CD8 细胞,CD8 细胞经过血液到达癌症组织,在此其攻击癌细胞。NK细胞在肿瘤中通过 不存在正常的HLA-I复合物而被活化。在癌组织中,癌细胞不能呈递合适抗原,它们可抑制 树突细胞和T细胞的活性,导致缺乏抗肿瘤活性。 例如,在患有癌症的患者中,组织样品可以取自肿瘤组织、淋巴结和/或外周血, 和/或取自如上进一步描述的另一位置,并且可以使用适当的识别抗体(例如针对血液样 品、针对髓样DC的抗CD11c 和抗CD141 以及针对浆细胞样DC的抗CD303 )从样品中分离免 疫细胞诸如抗原呈递细胞如树突细胞。基于树突细胞的结果和所提供的功能状态或指示功 能状态的分数,可以确定患者可能受益于免疫治疗的形式。在另一个示例中,应答的预测基 于单一样品类型分析。 在另一个示例中,患者正在接受一种形式的免疫治疗或免疫调节治疗,并且可以 在不同时间点采集一个或多个血液样品以分离免疫细胞类型(亚群),例如树突细胞,并且 确定活性状态以评估治疗的功效。通过从三个位置(或一个或两个位置)测量免疫细胞类型 中的途径活性(或优选地途径活性谱,即1、2、3、4、5、6、7或8或更多个途径的每个活性)并评 估活性或在信号传导途径活性方面,可以表征树突细胞类型或树突免疫细胞类型的混合物 的免疫抑制状态、功能活性状态,例如静息状态对比(例如抗肿瘤)活性状态对比免疫抑制 (例如肿瘤耐受或致耐受性)状态。 在另一个示例中,患者未患癌症,但患有另一种疾病,例如自身免疫性疾病,例如 类风湿性关节炎或SLE。在这种情况下,可以从疾病组织,例如类风湿性关节炎情况下的滑 膜组织,和/或来自血液的细胞样品获取组织样品,从中分离例如树突细胞,以及为预测或 监测对治疗的应答而确定活性状态(参见Khan S .、Greenberg J .D .、Bhardwaj N ., “Dendritic cells as targets for therapy in rheumatoid arthritis”,Nature Reviews Rheumatology,Vol.5,No.10,2009年10月,566-571页)。 如本文所用,术语“样品”还涵盖例如对象的组织和/或引流淋巴结和/或血液已经 从对象取得并且例如已经放置在显微镜载玻片上的情况,以及为了执行所要求保护的方 法,例如通过激光捕获显微解剖(LCMTM)或通过从载玻片上刮下感兴趣的细胞或通过荧光 活化的细胞分选技术提取该样品的一部分的情况。 通过测量免疫细胞类型例如树突细胞类型中的途径活性优选途径活性谱并评估 活性或免疫抑制型状态、功能活性状态或表征免疫细胞类型例如树突细胞类型或树突免疫 细胞类型的混合物的功能活性状态的评分,例如静息状态对比(例如抗肿瘤)激活状态和任 选对比免疫抑制(例如肿瘤耐受或致耐受性)状态。这可用于评估免疫应答,特别是免疫细 胞类型诸如其中的树突细胞在治疗开始前对抗肿瘤的作用,测量治疗期间的治疗应答、调 9 CN 111587293 A 说 明 书 6/36 页 节/优化治疗的剂量、监测任何疾病期间的免疫应答状态、预测免疫调节治疗的副作用,或 测量对免疫调节药物的顺应性,和/或监测免疫介导的疾病。该治疗可以是免疫治疗,也可 以是另一种治疗(例如化疗、靶向疗法、放疗等),其通过杀死肿瘤细胞从肿瘤细胞释放对免 疫应答有影响的抗原。 根据本发明的第一方面、第二方面、第三方面和第四方面的优选实施方案及其各 种实施方案,所述至少一种免疫细胞类型选自:(i)先天性免疫细胞,特别是自然杀伤(NK) 细胞、多形核白细胞(PMN),特别是中性粒细胞、巨噬细胞、单核细胞、树突细胞,包括髓样树 突细胞、浆细胞样树突细胞和经典树突细胞、外周和血液单个核细胞(PBMC),和(ii)适应性 免疫细胞,特别是B淋巴细胞、T淋巴细胞及其亚型,特别是CD4 T细胞、CD4 Th1细胞、CD4 Th2细胞、CD4 T调节(T-reg)细胞、CD4 T记忆细胞、CD8 T细胞和CD8 T记忆细胞。 根据本发明的第一方面、第二方面、第三方面和第四方面的优选实施方案及其各 种实施方案,通过本发明的方法确定的所述至少一种免疫细胞类型的功能状态选自静息型 状态、支持型状态、抑制型状态、记忆状态和未致敏状态。 如上所述,每种免疫细胞类型可以以非活性,即“静息”状态和激活即“支持型”状 态存在,其中活性针对根除免疫靶标如癌抗原或病原体。对于一些类型的免疫细胞(例如树 突细胞、Treg细胞),还存在“抑制型”状态,其中该免疫细胞在功能上抑制其他免疫细胞。 如本文所用,当所有免疫细胞类型未被活化或处于抑制型状态时,“静息型”是所 有免疫细胞类型的默认状态。“免疫支持型”通常描述细胞的活性针对根除免疫靶标的状 态,而术语“免疫抑制型”表示细胞的活性针对抑制一种或多种其他免疫细胞的功能的状 态。 如本文所用,“未致敏”是指细胞尚未遭遇特异性抗原,而如本文所用的“记忆”是 指细胞已遭遇特异抗原但处于“睡眠”状态以在暴露于抗原后立即变得有活性。 根据本发明的第一方面的优选实施方案及其各种实施方案,免疫细胞类型的功能 状态的确定借助于数学模型(本文也表示为免疫系统途径模型),特别是经校准的数学模型 完成。可以将该模型编程以解释至少一种信号传导途径的活性,从而基于该至少一种信号 传导途径活性和优选如本文所公开的途径活性谱来确定免疫细胞类型的功能状态。特别 地,确定至少一种免疫细胞类型的功能状态包含(i)接收该至少一种免疫细胞类型中至少 一个信号传导途径的活性,(ii)确定该至少一种免疫细胞类型的功能状态,该确定基于评 价将该至少一种信号传导途径的活性与指示该至少一种免疫细胞类型的功能状态的分数 相关联的经校准的数学模型。 在本发明的第一方面的优选实施方案及其各种实施方案中,经校准的数学途径模 型是形心或线性模型,或基于条件概率的贝叶斯网络模型。例如,所述经校准的数学途径模 型可以是基于与至少一个信号传导途径中的至少1、2、3或4个的功能状态或指示功能状态 和活性的分数或活性水平相关的条件概率的概率模型,优选贝叶斯网络模型,或所述经校 准的数学途径模型可基于该至少一种信号传导途径中的至少1、2、3或4个的活性的一种或 多种线性组合。 根据所述数学模型,解释信号传导途径的活性以提供指示免疫细胞类型的功能状 态的分数。该分数预测或提供免疫细胞类型在例如静息型、支持型、抑制型、未致敏或记忆 方面的功能状态的概率。 10 CN 111587293 A 说 明 书 7/36 页 在本发明第一方面的优选实施方案及其各种实施方案中,确定该至少一种免疫细 胞类型的功能状态包含区分该至少一种免疫细胞类型的两种或三种功能状态。可以基于以 下关系进行区分。应理解,对于本发明的目的,每一种免疫细胞类型应用至少1种,优选至少 2种,或甚至3种、4种或甚至更多种(如果存在的话)关系。举例而言,为了区分中性粒细胞的 功能状态,该至少一种信号传导途径活性可选自AR、ER、HH、JAK-STAT1/2、JAK-STAT3、MAPK- AP-1、NFkB、Notch、PI3K、TGF-β和Wnt,并且可以确定是否例如基于以下流动关系,PI3K途径 活性增加或不增加(与支持型状态的中性粒细胞相比): 在中性粒细胞中,静息型状态的特征在于比支持型状态更高的PI3K、更低的NFkB、 更低的TGF-β、更低的JAK-STAT1/2、更低的JAK-STAT3、更低的Wnt和更低的Notch途径; 在单核细胞中,静息型状态的特征在于比支持型状态更高的PI3K、更低的NFkB、更 低的TGF-β、更低的Notch和更低的JAK-STAT3途径; 在树突细胞中,静息型状态的特征在于比支持型状态更低的PI3K、更低的NFkB、更 低的JAK-STAT1/2、更低的TGF-β和更低的JAK-STAT3途径; 在树突细胞中,静息型状态的特征在于比抑制型状态更低的PI3K、更高的NFkB和 更低的JAK-STAT1/2途径; 在树突细胞中,支持型状态的特征在于比抑制型状态更高的PI3K、更高的NFkB、更 高的JAK-STAT1/2和更高的TGF-β途径; 在巨噬细胞中,静息型状态的特征在于比支持型状态更低的NFkB、更低的Notch、 更低的JAK-STAT1/2和更低的JAK-STAT3途径; 在CD4 T细胞中,静息型状态的特征在于比支持型状态更高的PI3K、更低的NFkB、 更低的JAK-STAT3、更低的Notch和更低的JAK-STAT1/2途径; 在CD4 T细胞中,静息型状态的特征在于比抑制型状态更低的PI3K、更低的NFkB、 更低的JAK-STAT3和更低的TGF-β途径; 在CD4 T细胞中,支持型状态的特征在于比抑制型状态更低的PI3K、更高的NFkB、 更高的JAK-STAT3、更低的TGF-β和更低的JAK-STAT1/2途径; CD4 Th1细胞的特征在于比CD4 Th2细胞更低的PI3K、更高的NFkB、更高的TGF-β和 更高的JAK-STAT1/2途径; 在T-reg细胞中,静息型状态的特征在于比抑制型状态更低的PI3K、更低的NFkB、 更低的JAK-STAT3、更低的TGF-β和更低的Notch途径; 在CD8 T细胞中,静息型状态的特征在于比支持型状态更低的PI3K、更低的NFkB、 更低的JAK-STAT3、更低的TGF-β、更低的Notch和更低的JAK-STAT1/2途径; T记忆细胞的特征在于比T未致敏细胞更高的PI3K、更高的NFkB和更高的TGF-β途 径; 在B淋巴细胞中,静息型状态的特征在于比支持型状态更高的PI3K、更低的NFkB和 更低的JAK-STAT3途径。 根据本发明的第一方面、第二方面、第三方面和第四方面的优选实施方案及其各 种实施方案,该至少一种信号传导途径选自AR、ER、HH、JAK-STAT1/2、JAK-STAT3、MAPK-AP- 1、NFkB、Notch、PI3K、TGF-β和Wnt信号传导途径。 在优选的实施方案中,该至少一种信号传导途径包含选自上述组中的两种或更多 11 CN 111587293 A 说 明 书 8/36 页 种信号传导途径,并且所述确定基于该两种或更多种信号传导途径的活性。 优选地,所述至少一种信号传导途径包含MAPK-AP-1、PI3K、NFkB、TGF-β、JAK- STAT3、JAK-STAT1/2、Notch和Wnt信号传导途径中的至少1、2、3、4、5、6、7种或全部。更优选 地,所述至少一种信号传导途径包含PI3K、NFkB、TGF-β、JAK-STAT1/2和JAK-STAT3信号传导 途径中的至少1、2、3、4种或全部。甚至更优选地,在先天免疫细胞类型的情况下,所述至少 一种信号传导途径包含PI3K和NFkB信号传导途径中的至少一个或两者,或PI3K、NFkB、JAK- STAT3和TGF-β信号传导途径中的至少1、2、3种或全部,和/或在适应性免疫细胞类型的情况 下,所述至少一种信号传导途径包含PI3K、NFkB和JAK-STAT3中的至少1种、2种或全部。 在免疫周期中描述(图8;参见Chen D .S .和Mellman I .,“Oncology meets immunology:The cancer-immunity cycle”,Immunity”,Immunity,Vol.39,No.1,2013年7 月,1至10页)了免疫细胞的所有功能,包括抗原呈递细胞如树突细胞。它们受信号转导途径 的控制,其中发现JAK-STAT1/2、JAK-STAT3、MAPK-AP-1、NFkB、Notch、PI3K和TGF-β途径是重 要的。如本文所述的途径分析及其定量解释使得可以相对于免疫细胞的功能状态表征免疫 细胞,包括抗原呈递细胞和树突细胞。这使得能够例如预测和评估免疫治疗功效。 根据本发明的第一方面、第二方面、第三方面和第四方面的优选实施方案及其各 种实施方案,通过本文所述的途径分析,例如在从对象分离的细胞或组织样品中,确定各种 免疫细胞类型的信号途径的活性。 基于从与相应信号传导途径相关的转录因子的充分验证的直接靶基因的mRNA水 平的测量推断信号转导途径的活性,途径分析能够定量测量组织/细胞样品中存在的免疫 细胞中信号转导途径活性(参见例如Verhaegh W等人,“Selection of personalized patient therapy through the use of knowledge-based computational models that identify tumor-driving signal transduction pathways”,Cancer research,Vol.74, No .11,2014年6月,2936至2945页;“Knowledge-based computational models”, Oncotarget,Vol.5,No.14,2014年7月,5196和5197页)。 根据本发明的第一方面、第二方面、第三方面和第四方面的优选实施方案及其各 种实施方案,确定一种或多种途径的活性,多种途径活性的组合及其应用是如例如在以下 文献中所描述的那样进行的,出于确定相应信号传导途径的活性的目的将其各自的全部内 容并入本文:国际专利申请WO201 3011 47 9 (题为“Assessmen t of cell ula r signalingpathway activity using probabilistic modeling of target gene expression”)、WO2014102668(题为“Assessment of cellular signaling pathway activity using linear combination(s)of target gene expressions”)、WO2015106135 (题为“Assessment of PI3K cellular signaling pathway activity using mathematical modelling of target gene expression”)、WO2016062891(题为 “Assessment of TGF-βcellular signaling pathway activity using mathematical modelling of target gene expression”)、WO2017029215(题为“Assessment of NFKB cellular signaling pathway activity using mathematical modelling of target gene expression”)、WO2014174003(题为“Medical prognosis and prediction of treatment response using multiple cellular signaling pathway activities”)、 WO2016062892(题为“Medical prognosis and prediction of treatment response 12 CN 111587293 A 说 明 书 9/36 页 using multiple cellular signaling pathway activities”)、WO2016062893(题为 “Medical prognosis and prediction of treatment response using multiple cellular signaling pathway activities”)、WO2018096076(题为“Method to distinguish tumor suppressive FOXO activity from oxidative stress”)、PCT/ EP2018/07633(2018年9月27日提交、题为“Assessment of JAK-STAT1/2cellular signaling pathway activity using mathematical modelling of target gene expression”)、PCT/EP2018/076232(2018年9月27日提交、题为“Assessment of JAK-STAT3 cellular signaling pathway activity using mathematical modelling of target gene expression”)、PCT/EP2018/076488(2018年9月28日提交、题为“Assessment of Notch cellular signaling pathway activity using mathematical modelling of target gene expression”)、PCT/EP2018/076513(2018年9月28日提交,题为“Assessment of MAPK-AP 1cellular signaling pathway activity using mathematical modelling of target gene expression”)、美国专利申请US16/143885(2018年9月27日提交、题为 “DETERMINATION OF JAK-STAT1/2PATHWAY ACTIVITY USING UNIQUE COMBINATION OF TARGET GENES”),US16/143708(2018年9月27日提交、题为“DETERMINATION OF JAK-STAT3 PATHWAY ACTIVITY USING UNIQUE COMBINATION OF TARGET GENES”)、US16/145263(2018 年9月28日提交、题为“DETERMINATION OF NOTCH PATHWAY ACTIVITY USING UNIQUE COMBINATION OF TARGET GENES”)、US16/145722 (2018年9月28日提交、题为 “DETERMINATION OF MAPK-AP-1PATHWAY ACTIVITY USING UNIQUE COMBINATION OF TARGET GENES”)和欧洲专利申请EP16200697 .7(2016年11月25日提交、题为“Method to distinguish tumor suppressive FOXO activity from oxidative stress”)、 EP17194288.1(2017年10月2日提交、题为“Assessment of Notch cellular signaling pathway activity using mathematical modelling of target gene expression”)、 EP17194291 .5(2017年10月2日提交、题为“Assessment of JAK-STAT1/2cellular signaling pathway activity using mathematical modelling of target gene expression”)、EP17194293 .1(2017年10月2日提交、题为“Assessment of JAK-STAT3 cellular signaling pathway activity using mathematical modelling of target gene expression”)和EP17209053.2(2017年12月20日提交、题为“Assessment of MAPK- AP-1cellular signaling pathway activity using mathematical modelling of target gene expression”)。这些模型已经在生物学上针对几种细胞类型的JAK-STAT1/2、 JAK-STAT3、MAPK-AP-1、NFkB、Notch、PI3K、TGF-β和Wnt途径进行了验证。注意,尚未公布的 专利申请中所采用的数学模型以及这些模型在这些申请中的校准和使用通常对应于已经 公布的专利申请中所公开的模型、校准和使用。 为促进快速鉴定参考文献,在本文将上述参考文献指定给所关注的每个信号传导 途径,并且已经指示了适合于测定信号传导途径活性的示例性相应靶基因。在这方面,还特 别参考了上述参考文献提供的靶基因的序列表。 AR:KLK2、PMEPA1、TMPRSS2、NKX3 1、ABCC4、KLK3、FKBP5、ELL2、UGT2B15、DHCR24、 PPAP2A、NDRG1、LRIG1、CREB3L4、LCP1、GUCY1A3、AR和EAF2(WO 2013/011479、WO 2014/ 102668);KLK2、PMEPA1、TMPRSS2、NKX3 1、ABCC4、KLK3、FKBP5、ELL2、UGT2B15、DHCR24、 13 CN 111587293 A 说 明 书 10/36 页 PPAP2A、NDRG1、LRIG1、CREB3L4、LCP1、GUCY1A3、AR、和EAF2(WO 2014/174003); ER:CDH26、SGK3、PGR、GREBl、CA12、XBP1、CELSR2、WISP2、DSCAM、ERBB2、CTSD、TFF1 和NRIPl(WO 2013/011479、WO 2014/102668);GREB1、PGR、XBP1、CA12、SOD1、CTSD、IGFBP4、 TFF1、SGK3、NRIP1、CELSR2、WISP2、和AP1B1(WO 2014/174003);AP1B1、ATP5J、COL18A1、 COX7A2L、CTSD、DSCAM、EBAG9、ESRl、HSPBl、KRT19、NDUFV3、NRIPI、PGR、PISD、PRDM15、PTMA、 RARA、SODl、TFFl、TRIM25、XBPl、GREBl、IGFBP4、MYC、SGK3、WISP2、ERBB2、CA12、CDH26、和 CELSR2(WO 2016/062892、WO 2016/062893); HH:GLI1、PTCH1、PTCH2、IGFBP6、SPP1、CCND2、FST、FOXL1、CFLAR、TSC22D1、RAB34、 S100A9、S100A7、MYCN、FOXM1、GLI3、TCEA2、FYN和CTSL1(WO 2013/011479、WO 2014/102668、 WO 2014/174003);GLI1、PTCH1、PTCH2、HHIP、SPP1、TSC22D1、CCND2、HI 9、IGFBP6、TOM1、 JUP、FOXA2、MYCN、NKX2-2、NKX2-8、RAB34、MIF、GLI3、FST、BCL2、CTSL1、TCEA2、MYLK、FYN、 PITRM1、CFLAR、IL1R2、S100A7、S100A9、CCNDl、JAG2、FOXM1、FOXF1、和FOXL1(WO 2016/ 062892、WO 2016/062893); JAK-STAT1/2:BID、GNAZ、IRF1、IRF7、IRF8、IRF9、LGALS1、NCF4、NFAM1、OAS1、 PDCD1、RAB36、RBX1、RFPL3、SAMM50、SMARCB1、SSTR3、ST13、STAT1、TRMT1、UFD1L、USP18、和 ZNRF3、优选选自:IRF1、IRF7、IRF8、IRF9、OAS1、PDCD1、ST13、STAT1和USP18(EP17194291.5, 如前); JAK-STAT3:AKT1、BCL2、BCL2L1、BIRC5、CCND1、CD274、CDKN1A、CRP、FGF2、FOS、 FSCN1、FSCN2、FSCN3、HIF1A、HSP90AA1、HSP90AB1、HSP90B1、HSPA1A、HSPA1B、ICAM1、IFNG、 IL10、JunB、MCL1、MMP1、MMP3、MMP9、MUC1、MYC、NOS2、POU2F1、PTGS2、SAA1、STAT1、TIMP1、 TNFRSF1B、TWIST1、VIM和ZEB1(EP17194293.1,如前); MAPK-AP-1:BCL2L11、CCND1、DDIT3、DNMT1、EGFR、ENPP2、EZR、FASLG、FIGF、GLRX、 IL2、IVL、LOR、MMP1、MMP3、MMP9、SERPINE1、PLAU、PLAUR、PTGS2、SNCG、TIMP1、TP53和VIM (EP17209053.2,如前); NFkB:BCL2L1、BIRC3、CCL2、CCL3、CCL4、CCL5、CCL20、CCL22、CX3CL1、CXCL1、CXCL2、 CXCL3、ICAM1、IL1B、IL6、IL8、IRF1、MMP9、NFKB2、NFKBIA、NFKB IE、PTGS2、SELE、STAT5A、 TNF、TNFAIP2、TNIP1、TRAF1和VCAM1(WO2017/029215); Notch:CD28、CD44、DLGAP5、DTX1、EPHB3、FABP7、GFAP、GIMAP5、HES1、HES4、HES5、 HES7、HEY1、HEY2、HEYL、KLF5、MYC、NFKB2、NOX1、NRARP、PBX1、PIN1、PLXND1、PTCRA、SOX9和 TNC(EP 17194288.1,如前); PI3K:AGRP、BCL2L11、BCL6、BNIP3、BTG1、CAT、CAV1、CCND1、CCND2、CCNG2、CDK 1A、 CDK 1B、ESRl、FASLG、FBX032、GADD45A、INSR、MXIl、NOS3、PCKl、POMC、PPARGCIA、PRDX3、 RBL2、SOD2和TNFSF10(WO 2015/101635);ATP8A1、BCL2L11、BNIP3、BTGl、ClOorflO、CAT、 CBLB、CCNDl、CCND2、CDKNIB、DDB1、DYRK2、ERBB3、EREG、ESRl、EXT1、FASLG、FGFR2、GADD45A、 IGF1R、IGFBP1、IGFBP3、INSR、LGMN、MXI1、PPM1D、SEMA3C、SEPP1、SESN1、SLC5A3、SMAD4、 SOD2、TLE4、和TNFSF10(WO 2016/062892、WO 2016/062893);SOD2、BNIP3、MXI1、PCK1、 PPARGC1A和CAT(EP16200697.7,如前); TGF-β:ANGPTL4、CDC42EP3、CDKNIA、CDKN2B、CTGF、GADD45A、GADD45B、HMGA2、ID1、 IL11、SERPINE1、INPP5D、JUNB、MMP2、MMP9、NKX2-5、OVOL1、PDGFB、PTHLH、SGK1、SKIL、SMAD4、 14 CN 111587293 A 说 明 书 11/36 页 SMAD5、SMAD6、SMAD7、SNAI1、SNAI2、TIMP1和VEGFA(WO 2016/062891、WO 2016/062893); Wnt:KIAA1199、AXIN2、RNF43、TBX3、TDGF1、SOX9、ASCL2、IL8、SP5、ZNRF3、KLF6、 CCND1、DEFA6和FZD7(WO 2013/011479、WO 2014/102668、WO 2014/174003);ADRA2C、ASCL2、 AXIN2、BMP7、CCNDl、CD44、COL18A1、DEFA6、DKKl、EPHB2、EPHB3、FAT1、FZD7、GLUL、HNF1A、 CXCL8(之前称为IL8)、CEMIP(之前称为KIAAl 199)、KLF6、LECT2、LEF1、LGR5、MYC、NKD1、 OAT、PPARG、REGIB、RNF43、SLC1A2、SOX9、SP5、TBX3、TCF7L2、TDGF1、和ZNRF3(WO 2016/ 062892、WO 2016/062893); 如本文所公开的用于确定不同信号传导途径活性的途径分析方法所共有的是一 个概念,其优选地在本文中应用于本发明的目的,其中样品中存在的细胞如免疫细胞中的 信号传导途径的活性可如下确定:接收所述信号传导途径的一或多个、优选三或更多个靶 基因的表达水平,确定所述样品中信号途径相关转录因子(TF)元件的活性水平,该TF元件 控制所述三或更多个靶基因的转录,该确定基于评价使所述三或更多个靶基因的表达水平 与所述信号途径的活性水平相关联的经校准的数学途径模型,以及任选地基于所确定的所 述样品中所述信号传导途径相关TF元件的活性水平推断所述细胞中所述信号传导途径的 活性。如本文所述,所述活性水平可直接用作确定所述至少一种免疫细胞类型的功能状态 的输入。因此,可能不必基于TF元件的活性水平明确地推断所述信号传导途径的活性,而是 可以将TF元件的活性水平直接用作所述信号传导途径的活性水平。 如上所示,本文所用的术语“转录因子元件”(TF元件)优选是指活性转录因子的中 间体或前体蛋白或蛋白复合物,或控制特定靶基因表达的活性转录因子蛋白或蛋白复合 物。例如,所述蛋白复合物可以至少含有各自信号传导途径蛋白之一的胞内结构域,以及一 种或多种辅因子,从而控制靶基因的转录。优选地,该术语是指通过裂解各自信号传导途径 蛋白之一导致细胞内结构域而触发的蛋白或蛋白复合物转录因子。 本文所用的术语TF元件的“活性水平”表示TF元件在其靶基因转录方面的活性水 平。 如本文所用,术语“靶基因”是指其转录直接或间接受相应转录因子元件控制的基 因。“靶基因”可以是“直接靶基因”和/或“间接靶基因”(如本文所述)。 所述经校准的数学途径模型可以是基于使信号途径相关TF元件的活性水平与所 述三或更多个靶基因的表达水平相关的条件概率的概率模型,优选贝叶斯网络模型,或者 所述经校准的数学途径模型可以基于所述三或更多个靶基因的表达水平的一或多个线性 组合。为了本发明的目的,所述经校准的数学途径模型优选是基于条件概率的形心或线性 模型,或贝叶斯网络模型。 特别地,可以例如通过以下来确定对象中靶基因的表达水平以及任选地推断信号 传导途径的活性:(i)评价经校准的概率途径模型优选贝叶斯网络的一部分,其代表一组输 入的细胞信号传导途径,该输入包括在对象样品中所测得的细胞信号传导途径的所述三或 更多个靶基因的表达水平,(ii)估计对象信号传导途径相关转录因子(TF)元件的活性水 平,该信号传导途径相关TF元件控制所述细胞信号传导途径的所述三或更多个靶基因的转 录,该估计基于条件概率,该条件概率将所述信号途径相关TF元件的活性水平和在对象样 品中所测得的所述细胞信号传导途径的所述三或更多个靶基因的表达水平相关联,以及任 选地(iii)基于所述对象样品中所述信号传导途径相关TF元件的估计的活性水平来推断所 15 CN 111587293 A 说 明 书 12/36 页 述细胞信号传导途径的活性。这在已公开的国际专利申请WO 2013/011479A2中详细描述 (“Assessment of cellular signaling pathway activity using probabilistic modeling of target gene expression”),其全部内容并入本文。 在示例性替代方案中,确定对象中细胞信号传导途径的表达水平以及任选地推断 细胞信号传导途径的活性可例如如下进行:(i)确定对象样品中信号传导途径相关转录因 子(TF)元件的活性水平,该信号传导途径相关TF元件控制该细胞信号传导途径的所述三或 更多个靶基因的转录,该确定基于评价将所述细胞信号传导途径的三或更多个靶基因的表 达水平与所述信号传导途径相关TF元件的活性水平相关联的经校准的数学途径模型,该数 学途径模型基于所述三或更多个靶基因表达水平的一或多种线性组合,以及任选地(ii)基 于所确定的对象样品中所述信号传导途径相关TF元件的活性水平推断对象中所述细胞信 号传导途径的活性。这在公开的国际专利申请WO 2014/102668A2(“Assessment of cellular signaling pathway activity using linear combination(s)of target gene expressions”)中详细描述,其全部内容并入本文。 可在Verhaegh W.等的“Selection of personalized patient therapy through the use of knowledge-based computational models that identify tumor-driving signal transduction pathways”,Cancer Research,Vol.74,No.11,2014年,2936至2945 页中找到关于使用靶基因表达的数学建模推断细胞信号传导途径活性的进一步细节。 在一个实施方案中,使用qPCR、多重qPCR (multiple q PCR)、多路qPCR (multiplexed qPCR)、ddPCR、RNAseq、RNA表达阵列或质谱法进行信号传导途径测量。例如, 可以使用基因表达微阵列数据,例如Affymetrix微阵列或RNA测序方法,如Illumina测序 仪。 根据本发明的第二方面,通过用于确定对象的先天免疫系统活性状态的方法来解 决所述问题,其中该方法包含:基于对象的至少一个样品中的至少一种先天免疫细胞类型 的功能状态来确定先天免疫系统活性状态。所述至少一种先天免疫细胞类型的功能状态优 选可通过本发明第一方面的方法确定。 在一个实施方案中,所述方法进一步包含提供先天免疫系统活性状态,例如作为 进一步方法、特别是根据本发明第四方面的方法的输入变量或输入值。 在另一个实施方案中,所述方法还包含提供先天免疫系统活性状态,例如用于本 文公开的各种目的。 根据本发明的第三方面,通过用于确定对象的适应性免疫系统活性状态的方法来 解决所述问题,其中该方法包含:基于对象的至少一个样品中的至少一种适应性免疫细胞 类型的功能状态来确定适应性免疫系统活性状态。所述至少一种适应性免疫细胞类型的功 能状态优选地可通过本发明第一方面的方法确定。 在一个实施方案中,所述方法还包含提供适应性免疫系统活性状态,例如作为根 据本发明第四方面的方法的输入变量或输入值。 在另一个实施方案中,所述方法还包含提供适应性免疫系统活性状态,例如用于 本文公开的各种目的。 根据本发明的第四方面,通过用于确定对象的总体免疫系统活性状态的方法来解 决所述问题,其中该方法包含基于该对象的先天性和适应性免疫系统活性状态来确定总体 16 CN 111587293 A 说 明 书 13/36 页 免疫系统活性状态,所述先天和/或适应性免疫系统活性状态可根据本发明第二方面和第 三方面的方法确定。可替代地,可基于对象的至少一个样品中的至少一种不同先天免疫细 胞类型和至少一种不同适应性免疫细胞类型的功能状态来确定总体免疫系统活性状态,所 述至少一种不同先天和/或适应性免疫细胞类型的功能状态优选可根据本发明第一方面的 方法确定。 在一个实施方案中,所述方法还包含提供对象的总体免疫系统活性状态,例如作 为用于本文公开的其他方法或各种目的的输入变量或输入值。 术语“先天免疫系统活性状态”、“适应性免疫系统活性状态”和“总体免疫系统活 性状态”可以描述相应免疫系统的免疫应答的活性,和/或相应免疫系统对总体免疫应答的 贡献,例如以活性、静息或抑制性。如本文所述,指示至少一种免疫细胞类型的功能状态的 分数可直接用作确定先天免疫系统活性状态的输入。因此,该术语还可以指指示免疫系统 活性状态的分数。 本发明人发现,单独针对先天和/或适应性免疫系统或针对总体免疫系统的免疫 系统活性状态可以有利地基于一或多种免疫细胞类型的功能状态来确定。免疫细胞自身不 起作用,并且它们共同协调免疫应答。因此,为了本发明的目的,对一种免疫细胞类型的测 定的解释可能是足够的。在某些情况下,可以通过评估一种或多种其他免疫细胞类型来验 证解释,或者可以基于一种或多种其他免疫细胞类型来解释。因此,为了本发明的目的,也 设想了多种免疫细胞类型的分析,以预测免疫应答的状态。例如,在根据本发明第二方面、 第三方面和第四方面的方法中,先天免疫细胞类型和/或适应性免疫细胞类型可以各自包 括1、2、3、4、5种或甚至更多种不同的免疫细胞类型。 有利地,所述方法允许确定先天免疫应答是否有效调节组织中的(非特异性)炎症 并与适应性免疫系统通讯以募集其针对靶如癌细胞或病原体的特异性作用(当被确定为有 活性,即支持型时)。还可以借助于先天免疫应答(当确定为活性时)确定适应性免疫应答是 否有效地调节对靶的高特异性应答。还可以确定先天性和适应性免疫应答分别对总免疫应 答的贡献,特别是根据疾病,应答可以是更先天或更适应性的情况。 根据本发明第二方面的优选实施方案及其各种实施方案,所述确定基于至少3种, 优选4种不同的先天免疫细胞类型。根据本发明第三方面的优选实施方案及其各种实施方 案,所述确定基于至少3种,优选至少4种,更优选至少5种,甚至更优选至少6种,最优选7种 不同的先天免疫细胞类型。根据本发明第四方面的优选实施方案及其各种实施方案,所述 确定基于至少3种,优选4种不同的先天免疫细胞类型和/或至少3种,优选至少4种,更优选 至少5种,甚至更优选至少6种,最优选7种不同的先天免疫细胞类型。通常,不同的细胞类型 越多,结果越准确。因此,可以考虑更多免疫细胞类型以提高准确性。 根据本发明的第二方面、第三方面和第四方面的优选实施方案及其各种实施方 案,对先天、适应性和/或总体免疫系统活性状态的确定是借助于数学模型(在本文也是指 免疫应答计算模型)、特别是经校准的数学模型完成的。该模型可以被编程来解释不同免疫 细胞类型的功能状态,以基于所述不同免疫细胞类型的组合功能状态来确定所述免疫系统 状态。 特别地,对象的先天免疫系统活性状态可通过包含以下步骤的方法确定:(i)接收 至少一种先天免疫细胞类型的功能状态,该功能状态可通过根据本发明第一方面的方法及 17 CN 111587293 A 说 明 书 14/36 页 其各种实施方案确定,(ii)确定对象的先天免疫系统状态(本文也指“免疫应答活性分 数”),该确定基于评价将该至少一种先天免疫细胞类型的功能状态与该对象的先天免疫系 统活性状态相关联的经校准的数学模型,并且任选地(iii)提供该对象的先天免疫系统活 性状态,例如用于本文所述的各种目的。 通过相应方法可确定对象的适应性免疫系统活性状态。具体地,该方法包含(i)接 收至少一种适应性免疫细胞类型的功能状态,该功能状态可通过根据本发明第一方面的方 法及其各种实施方案确定,(ii)确定该对象的适应性免疫系统活性状态,该确定基于评价 将至少一种适应性免疫细胞类型的功能状态与对象的适应性免疫系统活性状态相关联的 经校准的数学模型,以及任选地(iii)提供对象的适应性免疫系统活性状态,例如用于本文 所述的各种目的。 通过解释用于确定适应性和先天免疫系统活性状态的组合方法,或通过使用先天 免疫细胞功能状态和适应性免疫细胞功能状态作为输入值可确定对象的总体免疫系统活 性状态。具体地,对象的总体免疫系统活性状态可通过包含以下步骤的方法确定:(i)接收 至少一种适应性和至少一种先天免疫细胞类型的每一种的功能状态,该功能状态可通过根 据本发明第一方面的方法及其各种实施方案确定,(ii)确定对象的总体免疫系统活性状 态,该确定基于评价将至少一种适应性和至少一种先天免疫细胞类型的功能状态与对象的 总体免疫系统活性状态相关联的经校准的数学模型,并且任选地(iii)提供对象的总体免 疫系统活性状态,例如用于本文所述的各种目的。 在本发明的第二方面、第三方面和第四方面的优选实施方案及其各种实施方案 中,所述经校准的数学途径模型是形心或线性模型,或基于条件概率的贝叶斯网络模型。例 如,所述经校准的数学途径模型可以是基于使免疫系统状态和至少一种免疫细胞类型的功 能状态相关的条件概率的概率模型,优选为贝叶斯网络模型,或者所述经校准的数学途径 模型可以基于至少一种免疫细胞类型的功能状态的一或多个线性组合。 根据该计算模型,所述至少一种免疫细胞类型的功能状态被解释为例如以变量或 值的形式提供总体免疫系统状态,其以免疫活性、免疫抑制或静息,预测总体免疫应答的活 性状态(在本文也指“免疫系统活性状态”)或提供总体免疫应答的活性状态(在本文也指 “免疫系统活性状态”)的概率。该模型还可分别用于测定先天免疫反应和适应性免疫反应 的活性。该模型可以固有地提供这些不同类型的免疫应答的免疫系统活性状态,这是对免 疫应答总体状态的计算的一部分,或者该模型可以容易地分为两个单独部分,分别用于先 天性和适应性免疫应答。在贝叶斯模型中,这已经可以从所描述的模型读出。 在本发明的第二方面、第三方面和第四方面的优选实施方案及其各种实施方案 中,所述方法进一步包含: 确定或预测先天免疫系统状态、适应性免疫系统状态和/或总体免疫系统状态是 否处于支持型状态、静息型状态或免疫抑制型状态; 确定或预测总体免疫系统状态是否主要由先天免疫系统状态支配; 确定或预测总体免疫系统状态是否主要由适应性免疫系统状态支配; 确定或预测至少一种免疫细胞类型是否具有异常功能状态,其中异常是指在一定 情况下其应给予另一种功能状态,例如在癌症情况下该功能状态应是活性的,在自身免疫 性疾病情况下该功能状态应是非活性的; 18 CN 111587293 A 说 明 书 15/36 页 预测、监测或确定对治疗的应答; 预测、监测或确定治疗的有效性; 预测、监测或确定抗肿瘤免疫应答; 确定或监测对象是否适合治疗; 确定、优化或调节治疗、剂量和/或给药方案; 诊断或分型疾病,特别是免疫介导的疾病; 监测免疫介导的疾病的活性状态; 在疾病或治疗期间监测免疫应答状态; 预测治疗对免疫系统状态的副作用; 诊断或筛选处于疾病如癌症高风险的个体; 免疫功能低下状态的诊断;或 诊断活性过强的免疫应答; 其中所述确定、预测、监测、优化、调节或诊断基于至少一种免疫细胞类型的功能 状态、至少一种先天免疫细胞类型和/或至少一种适应性免疫细胞类型的功能免疫细胞活 性,和 其中所述治疗优选选自免疫治疗,特别是抗肿瘤免疫治疗、化疗、靶向治疗、放疗、 免疫活化治疗、免疫调节治疗、免疫抑制治疗、疫苗接种、体内疫苗接种、体外树突细胞接 种、抗病原体或抗感染治疗,例如抗生素或抗病毒治疗或抗真菌治疗。 根据本发明的第五方面,设备包含数字处理器,该数字处理器被配置为执行根据 本发明第一方面、第二方面、第三方面和第四方面及其各种实施方案的方法的任一种。 根据本发明的第六方面,非暂时性存储介质存储可由数字处理装置执行以执行根 据本发明第一方面、第二方面、第三方面和第四方面及其各种实施方案的方法的任一种的 指令。该非暂时存储介质可以是计算机可读存储介质,例如硬盘驱动器或其他磁存储介质、 光盘或其他光存储介质、随机存取存储器(RAM)、只读存储器(ROM)、闪存或其他电子存储介 质、网络服务器等。数字处理装置可以是手持装置(例如个人数据助理或智能电话)、笔记本 计算机、台式计算机、平板计算机或装置、远程网络服务器等)。 根据本发明的第七方面,计算机程序包含程序代码模块(program code means), 当计算机程序在数字处理装置上运行时,该程序代码模块用于使数字处理装置执行根据本 发明第一方面、第二方面、第三方面和第四方面及其各种实施方案的任一种方法。所述数字 处理装置可以是手持装置(例如个人数据助理或智能电话)、笔记本计算机、台式计算机、平 板计算机或装置、远程网络服务器等。 根据本发明的第八方面,用于实施根据本发明第一方面、第二方面、第三方面和第 四方面的任一种方法及其各种实施方案的试剂盒包含: 用于定量以下各信号传导途径的转录因子的靶基因中的一个,优选三或更多个的 表达的组分: NFkB和PI3K(转录因子FOXO);以及任选地以下的一或多种: 用于定量以下每个信号传导途径的一个,优选三或更多个靶基因表达的组分,每 种: AR、ER、HH、JAK-STAT1/2(转录因子STAT1/2)、JAK-STAT3(转录因子STAT3)、MAPK- 19 CN 111587293 A 说 明 书 16/36 页 AP-1(转录因子AP-1)、Notch、TGF-β和Wnt。 在一个优选的实施方案中,所述试剂盒包含用于FOXO、NFkB和STAT3靶基因的组 分,以及任选地包含用于TGF-β、STAT1/2、Notch、Wnt、AP-1、AR、ER和HH靶基因的组分的至少 一种。在另一个优选的实施方案中,所述试剂盒包含用于FOXO、NFkB和TGF-β靶基因的组分, 以及任选地包含用于STAT3、STAT1/2、Notch、Wnt、AP-1、AR、ER和HH靶基因的组分的至少一 种。在另一个优选的实施方案中,所述试剂盒包含用于FOXO、NFkB、STAT3和TGF-β靶基因的 组分,以及任选地包含用于STAT1/2、Notch、Wnt、AP-1、AR、ER和HH靶基因的组分的至少一 种。在另一个优选的实施方案中,所述试剂盒包含用于FOXO、NFkB、STAT3、TGF-β和STAT1/2 靶基因的组分,以及任选地包含用于Wnt、Notch、AP-1、AR、ER和HH靶基因的组分的至少一 种。 用于测量靶基因表达水平的一或多种组分或手段可以选自:DNA阵列芯片、寡核苷 酸阵列芯片、蛋白质阵列芯片、抗体、多种探针例如标记的探针、一组RNA逆转录酶测序组 分、和/或RNA或DNA包括cDNA、扩增引物。在优选的实施方案中,所述试剂盒选自qPCR、多重 qPCR、多路qPCR、ddPCR、RNAseq、RNA表达阵列和质谱。在一个实施方案中,所述试剂盒包括 针对本文所述靶基因的mRNA或cDNA序列的一部分的一组标记探针。在一个实施方案中,所 述试剂盒包括针对靶基因的mRNA或cDNA序列的一部分的一组引物和探针。在一个实施方案 中,标记的探针包含在标准化96孔板中。在一个实施方案中,所述试剂盒还包括针对一组参 考基因的引物或探针。这样的参考基因可以是例如可用于归一化或标准化本文所述靶基因 表达水平的表达水平的组成型表达的基因。 根据本发明的第九方面,系统包含: 如本文所述的本发明的试剂盒,和 如本文所述的本发明的设备,如本文所述的本发明的非暂时存储介质,或如本文 所述的本发明的计算机程序。 根据另一个公开的方面,本文所述的本发明的试剂盒或系统用于进行本文所述的 本发明的方法。 如本文所述的本发明还可以例如有利地用于以下活动中的至少一项中: 如本文所述的本发明还可以例如有利地用于以下活动中的至少一项中: 预测对免疫治疗/免疫活化药物/免疫调节药物/免疫抑制药物/疫苗接种/体内疫 苗接种/体外树突细胞疫苗接种的应答; 监测对免疫治疗的应答; 量化对免疫治疗的应答; 针对癌症、自身免疫/免疫介导的疾病、感染性疾病、炎性疾病、其他具有免疫成分 的疾病; 在由免疫细胞类型诸如树突免疫细胞组成的样品上鉴定该细胞是否功能性地处 于静息状态、激活状态或免疫抑制状态; 在由树突免疫细胞组成的样品上鉴定该细胞是否功能性地处于静息状态、激活状 态或免疫抑制状态; 在来自含有树突细胞的器官/组织的组织样品上鉴定该树突细胞是否是静息的、 有活性的或被抑制的; 20 CN 111587293 A 说 明 书 17/36 页 在来自含有树突细胞的癌组织的组织样品上鉴定该树突细胞是否是静息的、有活 性的或被抑制的; 在来自肿瘤引流淋巴结的组织样品上鉴定树突细胞是否是静息的、有活性的或被 抑制的; 在含有来自患有自身免疫性疾病的患者的树突细胞的组织样品上鉴定该树突细 胞是否是静息的、有活性的或被抑制的; 在血液样品上鉴定树突细胞是否是静息的、有活性的或被抑制的; 在患者样品上鉴定免疫治疗是否将有效; 在血液样品上鉴定免疫治疗是否将有效; 在组织样品上鉴定免疫治疗是否将有效; 在来自样品的树突细胞上鉴定免疫治疗是否将有效; 在来自患者的样品上鉴定所运用的治疗是否有效; 在来自患者的样品上鉴定所运用的免疫治疗是否有效; 在血液样品上鉴定患者是否符合免疫活化治疗,特别是树突细胞活化免疫治疗或 疫苗接种治疗; 在来自患有癌症的患者的样品上鉴定免疫活化治疗是否将有效,特别是树突细胞 活化免疫治疗; 在来自患有癌症的患者的样品上鉴定树突细胞活化免疫治疗是否将有效; 在来自患有癌症的患者的树突细胞上鉴定树突细胞活化免疫治疗是否将有效; 在来自患者的树突细胞上鉴定体内疫苗接种是否将有效; 在体外活化的树突细胞上鉴定随后在树突细胞疫苗接种中是否将有效; 在树突细胞疫苗接种治疗后在来自血液的树突细胞上鉴定该治疗是否有效; 在树突细胞上鉴定STING途径活化药物是否将有效; 在树突细胞上鉴定应用的STING途径活化药物是否有效; 基于例如以下假设预测对免疫治疗的应答:当例如肿瘤中的免疫应答已经是活性 的时,额外的刺激可能不是有效的; 表征抗原递呈免疫细胞类型、特别是树突细胞的功能性免疫活性或免疫抑制型状 态; 基于抗原呈递免疫细胞类型、特别是树突细胞类型的功能免疫活性或免疫抑制型 状态,预测治疗应答; 基于抗原呈递免疫细胞类型、特别是树突细胞类型的功能免疫活性或免疫抑制型 状态,预测对免疫调节治疗形式的应答; 基于抗原呈递免疫细胞类型、特别是树突细胞类型的功能性免疫活性或免疫抑制 型状态,预测对免疫刺激治疗的应答; 基于抗原呈递免疫细胞类型、特别是树突细胞类型的功能免疫活性或免疫抑制型 状态,预测对免疫抑制治疗的应答; 基于抗原递呈免疫细胞类型、特别是树突细胞类型的功能免疫活性或免疫抑制型 状态,评估(上述提及的全部)治疗的功效; 基于抗原呈递免疫细胞类型、特别是树突细胞类型的功能免疫活性或免疫抑制型 21 CN 111587293 A 说 明 书 18/36 页 状态,监测治疗应答; 基于抗原呈递免疫细胞类型、特别是树突细胞类型的功能免疫活性或免疫抑制型 状态,评估或监测治疗依从性。 在本文任何方面的实施方案中,可以以这样的方式对淋巴结组织或淋巴结组织的 特定部分如滤泡或生发中心区域进行途径分析,使得可以在淋巴结的不同功能区中分别分 析不同的免疫细胞类型以评估淋巴结在免疫应答中的功能活性。 在本文任何方面的实施方案中,可以对癌症组织中的淋巴结样区域如具有滤泡或 生发中心样结构的区域进行途径分析,以评估肿瘤中免疫细胞的抗肿瘤活性,并将该信息 与对淋巴结和/或血液中免疫细胞的途径分析相结合。 在一个实施方案中,所有癌症类型和癌症亚型;和免疫系统介导的疾病如炎性肠 病、类风湿性关节炎、银屑病、SLE、多发性硬化等,和炎性疾病如哮喘、动脉粥样硬化、糖尿 病、精神疾病如抑郁症和精神分裂症、痤疮、子宫内膜异位症等,和感染性疾病如细菌或病 毒感染或寄生物感染,测量单独或混合的免疫细胞类型中的组合途径活性谱。在患病或感 染的组织和血液中促进诊断、疾病亚型分型,例如在免疫介导疾病的情况中。 描述了包含测定树突细胞的成熟度和/或功能活性,任选地包括它们募集效应细 胞的能力的方法。 在本文任何方面的实施方案中,树突细胞的途径分析用于评估关于树突细胞的效 应细胞募集的成熟期和/或功能活性。 在一个实施方案中,测量树突细胞的成熟状态以基于结果决定对癌症患者施用免 疫治疗,例如,作为抗癌治疗,当树突细胞不具有所需成熟状态(与JAK-STAT1/2、JAK- STAT3、NFkB、TGF-β和Notch途径的活性和PI3K途径的降低活性相关(与增加的FOXO转录因 子活性反向相关))时,增加效应免疫细胞募集的树突细胞刺激治疗更可能有效。 在一个实施方案中,测量树突细胞的成熟状态以基于结果决定对自身免疫性疾病 患者施用免疫抑制治疗,例如免疫抑制药物,如JAK-STAT1/2或JAK-STAT3抑制剂可能干扰 效应细胞募集,导致症状减轻。 在一个实施方案中,患者来源的PMBC或树突细胞在体外分化或成熟为成熟树突细 胞并作为体外疫苗接种程序暴露于特异性癌抗原,之后将它们返回给患者作为对抗其癌症 的治疗。在体外暴露之前和之后评估DC的功能状态以决定DC激发程序的功效,并且在返回 至患者后评估体内功效。 通过获得样品,血液或组织、或树突细胞的任何其他体液或来源,如细胞培养模 型,进行示例性方法,并且从分离的树突细胞中分离样品RNA,随后通过测量各信号传导途 径的靶基因mRNA的水平并针对AR、ER、HH、JAK-STAT1/2、JAK-STAT3、MAPK-AP-1、NFkB、 Notch、PI3K、TGF-β和Wnt途径推断途径活性分数为log2几率或概率来如上所述进行途径分 析。从这些途径的活性,推断功能活性状态和效应细胞募集的能力。 描述了包含测定树突细胞功能活性状态的方法。该方法包含与数学计算模型结合 的一或多个信号转导途径的测量,该数学计算模型解释该信号传导途径测量以提供计算的 功能细胞活性分数,其以定量方式指示抗原呈递细胞、更具体地该树突细胞是否处于激活 状态(指抗原摄取、加工、呈递和迁移至适当位置用于呈递给淋巴细胞),或静息/非活性状 态,或被免疫抑制/致耐受性(非功能性)状态。术语“途径”、“信号转导途径”和“信号传导途 22 CN 111587293 A 说 明 书 19/36 页 径”在本文中可互换使用。 描述了一种方法,该方法包含确定树突免疫细胞或不同的树突免疫细胞类型的组 合的信号传导途径活性谱并使用数学模型将测量解释为功能活性分数。 在本文任何方面的一个实施方案中,所述样品是血液和/或对象是健康个体。 在本文任何方面的一个实施方案中,在从血液样品获得的树突免疫细胞类型中的 JAK-STAT1/2、JAK-STAT3、PI3K、TGF-β、Wnt、Notch、NFkB途径活性测量指示个体中的树突免 疫细胞类型的免疫功能是否偏离正常,如在健康个体中发现的。 在本文任何方面的一个实施方案中,在血液中,所有树突免疫细胞类型(如mDC、 pDC)可以使用标准技术(例如流式细胞术、Miltenyi珠等)分离,以通过测量途径活性谱关 于活性/免疫抑制型状态进行单独分析。 在本文任何方面的一个实施方案中,从个体抽取血液以测量和解释个体或组合的 树突免疫细胞类型中的组合途径活性谱,以推断患者的功能性树突免疫细胞活性是否偏离 健康个体中的功能性树突免疫细胞活性。 在本文任何方面的一个实施方案中,从个体抽取血液以测量和解释个体或组合的 树突免疫细胞类型中的组合途径活性谱,以推断患者是健康的或是患病的。 在本文任何方面的一个实施方案中,在开始治疗之前和之后从个体中抽取血液以 测量个体或组合的树突免疫细胞类型中的组合途径活性谱,以评价治疗对不同或组合的树 突免疫细胞中功能活性状态的影响,该功能活性状态是针对途径活性所测量的。 在本文任何方面的一个实施方案中,在开始治疗之前和之后从个体抽血以测量和 解释个体或组合的树突免疫细胞类型中的组合途径活性谱以预测免疫调节治疗的副作用。 通过从人抽血执行示例性方法,使用如FACS的方法分离不同的树突免疫细胞,如 mDC和pDC,分离RNA并且随后通过测量各个信号传导途径的靶基因mRNA的水平并针对JAK- STAT1/2、JAK-STAT3、PI3K、NFkB、TGF-β、Wnt和Notch途径推断途径活性分数为log2几率或 概率(或另一分数)来进行所述的途径分析。通过数学模型(例如贝叶斯模型或线性模型)解 释样品中测量的途径分数以提供功能免疫活性分数并与健康个体的功能免疫活性分数比 较。在一或多种树突免疫细胞类型或其组合中,偏离正常值的途径分数指示该细胞类型的 异常免疫功能。这可能由疾病或治疗引起。 在阅读和理解附图、以下描述并且特别是在阅读下文提供的详细实施例时,进一 步的优点对于本领域技术人员将是明显的。 本申请描述了几个优选实施方案。在阅读和理解前面详细描述的基础上,其他人 可以想到修改和改变。本申请旨在被解释为包括所有这样的修改和改变,只要它们落入所 附权利要求或其等价的范围内。 [0200] 通过研究附图、公开内容和所附权利要求,本领域技术人员在实施所要求保护的 发明时可以理解和实现对所公开的实施方案的其他改变。 [0201] 应当理解,权利要求1、8和9的方法、权利要求11的设备、权利要求12的非暂时存储 介质、权利要求13的计算机程序、权利要求14的试剂盒,以及权利要求15的系统具有类似 和/或相同的优选实施方案,特别地如从属权利要求所限定。 [0202] 在权利要求中,词语“包含”不排除其他元素或步骤,并且不定冠词“一种”或“一 个”不排除多个。 23 CN 111587293 A 说 明 书 20/36 页 [0203] 单个单元或装置可以实现权利要求中所述的若干项目的功能。在相互不同的从属 权利要求中陈述某些措施的起码事实并不表示不能有利地使用这些措施的组合。 [0204] 可以通过任何其他数目的单元或装置来执行计算(如由一个或多个单元或装置执 行的风险分数的确定)。 [0205] 计算机程序可以存储/分布在合适介质(诸如光存储介质或固态介质)上,与其他 硬件一起提供或作为其他硬件的一部分提供,但也可以以其他形式分布,诸如经由因特网 或其他有线或无线电信系统。 [0206] 应当理解,本发明的优选实施方案也可以是从属权利要求或上述实施方案与各自 独立权利要求的任何组合。 [0207] 参考下文描述的实施方案,本发明的这些和其他方面将变得明显并被阐明。 附图说明 [0208] 一般来说:在所有描述信号转导途径分析分数的图中,其被给定为途径活性的 log2几率分数,来自贝叶斯途径模型分析提供的途径活性的概率分数。Log2分数以线性标 度表示信号传导途径的活性水平。所分析的公共数据集用它们的GSE编号表示,而各个样品 用它们的GSM数(原则上最左列)。每个样品的注释,如GEO数据库中所示,包括在图中的特定 列中,其标题为注释信息(途径分析分数的左侧)。将每个样品的免疫细胞类型、免疫系统/ 免疫应答的活性分数加入含有各自途径分数的列右侧的列中。在途径分析列中:FOXO或 PI3K-FOXO是指:FOXO转录因子的活性,与PI3K途径活性相反,即当FOXO log2分数高时, PI3K信号传导途径活性低;NFkB是指NFkB信号转导途径;Notch是指Notch信号传导途径; STAT12_1是指由I型干扰素特异性活化的JAK-STAT1/2途径;STAT12_2是指由II型干扰素特 异性活化的JAK-STAT1/2途径;STAT3_血液是指JAK-STAT3信号传导途径,针对血细胞上的 特定用途进行校准;TGFB_1或TGFB是指TGF-β信号传导途径;APl指MAPK-APl信号传导途径。 [0209] 用于信号传导途径模型或免疫应答/系统模型的所有验证样品是独立的样品,并 且未被用于校准待验证的相应模型。 [0210] 在以下附图中: [0211] 图1A和1B示例性地显示基于分别为形心(A)和线性(B)模型的途径分析的中性粒 细胞的两状态(静息型、支持型)免疫模型的校准和验证结果;图1B(续)显示具有阈值的静 息型和支持型样品之间的分离。对该模型使用了PI3K、NFkB、Notch、JAK-STAT1/2-1(I型干 扰素)和JAK-STAT1/2-2(II型干扰素)、JAK-STAT3(经血液校准的)、TGF-β、Wnt途径。校准组 包含未受刺激的血液来源中性粒细胞(静息型)和LPS刺激的血液来源中性粒细胞(支持 型),所有样品均来自健康个体(GSE22103)。已知LPS活化中性粒细胞,并且这些样品被指定 为免疫支持型。独立模型验证组包含经过类似处理的样品(GSE28490)。在校准组以及验证 组中,形心模型和线性模型对中性粒细胞的功能活性状态评分都100%准确。在列“状态” 中,显示基本事实细胞状态(静息型、支持型)。在验证组中,最右列包含每个样品的模型结 论;OK意指:准确并符合基本事实,错误意指错的,不符合基本事实。这对于包含类似样品分 析结果的所有以下附图是相同的。 [0212] 图2A和2B示例性地显示基于分别为形心(A)和线性(B)模型的途径分析的单核细 胞两状态(静息型、支持型)免疫模型的校准和验证结果;图2B(续)显示具有阈值的静息型 24 CN 111587293 A 说 明 书 21/36 页 和支持型样品之间的分离。将PI3K、NFkB、Notch、JAK-STAT1/2-1(I型干扰素)和JAK-STAT1/ 2-2(II型干扰素)JAK-STAT3(经血液校准的)、TGF-β途径用于该模型。校准组包括未受刺激 的汇集的(来自10个供体/分析的mRNA样品)血液来源的单核细胞,所有样品均来自健康个 体(GSE28490)。从第二个数据集,使用从健康人供体血液的外周血单个核细胞(PBMC)分离 的单核细胞获得的样品数据(GSE43700)。PBMC通过Ficoll-Hypaque处理活化,粘附于细胞 培养板,并在含有10%FBS(胎牛血清)的培养基中培养24小时,随后从该细胞群体中分离活 化的CD14 单核细胞。两个独立的模型验证组包含来自正常个体的未受刺激的血液来源的 CD14 单核细胞(静息型)(GE72642)和与校准组(支持型)类似活化的CD14 单核细胞 (GE16385)。在校准组以及验证组中,形心模型对单核细胞的功能活性状态的评分100%准 确。线性模型评分稍低(80%)。 [0213] 图3A和3B示例性地显示基于分别为形心(A)和线性(B)模型的途径分析的树突细 胞的两状态(静息型、支持型)免疫模型的校准和验证结果;图3B(续)显示具有阈值的静息 型和支持型样品之间的分离。将PI3K、NFkB、Notch、JAK-STAT1/2-1(I型干扰素)和JAK- STAT1/2-2(II型干扰素)JAK-STAT3(经血液校准的)、TGF-β途径用于该模型。校准组包括2 个健康供体的血液来源的单核细胞,其使用(Zaslavsky E .等人,“Antiviral response dictated by choreographed cascade of transcription factors”,Journal of Immunology,Vol.184,No.6,2010年3月,2908至2917页中描述的)标准方案被分化为不成熟 树突细胞,随后用载体(顶部4个样品,指定为静息型)或新城疫病毒(NDV)感染(底部4个样 品,指定为支持型)18小时(GSE18791)。该NDV感染是用于树突细胞正常活化的模型系统 (Zaslavsky E .等,Antiviral response dictated by choreographed cascade of transcription factors,Journal of Immunology,Vol.184,No.6,2010年3月,2908至2917 页),并且在18小时已经获得了最大激活状态。验证组包含来自具有未致敏树突细胞(静息 型)、暴露于NDV感染的细胞(支持型)和NDV感染的细胞(支持型)的上清液的细胞的样品的 数据(GSE52081)。在校准组和验证组中,形心模型和线性模型对树突细胞的功能活性状态 评分都100%准确。 [0214] 图4A和图4B示例性地显示基于分别为形心(A)和线性(B)模型的四种信号传导途 径的途径分析的树突细胞的3状态(静息型、支持型、抑制型)免疫模型的校准和验证结果; 图4B(续)显示具有阈值的静息型和支持型样品之间的分离。对该模型使用了PI3K、NFkB、 JAK-STAT1/2-1(I型干扰素)和TGF-β途径。校准组包括来自一个健康供体的血液来源的 CD14 单核细胞的3个样品,使用GM-CSF和IL4(静息型)使它们分化为未成熟树突细胞,用 LPS(支持型)使它们成熟/活化,或用IL10/地塞米松组合使它们被免疫抑制(抑制型) (Jansen B.J .等,“MicroRNA genes preferentially expressed in dendritic cells contain sites for conserved transcription factor binding motifs in their promoters”,BMC Genomics,2011年6月,12:330)(GSE23371)。验证组由血液来源的CD14 单 核细胞样品(使用GM-CSF和IL4将其分化为未成熟树突细胞(静息型))和类似获得的未成熟 树突细胞样品(随后用IL-1β、IL-6、TNF-α和PGE2将其成熟/活化(支持型))组成(Cabezón R .等,“MERTK as negative regulator of human T cell activation”,Journal of Leukocyte Biology,Vol.97,No.4,751-760页)(GSE13762 GSE56017)。形心模型对验证组 中树突细胞的功能活性状态评分100%准确。线性模型评分相当差(11%准确)。 25 CN 111587293 A 说 明 书 22/36 页 [0215] 图5A和5B示例性地显示基于分别为形心(A)和线性(B)模型的三个信号途径的途 径分析的树突细胞的三状态(静息型、支持型、抑制型)免疫模型的校准和验证结果;图5B (续)显示具有阈值的静息型和支持型样品之间的分离。对该模型使用了PI3K、NFkB和TGF-β 途径。与图4中使用相同的校准和验证样品(校准GSE23371;验证GSE13762 GSE56017)。形心 模型与图4A中描述的4途径模型表现一样好,说明途径分析的该示例替代组合也表现良好 (100%准确)。线性模型评分相当差(正在重新评价该解释)。 [0216] 图6A和6B示例性地显示基于分别为形心(A)和线性(B)模型的途径分析的巨噬细 胞Ml的两状态(静息型、支持型)免疫模型的校准和验证结果;图6B(续)显示具有阈值的静 息型和支持型样品之间的分离。PI3K、NFkB、Notch、JAK-STAT1/2-1(I型干扰素)和JAK- STAT1/2-2(II型干扰素)、JAK-STAT3(经血液校准的)、TGF-β途径用于该模型。校准组包括 来自两个健康个体的外周血单核细胞衍生的巨噬细胞(三次重复),其在体外分化为巨噬细 胞(静息型),或随后用LPS活化(支持型)(GSE43596)。验证组包含得自7名健康志愿者的肺 衍生巨噬细胞样品的数据,这些健康志愿者在支气管肺泡灌洗之前将盐水运用到肺段(静 息型)或LPS(支持型)(GSE40885)。在校准组和验证组中,形心模型和线性模型对巨噬细胞 的功能活性状态评分都100%准确。 [0217] 图7A和7B示例性地显示基于分别为形心(A)和线性(B)模型的途径分析的CD4 淋 巴细胞的两状态(静息型、支持型)免疫模型的校准和验证结果;图7B(续)显示具有阈值的 静息型和支持型样品之间的分离。将PI3K、NFkB、Notch、JAK-STAT1/2-1(I型干扰素)和JAK- STAT1/2-2(II型干扰素)、JAK-STAT3(经血液校准的)、TGF-β途径用于该模型。校准组包含 来自以下的数据:7个样品(包含从健康个体获得的未活化的CD4 记忆T细胞(静息型))和3 个样品(其中使用针对CD3和CD28的抗体以标准方式活化CD4 记忆T细胞(样品8、9、10;支持 型)和底部4个样品(11-14)(其含有用来自4名患者的免疫抑制性乳腺癌上清液处理的类似 活化的CD4 T细胞(抑制型))(GSE36766)。验证组包含来自一个未受刺激的CD4 T效应淋巴 细胞样品(静息型)和来自用抗CD3/CD28活化的CD4 T效应细胞样品的按时间顺序的样品 (支持型)的数据(GSE11292)。形心模型对验证组中CD4 T淋巴细胞的功能活性状态评分 100%准确。线性模型对校准组和验证组的功能活性评分分别71%和100%准确。 [0218] 图8A和图8B示例性地显示基于分别为形心(A)和线性(B)模型的途径分析的Th1和 Th2 CD4 T淋巴细胞的两状态(静息型、支持型)免疫模型的校准和验证结果;图8B(续)显示 具有阈值的静息型和支持型样品之间的分离。对该模型使用了PI3K、NFkB、JAK-STAT1/2-1 (I型干扰素)和JAK-STAT1/2-2(II型干扰素)、TGF-β途径。校准组含有3个CD4 T细胞(来自 脐带血)样品(重复)(分化为T辅助1(Th1)淋巴细胞(使用Act IL12)(支持型))和3个样品 (重复)(其中CD4 细胞分化为T辅助2淋巴细胞(Th2)(使用Act IL4)(抑制型))(GSE71566)。 验证组包含经IL12(支持型)或IL14联合抗-IL12(抑制型)处理的相似样品(各3个生物学重 复)(GSE32959)。在验证组中,形心模型和线性模型对Th1和Th2淋巴细胞的功能活性状态评 分都100%准确,因此能够很好地区分Th1和Th2淋巴细胞。支持型=Th1;抑制型=Th2。 [0219] 图9A和9B示例性地显示基于分别为形心(A)和线性(B)模型的途径分析的T调节淋 巴细胞(T-reg细胞)的两状态(静息型、支持型)免疫模型的校准和验证结果;图9B(续)显示 具有阈值的静息型和支持型样品之间的分离。PI3K、NFkB、Notch、JAK-STAT1/2-1(I型干扰 素)和JAK-STAT1/2-2(II型干扰素)、JAK-STAT3(经血液校准的)、TGF-β途径用于该模型。校 26 CN 111587293 A 说 明 书 23/36 页 准数据集包含来自具有分离自来自6个健康对照外周血的分选的调节T细胞(T-reg细胞)的 样品(GSE65010,静息型)和用抗CD3/CD28/IL2刺激的按时间顺序的T-reg细胞(GSE11292, 抑制性)的数据。独立验证数据集包含一个未处理的T-reg细胞样品(静息型)和按时间顺序 的用抗CD3/-CD28/IL2刺激的T-reg细胞,这是产生免疫抑制型功能所必需的(GSE11292,抑 制型)。在校准组和验证组中,形心模型和线性模型对T-reg淋巴细胞的功能活性状态评分 都100%准确。 [0220] 图10A和10B示例性地显示基于分别为形心(A)和线性(B)模型的途径分析的CD8 T 淋巴细胞的两状态(静息型、支持型)免疫模型的校准和验证结果;图10B(续)显示具有阈值 的静息型和支持型样品之间的分离。PI3K、NFkB、Notch、JAK-STAT1/2-1(I型干扰素)和JAK- STAT1/2-2(II型干扰素)、JAK-STAT3(经血液校准的)、TGF-β途径用于该模型。校准组含有 未致敏CD8 T淋巴细胞(GSE26347,静息型),和一个含有在其特异性抗原存在下活化的CD8 T细胞的样品(GSE63129,支持型)。验证组含有来自健康个体血液的静息CD8 T淋巴细胞 (GSE72642,静息型),以及用IL-2/抗CD3抗体和eAPC或eAPC:4-1BBL扩增的CD8 T细胞克隆 的样品(GSE86284,支持型)。在校准组和验证组中,形心模型和线性模型对CD8 淋巴细胞的 功能活性状态评分都100%准确。CD8 T细胞在抑制型状态下无数据。 [0221] 图11A和11B示例性地显示基于分别为形心(A)和线性(B)模型的途径分析的T记忆 淋巴细胞的两状态(未致敏、记忆)免疫模型的校准和验证结果;图11B(续)显示具有阈值的 静息型和支持型样品之间的分离。对该模型使用了PI3K、NFkB、TGF-β途径。校准组包含从6 名健康个体外周血分离出的记忆T效应细胞(记忆)和未致敏T效应细胞(未致敏)。验证组包 含具有来自健康个体外周血的记忆T细胞(GSE65010 GSE26495,记忆)和来自健康个体的未 致敏CD8 T细胞(GSE26495)和未致敏T-reg细胞(GSE65010,未致敏)的样品。形心模型对验 证组中T细胞的功能活性状态(未致敏或记忆)评分96%准确(一个重复样品被错误地评分 为记忆)(类似于校准组结果)。对于校准组和验证组,线性模型评分相当差。 [0222] 图12A和12B示例性地显示基于分别为形心(A)和线性(B)模型的途径分析的B淋巴 细胞的两状态(静息型、支持型)免疫模型的校准和验证结果;图12B(续)显示具有阈值的静 息型和支持型样品之间的分离。将PI3K、NFkB、JAK-STAT3途径用于该模型。校准组含有具有 来自健康个体血液的B淋巴细胞的样品(GSE39411)(未受刺激(静息型))或作为用山羊F (ab ')2抗-人IgM刺激B细胞受体的培养物中的按时间顺序的B细胞(支持型)。验证组 (GSE9119)包含具有来自健康个体(静息型、支持型)的类似处理的B淋巴细胞的样品。该模 型对验证组中B细胞的功能活性状态评分75%准确。 [0223] 图13A-13G示例性地和示意性地显示基于提供免疫活性应答分数(A)的数学模型 (功能性免疫应答模型“类型1”)计算免疫应答活性百分比(本文也是指免疫系统状态)的方 法。在该实例中,总分数范围可以在19(最大、完全活性的免疫系统)和6(最小、受抑制的免 疫系统)之间。从19中减去6得到13,除以1-100%免疫应答激活比例。线性活性分数可通过 以下公式转化为激活百分比:免疫活性百分比=[(累积点-6/13]×100。百分比>77%表示 活性免疫应答;低于77%的百分比越来越指示免疫被抑制的免疫应答。为了将该读数变为 免疫活性对免疫抑制的定量分数,是指免疫应答状态:该“静息”阈值可以从77%重置为0, 同时去除%号。公式为如下:%免疫应答活性-77=免疫活性状态,其中正数是指免疫应答 是活性的,负数是指免疫应答被抑制。当代入先前的公式中时:免疫应答状态{[(累积点-6/ 27 CN 111587293 A 说 明 书 24/36 页 13]×100}-77。负数表示免疫应答抑制;正数表示免疫应答活性(图13E)。在并非所有输入 值都可用的情况下(F),可如下计算免疫活性百分比:免疫活性百分比=[(分数-min/max- min]×100,其中:min=所测得的免疫细胞类型的最小点值(在实例中:0 1=1);max=所测 得的免疫细胞类型的最大点值(在实例中:2 2=4)。对于本实例,免疫活性百分比=[(分 数-1/3]×100%。在本实例中:100%,但不确定性高,因为模型中只输入了两个可观测值。 可以如下计算(不)确定性:当所有11个可观测值(意指进入模型的输入变量,即免疫细胞类 型的功能活性分数)作为进入模型的输入值是可用的时=关于免疫活化状态预测的最大确 定性=定义为100%确定性。假设:可观察量对最终分数的线性贡献:(100/11)=9%确定性 贡献/可观察量。在示例性情况,2个累积点输入提供100%的免疫活性分数,相关82%不确 定性。图13A:用于计算免疫应答的模型,由两个部分的免疫应答(先天性和适应性)组成。进 入模型的输入变量或可观察值是免疫细胞类型的功能活性分数,通过在每种细胞类型中的 信号转导途径分析确定。将可观察分数相加,以提供先天性和适应性免疫系统活性以及总 体免疫系统活性的分数。图13B至13D:基于血细胞分析计算免疫系统活性的示例性情况。图 13B:用于免疫活化状态的示例性情况:血细胞分析,对癌症的活性应答。图13C:用于非活 性、静息免疫应答的示例性情况:血细胞分析,无活性免疫应答。图13D:用于免疫抑制状态 的示例性情况:血细胞分析,耗竭的免疫应答。图13F:示例性情况,仅来自两个免疫细胞类 型的功能活性状态输入可用。在并非所有输入值都可用的情况下计算免疫活性百分比:免 疫活性百分比=[(分数-min)/max-min]×100%,其中:min=所测得的免疫细胞类型的最 小点值(在实例中:0 1=1);Max=所测得的免疫细胞类型的最大点值(在实例中:2 2=4)。 对于本实例,免疫活性百分比=[(分数-1)/3]×100%。本实例的结果是100%活性,然而由 于模型中只输入了两个可观测值,因此不确定性高。当将相关的不确定性结合到结果中时: 2个累积点输入提供了100%的免疫系统活性分数,具有82%的不确定性。图13G:分数的计 算。 [0224] 图14示例性地和示意性地显示基于贝叶斯网络模型的数学模型(功能免疫应答模 型“类型2”)计算免疫应答活性的概率或log2几率分数的方法。图14A:贝叶斯网络模型的有 向无环图,其中箭头从先天性和适应性免疫细胞活性状态指向免疫应答活性并且从先天免 疫细胞活性状态指向适应性免疫活性状态。箭头方向在贝叶斯网络模型中具有定义意义。 表格图中显示作为模型的一部分的每个免疫细胞类型的示例性贝叶斯网络模型节点参数, 即分别具有2个和3个免疫活性状态的免疫细胞类型的两状态(静息型和支持型)和3状态模 型(静息型、支持型、抑制型)节点的参数。它们能够分别计算先天性和适应性免疫系统的活 性状态。图14B:确定总体免疫应答/免疫系统的活性状态。根据先天性和适应性免疫系统的 免疫活性分数,可以获得总体免疫应答的活性状态的结果。总体免疫应答是一个有效的查 找表。不存在概率依赖性。上图表格:这是用于具有2个父节点(先天性和适应性免疫系统) 的转置格式的节点表。右下方数字表应如下所示:给定先天性免疫系统是抑制型,处于静息 型状态的适应性免疫系统的概率为0.3。注意,列中的概率总计为1(但行中不必),因为给定 先天性免疫是活性的,(第1列)AI的3个选项是活性、静息型、抑制型,因此列必须总和为1。 [0225] 图15示例性地和示意性地显示基于线性模型(免疫应答模型“类型3”)计算免疫应 答活性的数值免疫分数的方法。图15A:计算免疫应答的构建模型。在所描绘的实例中,分数 是10,指示最大活性免疫系统/应答。图15B:计算免疫应答活性:高于10点的累积点越来越 28 CN 111587293 A 说 明 书 25/36 页 指示免疫应答不是非活性/抑制型的,而低于10的累积点越来越指示免疫应答处于抑制型 状态。在所描绘的实例中,分数是10,指示最大活性免疫系统/应答。 [0226] 图16A和16B示例性地和示意性地显示基于线性模型(线性免疫应答模型“类型3变 体A”)或线性转化成百分比模型特异性地测量免疫应答的免疫抑制型状态的方法。从点到 百分比的转换与已经描述的类似(图13)。在该实例中,最高的免疫抑制免疫应答分数是15。 最小免疫抑制应答分数为3点。免疫抑制免疫应答分数=[(累积点-3)/12]×100%。图16A: 模型用于免疫抑制计算的图。图16B:最大免疫抑制免疫应答/系统的实例。图16C:在该实例 中,最高免疫抑制免疫应答分数为15点,最低免疫抑制应答分数为3点(计算为[(累积点- 3)/12]×100)。 [0227] 图17A和17B示例性地和示意性地显示使用数学模型(“类型3变体B”)测量先天免 疫应答(在本文也是指先天免疫系统状态)和适应性免疫应答(在本文也是指适应性免疫系 统状态)的活性的方法。同样方法可用于描述总体免疫应答模型。图175A:示例性说明活性 先天免疫系统。图17B:示例性说明活性适应性免疫系统。 [0228] 图18A和图18B示例性地显示测量免疫应答状态的结果(数据集GSE72462)。从3名 健康个体的外周血样品分离不同的免疫细胞类型(CD4 、CD8 和B-淋巴细胞、中性粒细胞、 单核细胞),用本文描述的方法分析微阵列结果以使用形心模型评估各种免疫细胞类型的 功能活性状态,并且模型结果用作类型1(百分比免疫应答活性)免疫应答模型的输入。图 18A:显示途径分析结果的系列,以及连续CD4淋巴细胞、CD8淋巴细胞、B细胞、单核细胞、PMN 的形心模型结果(所有3个样品“静息”分数,所有免疫细胞类型的数据均可获得)。图的底部 显示被分析样品相对于相应免疫细胞类型的功能性免疫细胞活性模型校准样品的位置。图 18B:免疫应答模型计算(基于图18A的形心模型结果):百分比免疫活性=[(分数-min)/ (max-min)]×100%。(5-4)/(10-4)×100%=17%。不确定性计算:缺少可观察/变量=6。 不确定性6×9=54%不确定性。范围:0-71%,活性免疫应答的阈值为77%,指示这些样品 代表非活性免疫应答的高置信度。在这种情况下,数据集中的所有三个样品评分相似。图 18C:结果显示了使用类型2(贝叶斯模型免疫应答活性)免疫应答模型的分析。免疫细胞活 性分析(图18A)的形心模型结果也用作类型2(贝叶斯模型免疫应答活性)免疫应答模型的 输入。取细胞类型CD4、CD8、B细胞、单核细胞和PMN并将这些细胞归属于100%静息型状态, 形成了一套关于贝叶斯网络的证据。对于三个重复的每一个,生成数据集,其中状态不是 100%特定静息型状态,而是被定义为概率性的。从用形心模型获得的距离导出概率(如在 图18A中报告的),其中最高概率归因于具有最小距离的状态。使用以下Softmax方法确定概 率: [0229] [0230] 贝叶斯免疫应答模型计算的结果显示,先天免疫细胞类型、适应性免疫细胞类型 以及总体免疫应答对于正常/静息型状态的活性状态具有最高概率,与健康个体所期望的 免疫应答活性状态完全一致。 [0231] 图19示意性地显示免疫周期并指出了免疫系统中主要的三个位置,在这些位置可 以在患有癌症的患者中获得免疫细胞。 [0232] 图20A-20D示意性和示例性地显示使用两状态(静息型与支持型)贝叶斯模型基于 29 CN 111587293 A 说 明 书 26/36 页 NFkB、JAK-STAT1/2和TGF-β途径活性分数预测树突细胞功能状态的方法和校准结果。(在后 面的图中显示对独立数据集的贝叶斯模型的验证)。图20A和20B示意性地显示该方法。图 20A:用于计算树突细胞静息(非活性)状态的贝叶斯模型。图20B:用于计算树突细胞支持 (活性)状态的贝叶斯模型。图20C:顶部:作为贝叶斯模型的一部分的三条途径中的每一条 的CPT值(贝叶斯节点参数);底部:使用数据集GSE23371的校准数据集途径分析结果,其中 每个分析样品指示途径活性分数(GSM数)。图20D:数据集GSE23371的校准结果。在条形图 中,用条形表示每个被分析的样品。左:对于x轴上的样品数的校准结果,通过y轴上的log2 几率模式计算的免疫分数,负log2几率意指静息型,正log2几率是指支持型;右:对于x轴上 的校准结果样品数,由y轴上的模型概率计算的免疫分数,低概率意指静息型、高概率意指 支持型。基本事实是免疫静息型或免疫支持型。发现静息型DC具有为免疫静息型(非活性) 的高概率/log2几率。支持型DC具有为免疫支持型的高概率/log2几率。 [0233] 图21A-21D示意性和示例性地显示使用3状态(静息型对支持型对抑制型)贝叶斯 模型基于NFkB、JAK-STAT1/2、TGF-β、MAPK-APl和PI3K途径活性分数预测树突细胞功能状态 的方法和校准结果。图21A至21C示意性地显示该方法。图21A:用于计算树突细胞非活性静 息型状态的3状态贝叶斯模型。图21B:用于计算树突细胞免疫支持型状态的3状态贝叶斯模 型。图21C:用于计算树突细胞免疫抑制型状态的3状态贝叶斯模型。图21D:CPT值(贝叶斯网 络节点参数)。图21D,续:使用数据集GSE23371的校准数据集途径分析结果,其中每个分析 的样品指示了途径活性分数(GSM数)。图21E:数据集GSE23371上的贝叶斯模型校准结果。前 两个条形图显示用于评估免疫抑制状态的模型结果;条形图3/4显示用于评估免疫支持型 状态的结果;条形图的5/6显示静息型状态评估的结果。y轴显示相应分数,条形图1、3、5是 log2几率分数;条形图2、4、6是概率分数。在条形图中,每个被分析的样品由条形表示。在每 个条形图中,左边的三个条形表示具有“免疫抑制”状态基本事实的样品的分数;条形图4到 6表示具有“免疫支持型”状态基本事实的样品;条形图7到9表示具有“静息型”状态基本事 实的样品。在这些条形下方或上方的这些条形中的每一者中指示该基本事实状态。结果:免 疫抑制型DC具有为免疫抑制型的最高概率。支持型DC具有为免疫支持型的最高概率。静息 型DC具有为免疫静息型的最高概率。 [0234] 图22A-22E示意性和示例性地显示使用线性模型基于途径活性分数预测树突细胞 功能状态的方法、校准和验证结果。图22A:两状态(静息型与支持型)模型的分数。图22B:3 状态(静息型与支持型与抑制型)的分数。图22C:两状态模型(顶部)和3状态模型(底部)的 校准途径分析结果,针对每个单独样品(由GSM数指示)以及途径活性(最右列)的总和(累积 值)指示途径分析结果。图22D:两状态模型的独立数据集GSE18791的验证结果。该数据集中 的样品使用新城疫病毒(NDV)感染分别免疫活化1、2、4、6、8、10、12、14、16、18小时,或不活 化(参考:Zaslavsky E.等,“Antiviral response dictated by choreographed cascade of transcription factors”,Journal of Immunology,Vol.184,No.6,2010年3月,2908至 2917页)。结果:按照规定的分数,短期(最多4小时)活化的样品处于免疫静息型状态。活化 中间持续时间导致在静息型和支持型之间的中间状态。较长活化时间(>8小时)一致导致免 疫支持型状态。当样品未被活化(未感染NDV的整个系列的对照样品)时,它们处于免疫静息 状态(图22D,续)。图23E:3状态模型的数据集GSE13762和GSE18791的验证结果。数据集 GSE13762含有静息和免疫抑制(致耐受性)树突细胞的样品(参考:Széles L .等,“1 ,25- 30 CN 111587293 A 说 明 书 27/36 页 dihydroxyvitamin D3 is an autonomous regulator of the transcriptional changes leading to a tolerogenic dendritic cell phenotype”,Journal of Immunology, Vol.182,No.4,2009年2月,2074-2083页)。在图22D描述数据集GSE18791:样品用NDV分别活 化1、2、4、6、8、10、12、14、16、18小时,或不活化或被抑制。分析来自GSE18792数据集的样品 的结果与图22D描述的结果类似:根据规定的分数,短期活化的样品处于免疫静息状态。活 化中间持续时间导致在静息型和支持型之间的中间状态。较长时间的活化导致免疫支持型 状态。该模型准确预测了树突状细胞活性状态基本事实。图22D续显示来自GSE18792的对照 未处理样品组,并且在底部显示来自数据集GSE13762的6个样品。列“子组”包含基本事实名 称“静息型”或“免疫抑制型”。模型计算的结果:通过模型准确地将样品评分为静息型或免 疫抑制型。 [0235] 图23A-23E示意性和示例性地显示使用形心模型基于途径活性分数预测树突细胞 活性状态的方法、校准和验证结果。图23A:2-状态(静息型与支持型)模型。图23B:3-状态 (静息型与支持型与抑制型)。图23C:2-状态模型(顶部)和3-状态模型(底部)的校准数据集 途径分析结果。在每个校准数据集的底部显示形心模型校准结果。图23D:2-状态模型的独 立数据集GSE18791(图22中描述)的验证结果。样品用NDV感染分别活化1、2、4、6、8、10、12、 14、16、18小时,或不活化。结果:与图22说明中报道的那些类似。图23E:3-状态模型的数据 集GSE13762和GSE18791的验证结果。结果:与图22说明中报道的那些类似。 [0236] 图24:树突细胞贝叶斯模型的验证。在GSE79184数据集上使用3-状态贝叶斯模型 确定IL-4和IL-15培养的树突细胞的功能状态的示例性结果。IL-15培养的DC具有更多的支 持型和IL-4培养的具有更多的抑制型/致耐受性性质(由与该数据集相关的参考文献提供 的基本事实(参考:van Acker H.H.等人,“Desirable cytolytic immune effector cell recruitment by interleukin-15dendritic cells”,Oncotarget,Vol .8,No.8,2017, 13652-13665页)。y轴显示相应分数,对于左条形图,以log2几率分数显示;对于右条形图, 以概率分数显示。在条形图中,每个被分析的样品由条形表示。在每个条形图中,左边的三 个条形表示具有“免疫支持型”状态(与IL-15相关)基本事实的样品的分数;右边的三个条 形表示具有“免疫抑制”状态(与IL-4相关)基本事实的样品。在条形图的左侧,从上到下,显 示了用于分析的模型读数:免疫抑制型、免疫支持型、静息型。注意,三个概率分数和是1。根 据本文所用的定义,具有最高分数的状态定义了属于样品的状态。 [0237] 图25A和25B示例性地显示数据集GSE18971(图22中所述)的贝叶斯2-状态模型(免 疫抑制型和免疫支持型)的验证结果。样品分别用NDV活化1、2、4、6、8、10、12、14、16、18小 时,或不活化。对于每个条形图,校准样品指示在垂直线的左边,并且每个条形代表被分析 的树突细胞样品(条形1-3代表免疫抑制的树突细胞、条形4-6代表免疫支持型树突细胞、条 形7-9代表静息型树突细胞)。GSE18791的验证样品位于垂直线右侧:条形1-4代表NDV活化 开始前的对照样品;条形5-8代表在NDV活化开始后2小时的样品;条形9-12代表NDV活化开 始后4小时的样品,条形13-16代表NDV活化开始后6小时的样品;条形17-20代表NDV活化开 始后8小时的样品;条形21-24代表NDV活化开始后10小时的样品;条形25-28代表NDV活化开 始后12小时的样品;条形29-32代表NDV活化开始后14小时的样品;条形33-36代表NDV活化 开始后16小时的样品;条形37-39代表NDV活化开始后18小时的样品;条形40-57代表未被 NDV活化的对照树突细胞样品。应当注意,DC的活化花几个小时来将它们从静息型转变为支 31 CN 111587293 A 说 明 书 28/36 页 持型。图25A和25A续:验证数据集GSE18971的途径分析结果,其中每个样品具有途径活性分 数(GSM数)。图25B:样品的模型验证结果来自数据集GSE18791。校准样品结果描绘在左边并 且在条形图中表示为“校准”。每个条形表示具有y轴log2几率分数(顶图)和概率分数(底 图)的样品结果。总结:静息型DC具有为免疫静息型的高概率。支持型DC有为免疫支持型的 高概率。校准组和验证组的结果一致。 [0238] 图26示例性地显示使用GEO数据集GSE18791(图22中描述)在体外活化树突细胞期 间所测得的作为时间(以小时计,在X轴上)函数的信号转导途径活性(途径活性以y轴上的 log2几率表示)的结果。在图22、23和25中,显示通过各种模型分析的相应树突细胞活性分 数。在NDV活化后的多个时间点,测量树突状细胞样品的信号转导途径活性。描述了NFkB、 JAK-STAT1/2和TGF-β途径的每时间点平均途径活性,并通过线连接。在图中用箭头表示途 径标识。如所述进行的信号转导途径分析显示,在1小时后NFkB途径已经变得有活性;4小时 后JAK-STAT1/2途径变得有活性,10小时后TGF-β途径变得有活性。这种观察到的信号传导 途径的顺序活化与这些树突细胞样品的活性分数的逐渐增加平行运行,并且与树突细胞中 这些信号传导途径的已知功能一致:即NFkB途径对于抗原加工是重要的,JAK-STAT1/2途径 对于抗原呈递是重要的,最后已知TGF-β途径参与细胞的迁移行为,并被活化使表达抗原的 树突状细胞迁移至淋巴结以激活适应性免疫应答。 [0239] 图27A至27C示例性地显示了用于评估树突细胞活性状态的贝叶斯3-状态(免疫抑 制型、免疫支持型、免疫静息型)计算模型的验证结果。对所有三种状态提供分数;根据我们 的定义,具有最高分数的状态定义属于样品的状态(注意,所提供的三个活性概率分数和是 1)。图27A和图27A续:验证数据集GSE13672和GSE18971,每个样品(GSM数)具有计算的途径 活性分数(APl、FOXO、STAT1/2、TGF-β)。对于数据集的描述,我们参考图23。图27B:对来自数 据集GSE18791的样品的模型验证结果,该数据集仅包含注释为静息型和支持型的样品。对 于每个条形图,校准样品指示在垂直线的左边,并且每个条形代表被分析的树突细胞样品 (条形1-3代表免疫抑制的树突细胞、条形4-6代表免疫支持型树突细胞、条形7-9代表静息 型树突细胞)。GSE18791的验证样品位于垂直线右侧:条形1-4代表NDV活化开始前的对照样 品;条形5-8代表在NDV活化开始后2小时的样品;条形9-12代表NDV活化开始后4小时的样 品,条形13-16代表NDV活化开始后6小时的样品;条形17-20代表NDV活化开始后8小时的样 品;条形21-24代表NDV活化开始后10小时的样品;条形25-28代表NDV活化开始后12小时的 样品;条形29-32代表NDV活化开始后14小时的样品;条形33-36代表NDV活化开始后16小时 的样品;条形37-39代表NDV活化开始后18小时的样品;条形40-57代表未被NDV活化的对照 树突细胞样品。左条形图显示log2几率标度的结果(Y轴);右条形图显示概率标度(Y轴)的 结果。使用3-状态贝叶斯模型,获得免疫抑制状态(前2个条形图)、免疫支持型状态(后2个 条形图)(图27续)和静息型状态(最后2个条形图)(图27续)的分数。Log2几率分数和概率分 数读出结果相似。DC的静息型和免疫抑制型(致耐受性)分数紧密联系在一起,但仍能可靠 地区分。支持型DC具有高免疫支持型分数。图27C:对来自数据集GSE13791(在图22中描述) 的样品的模型验证结果,该数据集仅包含注释为静息型和抑制型的样品。左条形图显示 log2几率的结果(Y轴);右条形图显示概率标度结果(Y轴)。垂直线左侧的样品条是校准样 品,线右侧是验证样品。在每个条形图中指示了树突细胞样品的基本事实状态。校准样品: 条形1-3代表免疫抑制型样品;条形4-6代表免疫支持型样品;条形7-9代表免疫静息型样 32 CN 111587293 A 说 明 书 29/36 页 品。验证样品:条形1-3代表静息型树突细胞样品;条形4-6代表免疫抑制型(致耐受性)树突 细胞样品。前2个条形图显示免疫支持型分数(图27C),条形图3-4显示静息型分数(图27C 续)。结果:支持型树突细胞具有低免疫抑制型和静息型分数和高免疫支持型分数。免疫抑 制型和静息型样品具有为免疫支持型的低概率;和最高的静息型分数;因此,它们被模型分 类为通常接近免疫抑制状态的静息型。
技术实现要素:
[0240] 以下实施例仅说明特别优选的方法和与其相关的选定方面。本文提供的教导可以 用于构建几种测试和/或试剂盒,例如用于检测、预测和/或诊断一或多种免疫细胞类型、适 应性免疫系统、先天免疫系统或总体免疫系统的功能状态。此外,在使用如本文所述的方法 时,可以有利地指导药物处方,可以进行药物应答预测和药物功效(和/或副作用)的监测, 可以预测和监测耐药性,例如选择随后要执行的测试(如伴随诊断测试)。以下实施例不应 解释为限制本发明的范围。 [0241] 1:方法和样品描述 [0242] 使 用来自 临 床 和临 床前研究 样品的 G E O 数 据集数 据库 ( h t t p s : / / www.ncbi.nlm.nih.gov/gds/)Affymetrix 2.0Plus数据,在该临床和临床前研究中,各种 类型的免疫细胞在静息和各种活性状态下,用相关细胞因子刺激和不刺激进行了研,使用 所述途径模型分析了信号转导途径的活性(图1至12)。这能够鉴定在静息型状态和活性或 免疫抑制型状态下不同免疫细胞类型的特征性途径活性组合并且对于每种免疫细胞类型 定义了与暴露于激活或免疫抑制细胞因子或其他因子相关的特征性免疫功能途径谱。 [0243] 免疫应答的功能状态可以在产生或实现免疫应答的各种位置测量,如在患病组织 中,在引流淋巴结中或在血液中。在癌症的实例中,这些位置概括在所谓的“免疫周期”中 (图19)。简言之,为了有效的抗癌免疫应答,在肿瘤组织癌中,在适当的炎性环境中,抗原被 树突细胞摄取、携带至引流淋巴结并呈递至活化的CD4 和CD8 T细胞;CD4 T细胞可以被活 化而变成共同活化CD8 细胞的Th1细胞,该CD8 细胞穿过血液到达癌症组织,在此处攻击癌 细胞。在癌组织中,癌细胞不能呈递合适抗原,它们可抑制树突细胞和T细胞的活性,导致缺 乏抗肿瘤活性。通过测量来自三个位置的不同免疫细胞类型中的途径活性谱并评估它们的 个体活性或免疫抑制状态,总体免疫应答的功能状态例如静息型状态、(抗肿瘤)激活状态 或免疫抑制型(肿瘤耐受)状态。这可用于在开始治疗之前预测针对肿瘤的免疫应答,并预 测和监测对(免疫)治疗的应答,或调节/优化治疗剂量,或监测任何疾病期间的免疫应答状 态,或预测免疫调节治疗的副作用,或测量对免疫调节药物的顺应性,或监测免疫介导的疾 病。该治疗可以是免疫治疗,但例如在患癌的情况下,还可以是将通过杀死肿瘤细胞从肿瘤 细胞释放对免疫应答具有作用的抗原的另一种治疗(例如化疗、靶向治疗、放疗等)。 [0244] 对于在先天免疫系统/应答和适应性免疫系统/应答中起作用的以下免疫细胞类 型,已经鉴定了公共GEO数据集,其中可从特定免疫细胞类型的不同功能活性状态(如静息 型状态、活化或免疫支持型状态、致耐受性或免疫抑制状态、记忆细胞状态)的相应细胞类 型获得Affymetrix数据。对于每个分析的样品,要求已知关于活性状态的基本事实。 [0245] 从这些数据集为每种免疫细胞类型定义了校准组和至少一个评价/验证组。 [0246] 随后,使用每个免疫细胞类型所定义的校准组,如本文所述对可获得活性状态的 33 CN 111587293 A 说 明 书 30/36 页 不同细胞类型进行如本文所公开的途径分析。 [0247] 可以设想,在将来收集免疫细胞数据之后,使用该方法,可以基于数据分析进一步 改进如在本文公开的基本途径模型,并且选择对于在本文描述的免疫分析应用功能更好的 靶基因组合。收集与关于免疫细胞状态或免疫应答状态的“基本事实”证据结合的数据允许 靶基因组合的改善或添加用于免疫应用的新靶基因。 [0248] A.先天免疫应答: [0249] a .单核细胞,静息型、免疫支持型(校准GSE28490 GSE43700/验证GSE72642 GSE16385) [0250] b.巨噬细胞,静息型和免疫支持型(校准GSE43596/验证GSE40885) [0251] c.树突细胞,静息型和免疫支持型,2-状态模型(校准GSE18791/验证52081);分别 来自作为输入的3(校准GSE23371/验证GSE13762 GSE56017)和4(校准GSE23371/验证 GSE13762 GSE56017)条信号途径活性的静息型和免疫支持型和免疫抑制的3-状态模型 [0252] d.中性粒细胞:静息型、支持型(校准GSE22103/验证GSE28490) [0253] B.适应性免疫应答 [0254] a.CD4 T细胞:静息型、免疫支持型(校准:GSE36766/验证:GSE11292) [0255] b .CD4 Th1亚型,免疫支持型和CD4Th2亚型,免疫抑制(校准:GSE71566/验证: GSE32959) [0256] c.CD8 T细胞:静息型、免疫支持型、免疫抑制型(校准GSE26347/验证GSE72642) [0257] d.Treg细胞:静息型、免疫抑制型(校准GSE65010/验证GSE11292) [0258] e.B细胞:静息型、免疫支持型(校准GSE39411/验证GSE9119) [0259] f.T记忆,未致敏、记忆(校准GSE65010/验证GSE65010 GSE26495) [0260] 对于从GEO数据库获得的每个样品的所有Affymetrix数据集,根据相应文章作者 提供的基本事实或GEO中提供的注释列出免疫细胞的功能活性状态。随后,对每种免疫细胞 类型使用定义的校准组和验证组,对处于指定功能活性状态的不同细胞类型进行途径分析 (ER、AR、PI3K等)。 [0261] 不同免疫细胞类型的途径分析 [0262] 对每种免疫细胞类型的不同免疫细胞类型途径分析揭示了不同功能性免疫状态 即静息型、免疫支持型或免疫抑制型中活性信号转导途径的特定组合(图1至12)。 [0263] A.有助于先天免疫应答的免疫细胞 [0264] 静息型状态的中性粒细胞(图1)具有活性FOXO转录因子,指示非活性或低活性 PI3K途径、与免疫途径NFkB、JAK-STAT1/2(I型干扰素和II型干扰素)和JAK-STAT3的低活性 相关,并且Notch和Wnt途径均无活性。在支持型状态下,FOXO转录因子活性降低,指示PI3K 途径活性增加,免疫途径更具活性,Notch/Wnt也如此。 [0265] 单核细胞(图2)在FOXO、NFkB、JAK-STAT1/2II型干扰素以及Notch和JAK-STAT3途 径中显示与中性粒细胞类似的模式。 [0266] 在树突细胞中(图3至5),NFkB、JAK-STAT1/2(两种类型)和TGF-β在支持型状态下 更有活性,而NFkB活性在受抑制(致耐受性)状态下最低,并且FOXO转录因子活性介于静息 型和支持型状态之间的中间活性。 [0267] 在巨噬细胞中(图6),发现支持型状态的类似模式,也包括活性JAK-STAT3和Notch 34 CN 111587293 A 说 明 书 31/36 页 途径。 [0268] B.有助于适应性免疫应答的免疫细胞 [0269] 适应性免疫应答的细胞类型在功能和使用途径活性方面与先天免疫应答的细胞 类型有很大不同。支持型状态的CD4(图7)淋巴细胞显示低FOXO转录因子活性,指示PI3K途 径活性增加,以及免疫途径NFkB、JAK-STAT1/2、JAK-STAT3活性增加和TGF-β途径活性降低。 分别为支持型和抑制型的CD4 淋巴细胞亚型Th1和Th2(图8)可以基于FOXO转录因子活性 (在免疫支持型Th1中最低,指示更高的PI3K途径活性),和在Th1细胞中更高的NFkB、JAK- STAT1/2和JAK-STAT3以及TGF-β途径来区分。当活化时,Treg细胞(图9)变为免疫抑制型(抑 制型),然后清楚地显示增加的FOXO、NFkB、Notch、JAK-STAT1/2、JAK-STAT3和TGF-β活性谱。 [0270] 遗憾的是,对于CD8淋巴细胞(图10),仅有一个样品可用于支持型状态,然而观察 到的途径活性与基于免疫学知识所预期的一致,即降低的FOXO转录因子活性,指示增加的 PI3K活性(指示细胞增殖),增加的NFkB、JAK-STAT1/2和JAK-STAT3途径。对于在总体功能性 免疫应答预测模型中的使用,我们使用命名“非支持型”作为抑制型的替代物。 [0271] T记忆细胞(图11)在抗原刺激已经消失之后出现并且可以通过更具活性的FOXO转 录因子(活性较弱的PI3K途径活性和增殖)、更具活性的NFkB和更高的TGF-β途径活性与尚 未遭遇抗原的未致敏T细胞区分。B细胞(图12)产生抗体并且在支持型状态显示FOXO转录因 子活性降低,指示PI3K途径活性,以及增加的NFkB和JAK-STAT3活性。 [0272] 显然,虽然在适应性免疫系统细胞中,PI3K、NFkB和JAK-STAT3途径的活性通常指 示免疫支持型状态(除Treg之外),但是其他途径如TGF-β和Notch具有取决于特定细胞类型 的高度特异性功能作用。 [0273] 预测免疫细胞类型功能状态的计算模型的开发 [0274] 随后,使用校准数据集的途径结果作为校准模型的输入,为每种免疫细胞类型产 生多个计算模型(图1至12)。随后,每个模型被冻结并在相应的独立验证数据集上验证以测 试模型的准确性(图1至12)。使用在确定免疫细胞功能状态中具有已知作用(科学文献)的 信号转导途径的活性状态来创建该模型。 [0275] 基于不同数量的信号传导途径分析作为输入,描述了模型实例。所描述的每种免 疫细胞类型的信号传导途径组合通常不是途径模型的唯一可能组合。在示例性模型中使用 的途径的亚组/另一组合有时也可以起到预测相应免疫细胞类型的功能活性状态的作用 (在图4A和图5A以及图4B和图5B中显示)。一些类型的模型表现更好。 [0276] 如本文所述,创建用于分析个体免疫细胞类型的三种不同类型的模型,形心模型、 线性模型和贝叶斯模型。 [0277] 预测免疫系统状态的模型的开发 [0278] 开发了三种模型以从对至少两种不同免疫细胞类型测量的功能性免疫细胞活性 (本文也称为免疫细胞的功能状态)预测免疫应答的功能状态(本文也称为免疫系统状态)。 [0279] 免疫细胞不能对自身起作用并且它们一起协调免疫应答,原因是解释对多种免疫 细胞类型的测量提供了预测免疫应答状态的更好方法。最后,在开发和验证计算模型以区 分先天性和适应性免疫应答的每种免疫细胞类型的功能状态之后,开发了两种计算模型, 其使用免疫细胞类型特异性计算模型的功能活性结果,该计算模型提供每种分析的细胞类 型的功能免疫细胞活性分数作为输入值,以预测个体(健康或患病)中免疫应答的总体状 35 CN 111587293 A 说 明 书 32/36 页 态,即免疫应答是否处于静息非活性状态(静息型),或免疫系统是活性的(支持型)或抑制 的(抑制型),以及任何活性或抑制是否在先天性或适应性免疫系统中显现。 [0280] 在一种类型的免疫应答模型中,基于分别具有完全活跃的免疫应答和免疫抑制的 免疫应答的虚拟个体,定义了最高和最低免疫活化分数(图13A至13G)。建立计算公式,利用 该公式可以以百分比活性的形式计算免疫应答状态的分数。模型的每个输入变量被分配0、 1、2点(图13A)。所添加的点的总分数在19和6之间(图13B至13D)。将免疫应答活性计算为百 分比活化(图13E),并且对于具有降低的输入可观察值(是指免疫细胞活性分数)的模型。 [0281] 百分比免疫应答活性可以如下计算: [0282] 百分比免疫应答活性=[(累积点-6)/13]×100% [0283] 免疫静息型状态定义为10点。这可用于建立阈值,以区分活化的免疫应答(>10点) 和抑制的免疫应答(<10点)。计算10点静息型状态为77%免疫活化状态。因此,>77%的百分 比指示活性免疫应答;低于77%的百分比越来越指示免疫抑制的免疫应答。为了将该读数 改变为免疫活性对免疫抑制的定量分数,可以将该阈值重置为0。 [0284] 公式如下: [0285] %免疫应答活性-77=免疫活性状态,其中正数表示免疫应答是活性的,而负数表 示其被抑制。 [0286] 结合到前面的公式中给出: [0287] 百分比免疫活性={[(累积点-6)/13]×100%}-77。 [0288] 在并非所有输入值都可用的情况下(例如因为尚未对所有免疫细胞类型测量功能 活性状态),该模型仍可提供免疫应答活性分数,然而具有估计的不确定性。 [0289] 另一种免疫应答模型是贝叶斯模型,其将个体免疫细胞类型分析的分数解释为免 疫应答处于活性、静息或抑制状态的概率(图14A和14B)。 [0290] 另一种模型是线性模型。免疫应答活性计算如下: [0291] 高于10点的累积点越来越指示免疫应答不是非活性/抑制型的;低于10的累积点 越来越指示免疫应答处于抑制状态(图15)。 [0292] 线性模型的模型变体可用于特异性测量免疫应答的免疫抑制状态(图16A和16B)。 [0293] 每个模型还可以用于分别测量先天免疫应答和适应性免疫应答的活性。贝叶斯模 型方法将为这些不同类型的免疫应答固有地提供活性分数,这是计算总体免疫应答状态的 一部分。百分比和线性免疫应答计算模型可以很容易地分为两个独立的部分,分别用于先 天性和适应性免疫应答(图17A和图17B中的实例),也可以用于替代模型(图16A和16B中的 实例)。在贝叶斯模型中,这已经可以从所描述的模型中读出。 [0294] 对于所有模型,可以通过改变一或多个免疫细胞类型输入值(其通过基于途径分 析的功能性免疫活性分析获得)的权重来进一步提高预测的准确性。例如,预期处于抑制型 状态时的Treg细胞对于免疫抑制的免疫应答是高度特异性的;在百分比免疫活性模型和线 性模型中,可通过例如将“0”改为“-1”作为模型的输入来并入此知识;在贝叶斯模型中,可 以容易地调整节点参数以增加特异性(通过例如将0.9改为0.99;并降低0.1至0.001)。 [0295] 模型验证和结果 [0296] 图1-6显示先天免疫应答的细胞类型的结果。图7-12显示适应性免疫应答的细胞 类型的结果。途径活性结果(对于包括在相应计算模型中的信号转导途径)描述为log2几 36 CN 111587293 A 说 明 书 33/36 页 率;指示样品中免疫细胞的功能状态(静息型、支持型、抑制型、未致敏、记忆),右侧给出模 型提供的功能状态分数;OK表示正确的功能指定;错误表示不正确的功能指定。在图1B至 12B中,相邻的两个状态被由第一状态的平均线性值和第二状态的平均线性值的总平均值 决定的边界值分开。该边界值在下表中给出。 [0297] [0298] [0299] 为了免疫应答模型验证目的(图18),鉴定了不同的临床数据集,其中使用 Affymetrix微阵列分析每个样品的至少两种免疫细胞类型。对由不同数量的免疫细胞类型 组成的多个临床样品数据集进行验证,显示免疫应答模型的输入可以根据在各自样品中可 用的免疫细胞类型的数量而变化。 [0300] 例如,图18A和图18B显示使用数据集GSE72462测量免疫系统状态的结果。从3个健 康个体的外周血样品分离不同的免疫细胞类型(CD4 、CD8 和B-淋巴细胞、中性粒细胞、单 核细胞),并且使用本文描述的方法分析微阵列结果以使用形心模型评估各种免疫细胞类 型的功能(活性)状态。图18A的免疫细胞活性分析的形心模型结果也用作类型2(贝叶斯模 型免疫应答活性)免疫应答模型的输入。贝叶斯免疫应答模型计算结果显示,先天免疫细胞 类型、适应性免疫细胞类型以及总体免疫应答对于活性状态是正常/静息型状态的概率最 高,与健康个体所期望的免疫应答活性状态完全一致。对于三个重复的每一个,生成数据 集,其中状态不是100%特定静息型,而是被定义为概率性的。概率是从形心模型距离(如图 18A中所报告)中得到的,具有最高概率归因于具有最小距离的状态。用softmax方法确定概 率。结果总结于下表中。 [0301] 节点 状态 100%静息 重复1 重复2 重复3 适应性免疫 活性 0 0.02 0.01 0.03 适应性免疫 静息型 0.78 0.79 0.8 0.79 适应性免疫 抑制型 0.21 0.19 0.19 0.19 免疫应答 A)正常 0.52 0.4 0.41 0.4 37 CN 111587293 A 说 明 书 34/36 页 免疫应答 B)验证 0.02 0.19 0.2 0.19 免疫应答 C)被抑制 0.25 0.19 0.2 0.19 免疫应答 D)适应性 0 0.02 0.01 0.03 免疫应答 E)耗竭的 0.21 0.19 0.19 0.19 先天性免疫 活性 0.02 0.23 0.23 0.23 先天性免疫 静息型 0.58 0.45 0.46 0.45 先天性免疫 抑制型 0.4 0.32 0.32 0.31 [0302] 2:确定树突细胞的功能状态 [0303] 使 用来自 临 床 和临 床前研究 样品的 G E O 数 据集数 据库 ( h t t p s : / / www.ncbi.nlm.nih.gov/gds/)Affymetrix 2.0Plus数据,在该临床和临床前研究中,树突 免疫细胞在静息和各种活性及致耐受性状态下,用相关细胞因子刺激和不刺激进行了研 究,使用该途径模型分析了信号转导途径的活性。这使得能够鉴定在静息状态和活性或免 疫抑制型(致耐受性)状态下树突细胞类型的特征性途径活性谱以及定义了与暴露于激活 或免疫抑制细胞因子或其他因子相关的特征性免疫功能途径谱。 [0304] 微阵列数据的途径分析和每个样品的途径结果的计算解释使得能够在健康个体 中表征树突细胞的典型信号转导途径活性,表示为log2几率活性分数(参见上述途径模型 专利)。 [0305] 为两种情况开发了模型: [0306] (1)提供树突细胞活性状态相对静息状态的分数(称为2D模型); [0307] (2)提供树突细胞活性相对静息、相对致耐受状态的分数(称为3D模型)。 [0308] 对于这两种情况,开发了贝叶斯推理(a)和线性数学模型(b)以及形心计算模型作 为可以用于解释所测得的途径活性分数的模型的实例。 [0309] 使用来自公众可获得的包含Affymetrix U133 Plus2.0样品的GEO数据集的样品 校准模型,该样品具有分别关于树突细胞的2种功能活性状态(活性/支持型;非活性/静息 型)或3种功能活性状态概率(活性/支持型;非活性/静息型;免疫抑制型/致耐受性)的“基 本事实”。对于每个样品,给出每条途径的活性分数作为参数计算的输入。 [0310] 随后在含有Affymetrix U133 Plus2.0样品的独立公共GEO数据集上验证2-状态 和3-状态(本文也是指2D和3D)模型,该样品也分别具有关于树突细胞的2种功能活性状态 (活性/支持型;非活性/静息型)或3种功能活性状态概率(活性/支持型;非活性/静息型;免 疫抑制型/致耐受性)的“基本事实”。对于每个样品,给出每条途径的活性分数作为参数计 算的输入。 [0311] 对于贝叶斯模型,创建模型并手动设置CPT节点(针对2D模型的图20A至20D;针对 3D模型的图21A至21E)。对于2D模型:使用NFkB、JAK-STAT1/2和TGF-β途径的途径活性作为 参数节点的输入。对于3D模型:使用MAPK-AP-1、PI3K、NFkB、JAK-STAT1/2和TGF-β途径的途 径活性作为参数节点的输入。任选的额外标准可以是其他所测得的途径不区分树突细胞的 功能状态。 [0312] 对于线性计算模型,将所测途径的途径活性分数相加(在2D模型的情况下为3条途 径,在3D模型的情况下为5条途径),并且多个途径活性分数指示树突细胞的功能活性状态。 非活性/静息型具有低于0的分数,免疫抑制/致耐受性具有0-10的分数,免疫活化/支持型 38 CN 111587293 A 说 明 书 35/36 页 具有>10的分数(图22A和22B)。所选择的用于2D和3D模型的途径以及任选的附加标准与上 述用于贝叶斯模型的相同。 [0313] 对于形心模型,所测途径的途径活性分数基于在2D模型公式的情况下使用3条途 径的欧几里德距离的计算: [0314] [0315] [0316] 并且在3D模型公式的情况下使用5条途径的欧几里德距离的计算: [0317] [0318] [0319] [0320] 其中x、y和z表示3条途径,其中v、w、x、y和z表示5条途径,平均下标r、s和SP是指校 准数据的平均值,并且下标ri、si和SPI是指个体验证样品的值。最短距离定义了状态,在2 状态模型中分别为静息型或支持型、在3状态模型中分别为静息型、支持型或抑制型(图23A 和23B)。所选择的用于2D和3D模型的途径以及任选的附加标准与上述用于贝叶斯模型的相 同。 [0321] 骨髓树突细胞和单核细胞来源于共同祖细胞,在用作校准组的研究中 (GSE23371),通过向培养基中添加IL4和GMCSF使血液来源的单核细胞向树突细胞成熟,如 文献中所述和最常用的(de Vries等,J.Immunother 2002,25(5):429-438.)。在最近的出 版物中显示,与倾向于对T细胞发挥更抑制型作用的IL4-成熟的DC相比,在该成熟过程中 IL4被IL15取代可以导致具有提高的吸引效应淋巴细胞能力的成熟DC,如增强Treg和Th2细 胞类型产生的细胞因子的产生所显示(来源:数据集GSE79184;van Acker H .H .等, “Desirable cytolytic immune effector cell recruitment by interleukin- 15dendritic cells”,Oncotarget,Vol.8,No.8,2017,13652-13665页)。这解释了为什么所 描述的3D模型在“静息型”和致耐受性状态之间仅显示相对小的差异,这使得难以区分这两 种非活性状态。使用来自IL15成熟的DC的Affymetrix数据作为“静息”校准组将导致相反的 结果,即不能很好地区分活性/支持型状态和“静息”状态的模型。由于模型的最重要功能是 鉴定DC是否处于活性/支持型状态,相对于非活性状态,因此我们选择IL4成熟的DC数据作 为“静息”校准数据。在GSE79184数据集上使用含有来自IL4-和IL15-成熟的DC的数据的3D 模型显示IL5-成熟的DC被分类为轻微活化的(图24)。 [0322] 示例性验证结果,贝叶斯模型 [0323] 2D模型提供了树突细胞的活性/支持型状态相对于非活性/静息型状态的log2几 率标度的分数(图25A和25B)。Affymetrix 2.0Plus数据来自外周血衍生的分化的树突细 胞,其根据现有技术被诱导朝向活性/支持型状态或保持在非活性/静息状态,其中分析途 径活性和模型用于提供作为log2几率的免疫活性分数。在左侧描绘校准样品结果并在图例 中表示为“校准”。在数据集GSE18791上验证了2D贝叶斯模型并且准确预测了该数据/这些 数据集中样品的活性分数。 39 CN 111587293 A 说 明 书 36/36 页 [0324] 数据集GSE18791(图26)包含来自2个不同供体的人外周血单核细胞衍生的常规DC 的样品,该供体感染新城疫病毒(NDV)或用尿囊液(AF)作为对照。感染NDV用于建立体内树 突细胞激活的体外模型系统。在NDV感染后的多个时间点,如图中所示,测量细胞样品上的 信号转导途径活性,并且该分析显示在1小时后NFkB途径已经变得有活性,可能反映了抗原 加工机制;4小时后JAK-STAT1/2途径有活性,可能反映抗原呈递机制,以及10小时后完全活 化TGF-β途径,可能反映树突细胞中迁移机制的活化(图27)。(参考:Zaslavsky E .等, “Antiviral response dictated by choreographed cascade of transcription factors,Journal of Immunology,Vol.184,No.6,2010年3月,2908至2917页。第二个使用 的数据集GSE14000包含来自人外周血单核细胞衍生的DC的样品,通过向细胞中加入脂多糖 (LPS)被以另外方式激活(活性/支持功能状态),并且在两个时间点进行测量,其中4小时时 间点表示部分活化,而16小时时间点表示完全活化。(参考:Ceppi M .等,“Ribosomal protein mRNAs are translationally-regulated during human dendritic cells activation by LPS”,Immunome Research,2009年11月,5:5)。 [0325] 3D模型以log2几率标度提供树突细胞的活性/支持型状态相对非活性/静息型状 态相对免疫抑制/致耐受性状态的分数(图27A和27B)。Affymetrix2.0 Plus数据来自外周 血衍生的分化的树突细胞,其根据现有技术被诱导朝向活性/支持型或免疫抑制/致耐受性 状态或保持在非活性/静息型状态,其中分析途径活性和模型用于提供作为log2几率的免 疫活性分数。在左侧描绘校准样品结果并且指示为“校准”。3D贝叶斯模型在数据集 GSE18791上验证并准确预测这些数据集中样品的活性分数。 [0326] 示例性验证结果、线性模型 [0327] 线性模型在数据集GSE18791上对2D模型进行了验证,在数据集GSE13672和 GSE18791上对3D模型进行了验证,并正确预测了数据集中样品的活性分数(图22C和22D)。 [0328] 示例性验证结果,形心模型 [0329] 形心模型在数据集GSE18791上对2状态模型进行了验证,在数据集GSE13672和 GSE18791上对3状态模型进行了验证,并且正确预测了数据集中样品的活性分数(图23C和 图23D)。 40 CN 111587293 A 说 明 书 附 图 1/151 页 图1A 41 CN 111587293 A 说 明 书 附 图 2/151 页 图1A(续) 42 CN 111587293 A 说 明 书 附 图 3/151 页 图1B 43 CN 111587293 A 说 明 书 附 图 4/151 页 图1B(续) 44 CN 111587293 A 说 明 书 附 图 5/151 页 图1B(续) 45 CN 111587293 A 说 明 书 附 图 6/151 页 图2A 46 CN 111587293 A 说 明 书 附 图 7/151 页 图2A(续) 47 CN 111587293 A 说 明 书 附 图 8/151 页 图2B 48 CN 111587293 A 说 明 书 附 图 9/151 页 图2B(续) 49 CN 111587293 A 说 明 书 附 图 10/151 页 图2B(续) 50 CN 111587293 A 说 明 书 附 图 11/151 页 图3A 51 CN 111587293 A 说 明 书 附 图 12/151 页 图3A(续) 52 CN 111587293 A 说 明 书 附 图 13/151 页 图3B 53 CN 111587293 A 说 明 书 附 图 14/151 页 图3B(续) 54 CN 111587293 A 说 明 书 附 图 15/151 页 图3B(续) 55 CN 111587293 A 说 明 书 附 图 16/151 页 图4A 56 CN 111587293 A 说 明 书 附 图 17/151 页 图4A(续) 57 CN 111587293 A 说 明 书 附 图 18/151 页 图4B 58 CN 111587293 A 说 明 书 附 图 19/151 页 图4B(续) 59 CN 111587293 A 说 明 书 附 图 20/151 页 图4B(续) 60 CN 111587293 A 说 明 书 附 图 21/151 页 图5A 61 CN 111587293 A 说 明 书 附 图 22/151 页 图5A(续) 62 CN 111587293 A 说 明 书 附 图 23/151 页 图5B 63 CN 111587293 A 说 明 书 附 图 24/151 页 图5B(续) 64 CN 111587293 A 说 明 书 附 图 25/151 页 图5B(续) 65 CN 111587293 A 说 明 书 附 图 26/151 页 图6A 66 CN 111587293 A 说 明 书 附 图 27/151 页 图6A(续) 67 CN 111587293 A 说 明 书 附 图 28/151 页 图6B 68 CN 111587293 A 说 明 书 附 图 29/151 页 图6B(续) 69 CN 111587293 A 说 明 书 附 图 30/151 页 图6B(续) 70 CN 111587293 A 说 明 书 附 图 31/151 页 图7A 71 CN 111587293 A 说 明 书 附 图 32/151 页 图7A(续) 72 CN 111587293 A 说 明 书 附 图 33/151 页 图7A(续) 73 CN 111587293 A 说 明 书 附 图 34/151 页 图7B 74 CN 111587293 A 说 明 书 附 图 35/151 页 图7B(续) 75 CN 111587293 A 说 明 书 附 图 36/151 页 图7B(续) 76 CN 111587293 A 说 明 书 附 图 37/151 页 图7B(续) 77 CN 111587293 A 说 明 书 附 图 38/151 页 图8A 78 CN 111587293 A 说 明 书 附 图 39/151 页 图8A(续) 79 CN 111587293 A 说 明 书 附 图 40/151 页 图8B 80 CN 111587293 A 说 明 书 附 图 41/151 页 图8B(续) 81 CN 111587293 A 说 明 书 附 图 42/151 页 图8B(续) 82 CN 111587293 A 说 明 书 附 图 43/151 页 图9A 83 CN 111587293 A 说 明 书 附 图 44/151 页 图9A(续) 84 CN 111587293 A 说 明 书 附 图 45/151 页 图9B 85 CN 111587293 A 说 明 书 附 图 46/151 页 图9B(续) 86 CN 111587293 A 说 明 书 附 图 47/151 页 图9B(续) 87 CN 111587293 A 说 明 书 附 图 48/151 页 图10A 88 CN 111587293 A 说 明 书 附 图 49/151 页 图10A(续) 89 CN 111587293 A 说 明 书 附 图 50/151 页 图10A(续) 90 CN 111587293 A 说 明 书 附 图 51/151 页 图10B 91 CN 111587293 A 说 明 书 附 图 52/151 页 图10B(续) 92 CN 111587293 A 说 明 书 附 图 53/151 页 图10A(续) 93 CN 111587293 A 说 明 书 附 图 54/151 页 图10B(续) 94 CN 111587293 A 说 明 书 附 图 55/151 页 图11A 95 CN 111587293 A 说 明 书 附 图 56/151 页 图11A(续) 96 CN 111587293 A 说 明 书 附 图 57/151 页 图11A(续) 97 CN 111587293 A 说 明 书 附 图 58/151 页 图11B 98 CN 111587293 A 说 明 书 附 图 59/151 页 图11B(续) 99 CN 111587293 A 说 明 书 附 图 60/151 页 图11B(续) 100 CN 111587293 A 说 明 书 附 图 61/151 页 图11B(续) 101 CN 111587293 A 说 明 书 附 图 62/151 页 图12A 102 CN 111587293 A 说 明 书 附 图 63/151 页 图12A(续) 103 CN 111587293 A 说 明 书 附 图 64/151 页 图12B 104 CN 111587293 A 说 明 书 附 图 65/151 页 图12B(续) 105 CN 111587293 A 说 明 书 附 图 66/151 页 图12B(续) 106 CN 111587293 A 说 明 书 附 图 67/151 页 图13A 107 CN 111587293 A 说 明 书 附 图 68/151 页 图13B 108 CN 111587293 A 说 明 书 附 图 69/151 页 图13C 109 CN 111587293 A 说 明 书 附 图 70/151 页 图13D 110 CN 111587293 A 说 明 书 附 图 71/151 页 图13E 111 CN 111587293 A 说 明 书 附 图 72/151 页 图13F 112 CN 111587293 A 说 明 书 附 图 73/151 页 图13G 113 CN 111587293 A 说 明 书 附 图 74/151 页 图14A 114 CN 111587293 A 说 明 书 附 图 75/151 页 图14A(续) 115 CN 111587293 A 说 明 书 附 图 76/151 页 图14B 116 CN 111587293 A 说 明 书 附 图 77/151 页 图15A 117 CN 111587293 A 说 明 书 附 图 78/151 页 图15B 118 CN 111587293 A 说 明 书 附 图 79/151 页 图16A 119 CN 111587293 A 说 明 书 附 图 80/151 页 图16B 120 CN 111587293 A 说 明 书 附 图 81/151 页 图16C 121 CN 111587293 A 说 明 书 附 图 82/151 页 图17A 122 CN 111587293 A 说 明 书 附 图 83/151 页 图17B 123 CN 111587293 A 说 明 书 附 图 84/151 页 图18A 124 CN 111587293 A 说 明 书 附 图 85/151 页 图18A(续) 125 CN 111587293 A 说 明 书 附 图 86/151 页 图18A(续) 126 CN 111587293 A 说 明 书 附 图 87/151 页 图18A(续) 127 CN 111587293 A 说 明 书 附 图 88/151 页 图18A(续) 128 CN 111587293 A 说 明 书 附 图 89/151 页 图18B 129 CN 111587293 A 说 明 书 附 图 90/151 页 图18C 130 CN 111587293 A 说 明 书 附 图 91/151 页 图19 131 CN 111587293 A 说 明 书 附 图 92/151 页 图20A 132 CN 111587293 A 说 明 书 附 图 93/151 页 图20B 133 CN 111587293 A 说 明 书 附 图 94/151 页 图20C 134 CN 111587293 A 说 明 书 附 图 95/151 页 图20D 135 CN 111587293 A 说 明 书 附 图 96/151 页 图21A 136 CN 111587293 A 说 明 书 附 图 97/151 页 图21B 137 CN 111587293 A 说 明 书 附 图 98/151 页 图21C 138 CN 111587293 A 说 明 书 附 图 99/151 页 图21D 139 CN 111587293 A 说 明 书 附 图 100/151 页 图21D(续) 140 CN 111587293 A 说 明 书 附 图 101/151 页 图21E 141 CN 111587293 A 说 明 书 附 图 102/151 页 图21E(续) 142 CN 111587293 A 说 明 书 附 图 103/151 页 图21E(续) 143 CN 111587293 A 说 明 书 附 图 104/151 页 图22A 144 CN 111587293 A 说 明 书 附 图 105/151 页 图22B 145 CN 111587293 A 说 明 书 附 图 106/151 页 图22C 146 CN 111587293 A 说 明 书 附 图 107/151 页 图22D-I 147 CN 111587293 A 说 明 书 附 图 108/151 页 图22D-II 148 CN 111587293 A 说 明 书 附 图 109/151 页 图22D(续) 149 CN 111587293 A 说 明 书 附 图 110/151 页 图22E-I 150 CN 111587293 A 说 明 书 附 图 111/151 页 图22E-II 151 CN 111587293 A 说 明 书 附 图 112/151 页 图22E-III 152 CN 111587293 A 说 明 书 附 图 113/151 页 图22E-IV 153 CN 111587293 A 说 明 书 附 图 114/151 页 图22E-I(续) 154 CN 111587293 A 说 明 书 附 图 115/151 页 图22E-II(续) 155 CN 111587293 A 说 明 书 附 图 116/151 页 图23A 156 CN 111587293 A 说 明 书 附 图 117/151 页 图23B 157 CN 111587293 A 说 明 书 附 图 118/151 页 图23C 158 CN 111587293 A 说 明 书 附 图 119/151 页 图23D-I 159 CN 111587293 A 说 明 书 附 图 120/151 页 图23D-II 160 CN 111587293 A 说 明 书 附 图 121/151 页 图23D-III 161 CN 111587293 A 说 明 书 附 图 122/151 页 图23D-IV 162 CN 111587293 A 说 明 书 附 图 123/151 页 图23D-I(续) 163 CN 111587293 A 说 明 书 附 图 124/151 页 图23D-II(续) 164 CN 111587293 A 说 明 书 附 图 125/151 页 图23E-I 165 CN 111587293 A 说 明 书 附 图 126/151 页 图23E-II 166 CN 111587293 A 说 明 书 附 图 127/151 页 图23E-III 167 CN 111587293 A 说 明 书 附 图 128/151 页 图23E-IV 168 CN 111587293 A 说 明 书 附 图 129/151 页 图23E-I(续) 169 CN 111587293 A 说 明 书 附 图 130/151 页 图23E-II(续) 170 CN 111587293 A 说 明 书 附 图 131/151 页 图24 171 CN 111587293 A 说 明 书 附 图 132/151 页 图24(续) 172 CN 111587293 A 说 明 书 附 图 133/151 页 图25A 173 CN 111587293 A 说 明 书 附 图 134/151 页 图25A(续) 174 CN 111587293 A 说 明 书 附 图 135/151 页 图25B 175 CN 111587293 A 说 明 书 附 图 136/151 页 图25B(续) 176 CN 111587293 A 说 明 书 附 图 137/151 页 图26 177 CN 111587293 A 说 明 书 附 图 138/151 页 图27A 178 CN 111587293 A 说 明 书 附 图 139/151 页 图27A(续) 179 CN 111587293 A 说 明 书 附 图 140/151 页 图27B 180 CN 111587293 A 说 明 书 附 图 141/151 页 图27B(续) 181 CN 111587293 A 说 明 书 附 图 142/151 页 图27B(续) 182 CN 111587293 A 说 明 书 附 图 143/151 页 图27B(续) 183 CN 111587293 A 说 明 书 附 图 144/151 页 图27B(续) 184 CN 111587293 A 说 明 书 附 图 145/151 页 图27B(续) 185 CN 111587293 A 说 明 书 附 图 146/151 页 图27C 186 CN 111587293 A 说 明 书 附 图 147/151 页 图27C(续) 187 CN 111587293 A 说 明 书 附 图 148/151 页 图27C(续) 188 CN 111587293 A 说 明 书 附 图 149/151 页 图27C(续) 189 CN 111587293 A 说 明 书 附 图 150/151 页 图27C(续) 190 CN 111587293 A 说 明 书 附 图 151/151 页 图27C(续) 191