技术摘要:
本发明涉及一种用于生物样本中细菌定量检测的微流控芯片,包括用于加入所述的生物样本的加样区、与所述的加样区相连通且设置有第一滤膜的第一过滤区、与所述的第一过滤区相连通且设置有第二滤膜的第二过滤区、与所述的第二过滤区相连通的检测区、与所述的第二过滤区相 全部
背景技术:
传统检测生物样本中细菌的方法存在步骤繁琐、检测时间长、需要专业人员操作 等问题,难以满足对添加物进行现场、快速、微量化、便携化的检测需要。微流控芯片以在微 米尺度空间对流体进行操控为主要特征,芯片系统内可集成样品生化反应、分离、检测等基 本操作单元,由微通道形成网络,以可控流体贯穿整个系统,从而实现常规实验室的各种功 能。 将微流控芯片技术与病原微生物检测技术结合起来,开发可用于生物样本中细菌 快速定量检测的微流控芯片,为快速确诊病原微生物提供一种简单、快速、有效的解决方 案,对于疾病的治疗和预后具有重要意义。
技术实现要素:
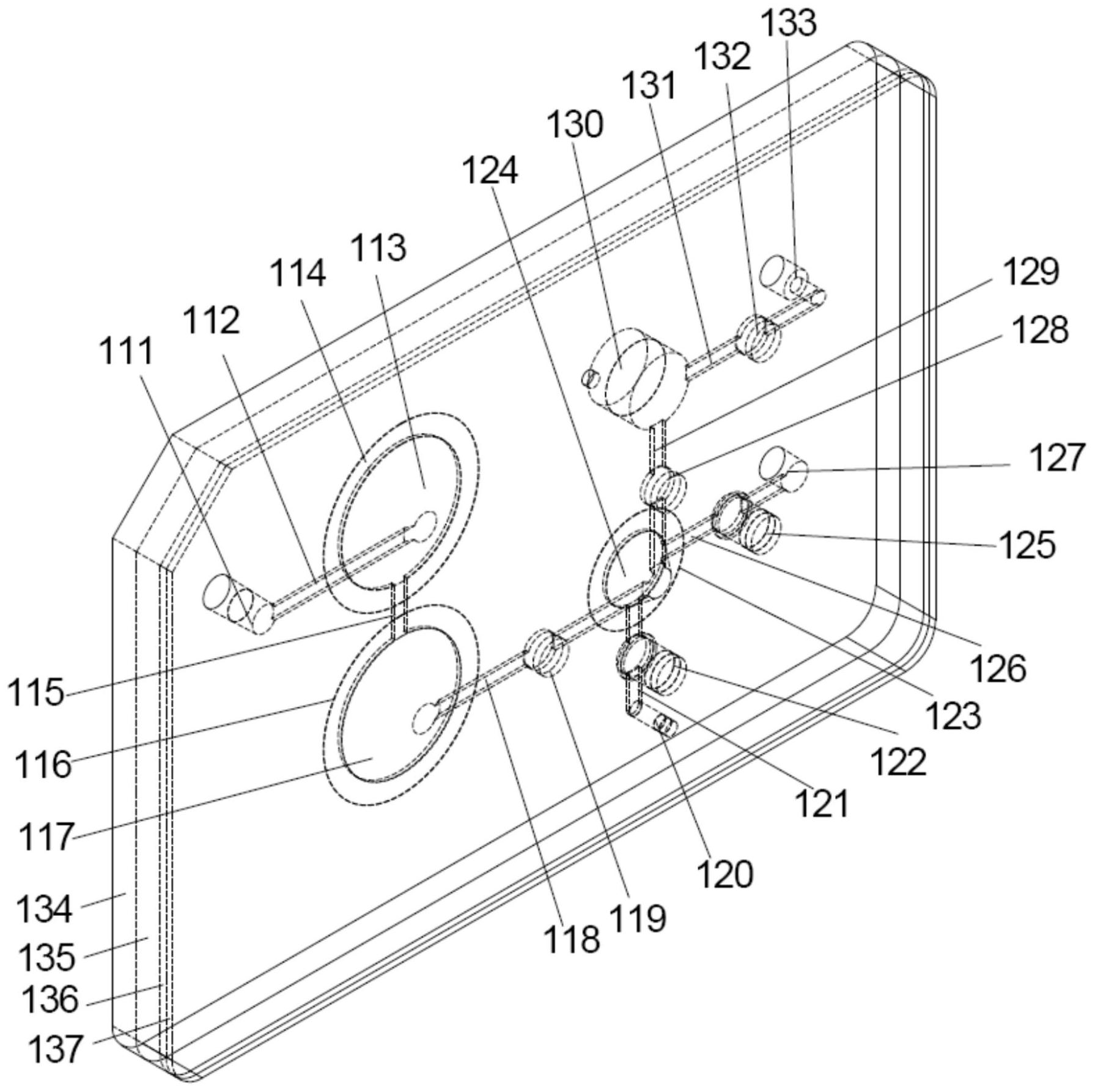
本发明的目的是提供一种试剂消耗量低、分析速度快、操作过程简单、便于集成 化、生物样本在芯片上的流动可控,特别适合生物样本中细菌快速定量检测的的微流控芯 片。 为达到上述目的,本发明采用的技术方案是: 本发明一方面提供一种用于生物样本中细菌定量检测的微流控芯片,其包括用于 加入所述的生物样本的加样区、与所述的加样区相连通且设置有第一滤膜的第一过滤区、 与所述的第一过滤区相连通且设置有第二滤膜的第二过滤区、与所述的第二过滤区相连通 的检测区、与所述的第二过滤区相连通且用于加入用于将所述的细菌自所述的第二滤膜上 洗脱下来的试剂的第一试剂区、与所述的第二过滤区和/或所述的检测区相连通的第二试 剂区;其中,所述的第一滤膜的孔径设置为允许细菌通过且能够截留体积大于细菌的生物 样本中的杂质,所述的第二滤膜的孔径设置为能够截留所述的细菌。 优选地,所述的第一滤膜的孔径为1~100μm,优选为1~50μm,更优选为1~10μm; 所述的第二滤膜的孔径为0.01~1μm,优选为0.01~0.5μm,更优选为0.1~0.3μm。使用第一 滤膜对生物样本进行粗滤,阻挡生物样本中体积大于细菌的细胞以及结晶体等杂质进入流 道,防止流道堵塞,使用第二滤膜对生物样本进行精滤,将生物样本中的细菌截留在第二滤 膜上,从而使得细菌可以在检测区富集,保证检测结果的准确度。 优选地,所述的第一过滤区的数量为两个及以上,且两个及以上的第一过滤区串 联设置,每个所述的第一过滤区设置有所述的第一滤膜;或者,所述的第一滤膜为沿着所述 的生物样本经过所述的第一过滤区的流向设置在一个所述的第一过滤区中的两个及以上, 两个及以上的所述的第一滤膜相互平行设置。设置两个及以上的第一滤膜,对生物样本进 行两次粗滤,尽可能多的截留生物样本中体积大于细菌的杂质,进一步有效防止流道堵塞 并提高第二滤膜上截留的细菌的纯度,避免第二滤膜上杂质过多而影响检测结果的准确 6 CN 111569959 A 说 明 书 2/12 页 性。 进一步优选地,两个及两个以上的所述的第一过滤区中的第一滤膜的孔径或者一 个所述的第一过滤区中的两个及以上的所述的第一滤膜的孔径不同,且位于所述的生物样 本流向的下游的所述的第一滤膜的孔径小于位于所述的生物样本流向的上游的所述的第 一滤膜的孔径。 由于生物样本,例如尿液的成分复杂,细胞、结晶体等杂质较多,并且尿液的粘度 相对于水来说更大,因此,采用微流控芯片检测尿液等生物样本时,容易发生堵塞等问题, 而本发明通过设置含有第一滤膜的第一过滤区,很好的避免了流道的堵塞,进一步地,本发 明通过设置两个第一滤膜,可以进一步提高粗滤的效果且更好的避免流道堵塞。 进一步优选地,位于所述的生物样本流向的上游的所述的第一滤膜的孔径为2~ 100μm;位于所述的生物样本流向的下游的所述的第一滤膜的孔径为1~2μm,从而使得生物 样本中的体积较大的杂质经过第一个孔径较大的第一滤膜先去除,体积较小的杂质在经过 孔径较小的第二滤膜去除,从而一方面可以进一步提高粗滤的效果,另一方面也能够更好 的避免流道被堵塞。 优选地,所述的第一过滤区的内径与所述的第二过滤区的内径的比值为1.5~ 2.5:1,从而可以更好的实现细菌的富集,并且可以节约空间,从而使得芯片的体积可以缩 小,进而降低芯片的成本。 优选地,所述的第二过滤区与所述的检测区重合;或者,所述的第二过滤区与所述 的检测区分离设置。检测区为加入缓冲液、反应液后用于检测溶液中化学发光强度的腔室。 如果将第二过滤区和检测区重合设置,可以减少部分流道和检测池的设置,降低芯片内部 结构复杂程度,但检测结果会收到滤膜等的干扰。如果将第二过滤区和检测区分开设置,则 可以避免检测时,由于第二过滤区存在滤膜等其他杂物导致的背景干扰,提高检测的准确 性,并且,由于分开设置,可以使得芯片做得较薄,从而降低成本。 优选地,所述的微流控芯片的厚度为8~12mm,所述的微流控芯片上的流道的内径 为1~2mm。 优选地,所述的加样区与所述的第一过滤区重合;或者,所述的加样区与所述的第 一过滤区分离设置。 优选地,所述的微流控芯片还包括与所述的第二过滤区和所述的检测区相连通的 第三试剂区。通过第三试剂区的设置,可将清洗液、缓冲液或者反应液分开储存。 根据一种实施方式,所述的试剂区为加样口,该种实施方式下,试剂需要通过加样 口加入。 根据另一种实施方式,所述的试剂区包括储存有试剂的试剂仓,从而使得试剂无 需现配现用,只需在需要加入该试剂时,将试剂仓中预先储存的试剂加入相应的腔室即可, 使用更为方便。 本发明中试剂仓为预先在芯片上储存测试过程所需试剂的区域,如清洗液、缓冲 液以及反应液等。 优选地,所述的微流控芯片还包括用于加样或加试剂的注射器,从而使得芯片可 以和注射器成套使用,而无需使用者额外配注射器。 优选地,所述的微流控芯片还包括与所述的第二过滤区和/或所述的检测区相连 7 CN 111569959 A 说 明 书 3/12 页 通的废液区。 进一步优选地,所述的废液区为出样口,或者,所述的废液区包括用于储存废液的 废液仓、用于将所述的废液仓与外界连通的通气孔。 优选地,所述的微流控芯片包括层叠设置的至少一层硬膜层和至少一层软膜层。 本发明中,硬膜层使用的材质为不与生物样本及试剂发生反应的材料即可,优选 采用亚克力(PMMA)或聚苯乙烯(PA)等;软膜层使用的材质为不与生物样本及试剂发生反应 且可以发生形变的材质即可,优选采用橡胶或硅胶。 根据一种实施方式,所述的微流控芯片包括依次层叠设置且通过粘合剂固定连接 的第一硬膜层、第二硬膜层、第一软膜层和第二软膜层;所述的第一硬膜层、所述的第二硬 膜层的厚度独立地为3~5mm,所述的第一软膜层、所述的第二软膜层的厚度独立地为0.5~ 1.5mm;此种方式下,微流控芯片无法重复使用。 根据另一种实施方式,所述的微流控芯片包括依次层叠设置且通过连接件固定连 接的第一硬膜层、第一软膜层、第二硬膜层、第二软膜层和第三硬膜层;所述的第一硬膜层、 所述的第三硬膜层的厚度独立地为1~3mm,所述的第二硬膜层的厚度为2~4mm,所述的第 一软膜层、所述的第二软膜层的厚度独立地为0.5~1.5mm;从而在微流控芯片使用过后,可 以将各层拆解清洗后,重新组装成微流控芯片,从而达到重复利用的目的,进而可以节约成 本。 进一步优选地,所述的加样区、所述的第一过滤区、所述的第二过滤区、所述的检 测区、所述的第一试剂区、所述的第二试剂区、以及连通各区的流道开设在所述的硬膜层 上,所述的流道上设置有能够控制所述的流道打开和关闭的挤压阀。 根据一种具体且优选实施方式,所述的流道包括分别与所述的加样区和第一个所 述的第一过滤区的底部相连通的第一流道、分别与第一个所述的第一过滤区和第二个所述 的第一过滤区的顶部相连通的第二流道、分别与第二个所述的第一过滤区和所述的第二过 滤区的底部相连通的第三流道、分别与所述的第二过滤区和所述的检测区的底部相连通的 第四流道、分别与所述的第一试剂区的底部和所述的第二过滤区的顶部相连通的第五流 道、分别与所述的第二试剂区和所述的检测区的底部相连通的第六流道、分别与所述的第 二过滤区的顶部和废液区的顶部相连通的第七流道,所述的废液区开设在所述的第二硬膜 层、所述的第一软膜层和所述的第二软膜层上。 根据一种具体且优选的实施方式,所述的微流控芯片包括依次层叠设置且通过连 接件固定连接的第一硬膜层、第一软膜层、第二硬膜层、第二软膜层和第三硬膜层;所述的 第一硬膜层、所述的第三硬膜层的厚度独立地为1~3mm,所述的第二硬膜层的厚度为2~ 4mm,所述的第一软膜层、所述的第二软膜层的厚度独立地为0.5~1.5mm。 优选地,当所述的微流控芯片不加样或者不添加试剂时,所述的第一软膜层和所 述的第二软膜层分别挡设在流道上使所述的流道关闭;当所述的微流控芯片加样或者添加 试剂时,所述的第一软膜层和所述的第二软膜层在压力的作用下发生形变使所述的流道打 开。控制流道在芯片常态及使用后均保持关闭状态,可以防止试剂或反应后的反应液挥发 到空气中,并且可以保证芯片内部处于封闭的环境中,从而可以保证芯片不易被污染。 进一步优选地,所述的加样区为开设在所述的第一硬膜层上的第一通孔,所述的 第一过滤区为开设在所述的第二硬膜层上的第二通孔,所述的第一通孔位于所述的第二通 8 CN 111569959 A 说 明 书 4/12 页 孔的上方且所述的第一通孔的直径小于所述的第二通孔的直径,位于所述的第一通孔和所 述的第二通孔之间的所述的第一软膜层上开设有多个第三通孔,所述的第三通孔与所述的 第一通孔错开设置;所述的流道包括开设在所述的第二硬膜层上和/或所述的第三硬膜层 上且一端与所述的第一过滤区的底部相连通的第一流道、开设在所述的第二硬膜层上且下 端与所述的第一流道的另一端相连通的第二流道、开设在所述的第一硬膜层和/或所述的 第二硬膜层上且一端与所述的第二流道的上端相连通的第三流道,所述的第二过滤区为开 设在所述的第二硬膜层上的第四通孔,所述的第三流道的另一端与所述的第四通孔的顶部 连通,所述的流道还包括开设在所述的第二硬膜层和/或所述的第三硬膜层上且一端与所 述的第四通孔的底部相连通的第四流道、开设在所述的第二硬膜层上且下端与所述的第四 流道的另一端相连通的第五流道,所述的微流控芯片还包括废液区,所述的废液区为开设 在所述的第一硬膜层上的第五通孔,所述的第五通孔与所述的第五流道相连通,位于所述 的第五通孔和所述的第五流道之间的第一软膜层上开设有多个第六通孔,所述的第六通孔 与所述的第五流道错开设置;所述的流道还包括开设在所述的第二硬膜层上且上端与所述 的第一试剂区相连通的第六流道、开设在所述的第二硬膜层和/或所述的第三硬膜层上且 一端与所述的第六流道的下端相连通的第七流道,所述的第七流道的另一端与所述的第四 通孔的底部相连通;所述的流道还包括开设在所述的第二硬膜层上且上端与所述的第二试 剂区相连通的第八流道、开设在所述的第二硬膜层上且一端与所述的第八流道的下端相连 通的第九流道、开设在所述的第三硬膜层上且一端与所述的第九流道的另一端相连通的第 十流道、开设在所述的第二硬膜层上且一端与所述的第十流道的另一端相连通的第十一流 道,所述的第十一流道的另一端与所述的第四通孔的底部相连通,所述的微流控芯片还包 括开设在所述的第二硬膜层上且用于储存试剂的第三试剂区,当所述的第二试剂区不添加 试剂时,所述的第二软膜层部分位于所述的第三试剂区和所述的第十流道之间阻止所述的 第三试剂区的试剂进入所述的第十流道,当所述的第二试剂区添加试剂时,所述的第二软 膜层发生形变使所述的第九流道、所述的第十流道、所述的第十一流道以及所述的第三试 剂区相连通。 更进一步优选地,所述的第一试剂区为开设在所述的第二硬膜层上的第七通孔、 储存在所述的第七通孔内的第一试剂、与所述的第七通孔相滑动连接的第一活塞;所述的 第二试剂区为开设在所述的第二硬膜层上的第八通孔、储存在所述的第八通孔内的第二试 剂、与所述的第八通孔相滑动连接的第二活塞。 本发明另一方面提供一种采用微流控芯片定量检测生物样本中细菌含量的方法, 包括如下步骤: (1)将所述的生物样本自所述的微流控芯片的加样区加入,并使所述的生物样本 流过第一过滤区以除去所述的生物样本中的杂质,然后再流过第二过滤区以截留所述的生 物样本中的细菌; (2)使试剂与所述的细菌反应并产生检测信号。 优选地,步骤(2)的具体步骤为: (a)采用清洗液或缓冲液流过所述的第二过滤区并使所述的第二过滤区中截留的 细菌随同所述的清洗液或缓冲液一同流入检测区; (b)若步骤(a)采用的是清洗液,则向所述的检测区加入缓冲液和反应液;若步骤 9 CN 111569959 A 说 明 书 5/12 页 (a)采用的是缓冲液,则向所述的检测区加入反应液;经孵育后进行化学发光信号的检测。 优选地,所述的方法还包括位于步骤(1)和步骤(2)之间的清洗步骤,所述的清洗 步骤具体为:采用清洗液依次流经所述的第一过滤区和所述的第二过滤区,从而可以使流 道或者第一过滤区残留的细菌更好的被第二过滤区富集,以及第二过滤区上残留的杂质被 更好的去除,进而进一步提高检测的准确性。 优选地,所述的生物样本为尿液。 优选地,所述的清洗液为PBS缓冲液、MES缓冲液、LB培养基、牛肉膏蛋白胨培养基 中的一种或多种。 优选地,所述的缓冲液为具有可以表达荧光蛋白的基因的噬菌体溶液,将特定基 因导入噬菌体中的方法为本领域的常规方法,其中特定基因可以表达特定的荧光蛋白,与 特定的发光底物反应,从而实现催化反应液发光;例如,lux基因会表达lux蛋白,催化癸醛 发生氧化还原反应,进而产生光信号;而nanoluc基因则与底物Furimazine反应发光。对于 噬菌体的选择,根据所需检测的细菌种类进行确定,例如,K1F噬菌体专一寄宿大肠杆菌,因 此,需要检测大肠杆菌时,采用K1F噬菌体;而Felix O1噬菌体专一寄宿沙门氏菌,因而可以 用于检测沙门氏菌。 优选地,所述的反应液为发光底物与所述的清洗液的混合物。 本发明中,所述的噬菌体包括K1F噬菌体、Felix O1噬菌体等,具体的噬菌体根据 所需检测的细菌进行确定;所述的荧光蛋白包括Lux蛋白、GFP蛋白、NanoLuc蛋白等;所述的 发光底物包括癸醛、芳香醛等醛类、咪唑并吡嗪酮类(如Furimazine)等。 进一步优选地,所述的反应液中,所述的发光底物和所述的清洗液的体积比为1:1 ~50。 优选地,所述的生物样本的加入量为8~15mL,所述的缓冲液的加入量为10~200μ L,所述的反应液的加入量为60~2000μL。 优选地,所述的缓冲液和所述的细菌的孵育时间为10~60min。 使用本发明的微流控芯片对生物样本中的细菌进行定量检测的流程见图15至图 22,其中,图15至图18是采用清洗液流过所述的第二过滤区并使所述的第二过滤区中截留 的细菌随同所述的清洗液一同流入检测区的方法对应的流程图;图19至图22是采用缓冲液 流过所述的第二过滤区并使所述的第二过滤区中截留的细菌随同所述的缓冲液一同流入 检测区的方法对应的流程图。其中,图15和图19为进样流程,在加样区加入生物样本后,驱 动生物样本依次流经第一过滤区、第二过滤区后,流入废液区,第一过滤区会截留样本中尺 寸较大的细胞、结晶等物质,第二过滤区将生物样本中的细菌截留、富集。图16和图20为清 洗流程,清洗液依次流经第一过滤区、第二过滤区后,流入废液区。图17和图21为冲洗和/或 孵育流程,其中,图17采用清洗液将第二过滤区的第二滤膜上截留的细菌冲洗至检测区,此 时,需要将缓冲液和反应液再加入检测区,流程见图18;图21是采用缓冲液将第二过滤区的 第二滤膜上截留的细菌冲洗至检测区,此时,只需要将反应液再加入检测区,流程见图22。 本发明中可以通过正压、负压或者挤压阀等方式驱动样本和试剂通过流道。 由于上述技术方案运用,本发明与现有技术相比具有下列优点: 本发明的微流控芯片,试剂消耗量低、分析速度快,同时还具有操作过程简单、便 于集成化等优点,生物样本在芯片上的流动可控,特别适合于病原微生物的快速检测,且可 10 CN 111569959 A 说 明 书 6/12 页 以同时检测多种病原微生物。 附图说明 附图1为本发明的实施例1的微流控芯片的立体透视图; 附图2为本发明的实施例1的微流控芯片的仰视图; 附图3为本发明的实施例1的微流控芯片沿附图2中A-A的剖面图; 附图4为本发明的实施例1的微流控芯片沿附图2中B-B的剖面图; 附图5为本发明的实施例1的微流控芯片沿附图2中C-C的剖面图; 附图6为本发明的实施例1的微流控芯片沿附图2中D-D的剖面图; 附图7为本发明的实施例2的微流控芯片的结构示意图; 附图8为本发明的实施例3的微流控芯片的立体透视图; 附图9为本发明的实施例3的微流控芯片的俯视图; 附图10为本发明的实施例3的微流控芯片的仰视图; 附图11为本发明的实施例3的微流控芯片的主视图; 附图12为本发明的实施例3的微流控芯片的后视图; 附图13为本发明的实施例3的微流控芯片的右视图; 附图14为本发明的实施例3的微流控芯片的左视图; 附图15为一种实施方式的微流控芯片定量检测细菌含量时的进样流程图; 附图16为一种实施方式的微流控芯片定量检测细菌含量时的清洗流程图; 附图17为一种实施方式的微流控芯片定量检测细菌含量时使用清洗液的洗脱流 程图; 附图18为一种实施方式的微流控芯片定量检测细菌含量时的反应流程图; 附图19为另一种实施方式的微流控芯片定量检测细菌含量时的进样流程图; 附图20为另一种实施方式的微流控芯片定量检测细菌含量时的清洗流程图; 附图21为另一种实施方式的微流控芯片定量检测细菌含量时使用缓冲液的洗脱 流程图; 附图22为另一种实施方式的微流控芯片定量检测细菌含量时的反应流程图。












