技术摘要:
本发明公开了一种羧酸类化合物、其制备方法及应用。本发明羧酸类化合物在应用于金属离子的萃取分离时,分离系数高,反萃酸度低,负载率高,反萃率高。本发明羧酸类化合物作为萃取剂稳定性高、水溶性低,使得萃取工艺稳定,可以减少环境污染、降低成本。本发明羧酸类化 全部
背景技术:
近年来,随着电动汽车的快速发展和推广,锂离子电池的需求规模也不断扩大。镍 钴锰三元正极材料循环性能好、结构稳定、性价比高,是新型锂离子电池正极材料,而三元 正极材料前驱体产品的主要原料为镍盐、钴盐、锰盐。 钴多数与镍相伴而生,在矿物中大多同时出现,如在镍红土矿中。在很多行业会产 生含镍、钴等有价金属的废渣,例如废旧动力电池材料、含镍钴废渣、废催化剂等,这些废渣 中多数还同时含有较高的锰,具有很高的回收价值,可以将它们进行回收用于制备镍钴锰 三元前驱体。 溶剂萃取技术是从溶液中分离提取各种金属的有效技术,它具有分离效率高、工 艺和设备简单、操作连续化、易于实现自动控制等优点,一直以来被众多研究者持续关注并 不断发展。随着环境保护和资源循环利用的迫切性,对萃取体系的能耗、酸耗、排污和产能 等也提出了更高的要求,因此,有必要提高萃取剂的萃取效率、分离效果和溶解性等性能以 适应环境和经济要求。 常用的阳离子交换萃取剂如酸性磷酸类萃取剂P204、P507、C272、中性络合萃取剂 TBP、螯合萃取剂LiX84和羧酸类萃取剂Versatic10、Versatic911等,因萃取分离效果好已 被广泛应用于金属元素分离与提纯。专利CN109449523A公开了一种废旧锂离子电池综合回 收方法,其先调节料液pH=4.2~4.5,采用P204对料液进行萃取,得P204萃余液和负载有机 相,采用硫酸反萃负载有机相得硫酸锰;调节所述P204萃余液pH=4.5~5,采用C272对所述 P204萃余液进行萃取,得C272萃余液和负载有机相,采用硫酸对所述C272负载有机相进行 反萃得硫酸钴溶液;调整C272萃余液pH=5~5.5,采用P507对该萃余液进行萃取Ni,采用硫 酸反萃P507负载有机相得硫酸镍溶液。但这些萃取剂在分离过程中也存在明显的缺点: P507/P204用于镍钴的分离,但在锂离子电池正极材料回收方面,不能同步提取镍钴锰,分 别回收镍钴锰工艺成本高,且反萃酸度高,污染严重;C272在萃取镍元素前优先萃取钙镁, 操作工序复杂,除杂成本高;Versatic10萃取剂在水相中的溶解较大,易造成工艺不稳定和 环境污染。
技术实现要素:
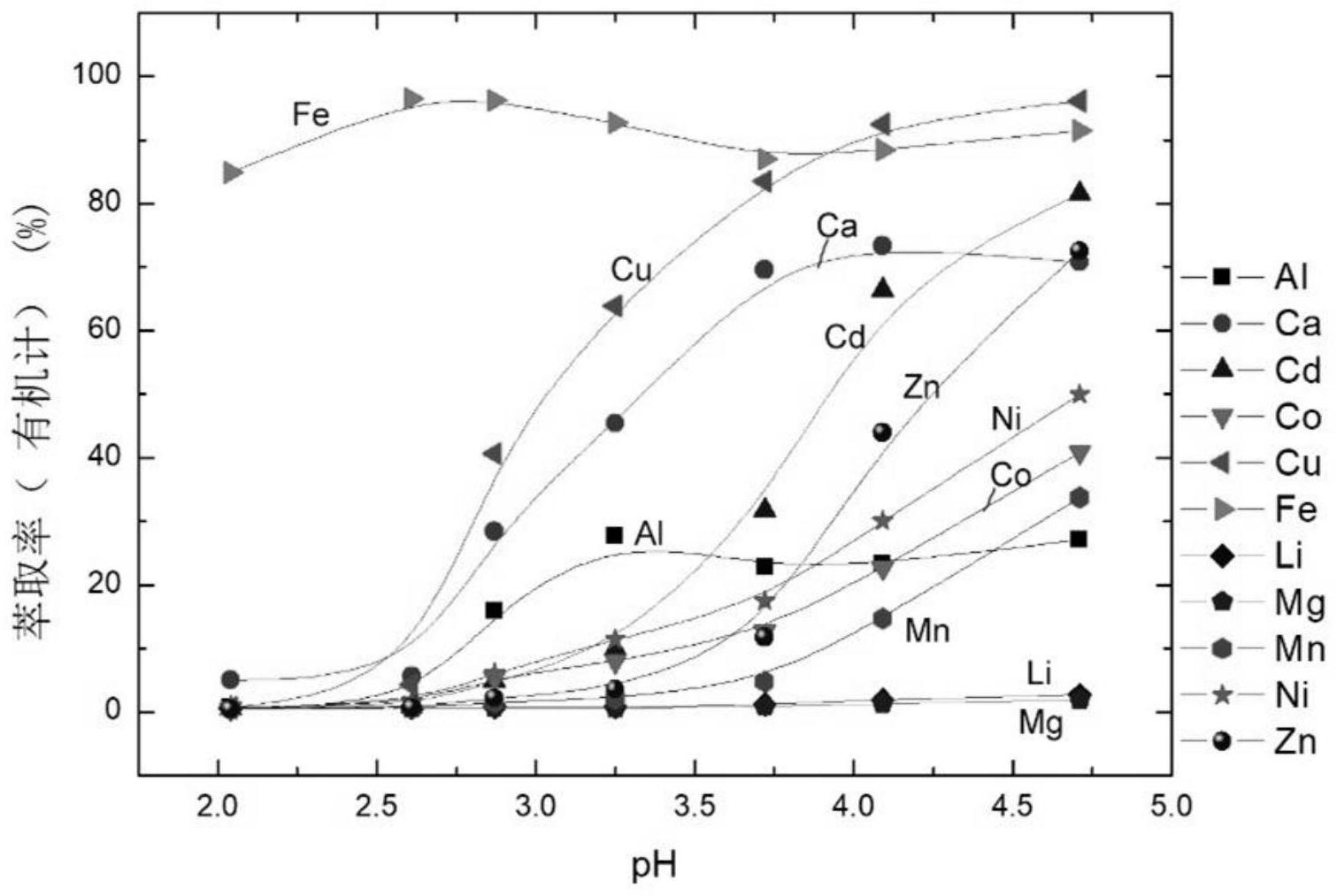
针对现有技术的不足,本发明提供一种羧酸类化合物、其制备方法及应用。所述羧 酸类化合物用作萃取剂,对离子(尤其是镍钴锰离子)具有较好的选择性,反萃酸度低,且具 有水溶性低、稳定性高、成本低等优点。 本发明通过以下技术方案解决上述技术问题。 本发明提供了一种如式I所示的羧酸类化合物或其盐: 6 CN 111592459 A 说 明 书 2/13 页 其中,R1和R2独立地为C3~C12直链或支链烷基。 其中,较佳地,R1为C4~C9直链或支链烷基;更佳地,R1为C4~C9直链烷基,例如正丁 基、正戊基、正己基或正辛基。 其中,较佳地,R2为C3~C10直链或支链烷基;更佳地,R2为C6~C8直链或支链烷基; 例如正己基、正辛基或异辛基(例如 )。 其中,较佳地,R1和R2的碳数总和n为10~20,例如n为12、14或16。 其中,较佳地,所述如式I所示的羧酸类化合物选自如下任一化合物: 其中,所述如式I所示的羧酸类化合物的盐一般是通过将如式I所示的羧酸类化合 物与碱进行反应制备得到,例如将所述如式I所示的羧酸类化合物与碱以摩尔比为1:1的比 例,进行反应制备得到。所述碱可为本领域常规的碱,例如碱金属氢氧化物或氨水,又如氢 氧化钠、氢氧化钾或氨水,由此所述羧酸类化合物的盐可为钠盐、钾盐或铵盐。 其中,所述如式I所示的羧酸类化合物的盐的制备方法的条件可为本领域常规的 酸碱成盐反应的常规条件。 其中,所述如式I所示的羧酸类化合物可从自然界物中提取或通过常规方法合成, 用于萃取时萃取剂可为所述如式I所示的羧酸类化合物中的一种或其混合(例如两种以 上)。 本发明还提供了所述如式I所示的羧酸类化合物的制备方法,其包括:溶剂中,在 碱的作用下,将如式II所示的化合物与如式III所示的化合物进行反应,即可; 7 CN 111592459 A 说 明 书 3/13 页 其中,X为卤素,R1和R2的定义如前所述。 所述制备方法中,较佳地,所述卤素为氟、氯、溴或碘,例如氯或溴,再例如溴。 所述制备方法中,所述溶剂可为本领域此类反应常用的溶剂,例如醚类溶剂,所述 醚类溶剂例如为四氢呋喃。 所述制备方法中,所述溶剂的用量可为本领域此类反应的常规用量,以不影响反 应的进行即可。例如,所述溶剂与所述如式III所示的化合物的体积质量比的用量范围为1 ~10mL/g,例如5.3、6.25、7.0、7.1或7.7mL/g。 所述制备方法中,所述碱可为本领域此类反应常用的碱,例如碱金属或者碱金属 氢化物,例如钠或氢化钠。 所述制备方法中,所述碱的用量可为本领域此类反应的常规用量,例如,所述碱与 所述如式II所示的化合物的摩尔比为(1~1.5):1,例如1.1:1、1.2:1或1.35:1。 所述制备方法中,所述如式II所示的化合物与所述如式III所示的化合物的摩尔 比可为本领域此类反应的常规比例,优选为1:(1~1.5),例如1:1.1或1:1.2。 所述制备方法中,所述反应的温度可为本领域此类反应中常规的温度,本发明中 较佳地为60~70℃。 所述制备方法中,所述反应的进程可采用本领域中的常规监测方法(例如TLC、 HPLC或NMR)进行检测,一般以所述的如式II所示的化合物消失或不再反应时作为反应终 点。所述的反应的时间可为6~12小时,例如10h。 本发明还提供了所述如式I所示的羧酸类化合物或其盐作为萃取剂的应用。 所述应用中,所述萃取剂可为所述如式I所示的羧酸类化合物中的一种或其混合 (例如两种以上),例如选自如下化合物中的任意一种或其混合(例如两种以上): 所述应用中,所述如式I所示的羧酸类化合物或其盐作为萃取剂用于萃取分离金 属离子。较佳地,所述金属离子为Ni2 、Co2 和Mn2 中的一种或其混合(例如两种以上),所述 8 CN 111592459 A 说 明 书 4/13 页 金属离子还可包含例如Fe3 、Al3 、Cu2 、Zn2 、Cd2 和Ca2 中的一种或其混合(例如两种以上), 所述金属离子还可进一步包含例如Mg2 、Li 等其它离子。例如,所述金属离子为“Ni2 、Co2 和Mn2 中至少一种”与“Fe3 、Al3 、Cu2 、Zn2 、Cd2 、Ca2 、Mg2 和Li 中至少一种”的混合。再例 如,所述金属离子为Ni2 、Co2 、Mn2 、Fe3 、Al3 、Cu2 、Zn2 、Cd2 、Ca2 、Mg2 和Li 的混合。较佳 地,所述金属离子可来源于废锂离子电池正极材料、镍红土矿或含镍钴废渣。因此,在本发 明一优选方案中,所述如式I所示的羧酸类化合物或其盐作为萃取剂用于萃取分离废锂离 子电池正极材料、镍红土矿或含镍钴废渣中的金属离子。 本发明还提供了一种萃取组合物,其包括萃取剂和稀释剂,所述萃取剂包括上述 如式I所示的羧酸类化合物和/或上述如式I所示的羧酸类化合物的盐。 所述萃取组合物中,较佳地,所述如式I所示的羧酸类化合物和所述如式I所示的 羧酸类化合物的盐的摩尔比为(0.4~9):1(例如1:1)。 所述萃取组合物中,较佳地,所述萃取剂包括所述如式I所示的羧酸类化合物和所 述如式I所示的羧酸类化合物的盐,所述如式I所示的羧酸类化合物和所述如式I所示的羧 酸类化合物的盐的摩尔比为(0.4~9):1。 所述萃取组合物中,所述稀释剂可为本领域常用的稀释剂,较佳地,所述稀释剂为 溶剂油(例如200号溶剂油或260号溶剂油)、煤油、Escaid 110、己烷、庚烷和十二烷(例如正 十二烷)中的一种或其混合(例如两种以上);更佳地,所述稀释剂为溶剂油(例如260号溶剂 油)、十二烷(例如正十二烷)和Escaid 110中的一种或其混合(例如两种以上)。 所述萃取组合物中,所述稀释剂的用量可不作具体限定,只要不影响所述萃取组 合物的萃取和反萃取性能即可,较佳地,所述萃取剂和所述稀释剂的摩尔体积比为0.1mol/ L~1.5mol/L,优选0.16mol/L~0.85mol/L,例如0.16mol/L、0.33mol/L或0.6mol/L。 本发明还提供了一种萃取方法,其包括如下步骤:将含萃取剂的有机相对含金属 离子的水相进行萃取,得含金属离子的有机相; 所述含萃取剂的有机相中,所述萃取剂包括上述如式I所示的羧酸类化合物和/或 上述如式I所示的羧酸类化合物的盐; 所述含金属离子的水相中,所述金属离子包括Ni2 、Co2 、Mn2 、Fe3 、Al3 、Cu2 、Zn2 、 Cd2 和Ca2 中的一种或其混合(例如两种以上)。 所述含金属离子的水相中,所述金属离子还可包含例如Mg2 、Li 等其它离子。较佳 地,所述金属离子可来源于废锂离子电池正极材料、镍红土矿或含镍钴废渣。较佳地,所述 金属离子为“Ni2 、Co2 和Mn2 中至少一种”与“Fe3 、Al3 、Cu2 、Zn2 、Cd2 、Ca2 、Mg2 和Li 中至 少一种”的混合。例如,所述金属离子为Ni2 、Co2 、Mn2 、Fe3 、Al3 、Cu2 、Zn2 、Cd2 、Ca2 、Mg2 和 Li 的混合。 所述含萃取剂的有机相中,较佳地,所述如式I所示的羧酸类化合物和所述如式I 所示的羧酸类化合物的盐的摩尔比为(0.4~9):1(例如1:1)。 所述含萃取剂的有机相中,较佳地,所述萃取剂包括所述如式I所示的羧酸类化合 物和所述如式I所示的羧酸类化合物的盐,所述如式I所示的羧酸类化合物和所述如式I所 示的羧酸类化合物的盐的摩尔比为(0.4~9):1。 所述萃取方法中,较佳地,所述含萃取剂的有机相还包括稀释剂。所述稀释剂可为 本领域常用的稀释剂,较佳地,所述稀释剂为溶剂油(例如200号溶剂油或260号溶剂油)、煤 9 CN 111592459 A 说 明 书 5/13 页 油、Escaid 110、己烷、庚烷和十二烷(例如正十二烷)中的一种或其混合(例如两种以上); 更佳地,所述稀释剂为溶剂油(例如260号溶剂油)、十二烷(例如正十二烷)和Escaid 110中 的一种或其混合(例如两种以上)。所述稀释剂的用量可不作具体限定,只要不影响所述含 萃取剂的有机相的萃取和反萃取性能即可,较佳地,所述含萃取剂的有机相中,所述萃取剂 和所述稀释剂的摩尔体积比为0.1mol/L~1.5mol/L,优选0.16mol/L~0.85mol/L,例如 0.16mol/L、0.33mol/L或0.6mol/L。 所述萃取方法中,所述含萃取剂的有机相和所述含金属离子的水相的体积比可为 本领域常规萃取所用比例;较佳地,所述含萃取剂的有机相和所述含金属离子的水相的体 积比为1:(1~10),更佳地为1:(1~5),例如1:1、1:2或1:4。 所述萃取方法中,较佳地,通过振荡传质。 所述萃取方法中,较佳地,所述萃取的温度可为本领域此类萃取常规所用,较佳地 为10℃~50℃,更佳地为25℃~40℃。所述萃取的时间可为本领域常规的时间,较佳地为5 ~60分钟,例如15分钟或30分钟。 本发明还提供了一种反萃方法,其包括如下步骤:将经上述萃取方法获得的含金 属离子的有机相与酸的水溶液混合,即可。 所述反萃方法中,所述含金属离子的有机相中负载的金属离子转入水相,得富金 属离子的水相和再生有机相。 所述反萃方法中,所述酸的水溶液的摩尔浓度可为本领域此类反萃常用的摩尔浓 度,较佳地为0.5mol/L~5mol/L,更佳地为1~3mol/L,例如1mol/L或2mol/L,所述的摩尔浓 度是指所述的酸的物质的量占所述的酸的水溶液总体积的比。 所述反萃方法中,所述酸的水溶液中的酸可为本领域常规的酸,较佳地为无机酸。 所述的无机酸较佳地为盐酸、硫酸、磷酸和硝酸中的一种或多种,更佳地为硫酸。 所述反萃方法中,所述的含金属离子的有机相与所述酸的水溶液的体积比可为本 领域常规比例,较佳地为(1~50):1,更佳地为(10~20):1,例如10:1或15:1。 本发明中,所述振荡是为了传质需要,使有机相和水相混合均匀,还可采用本领域 其他常规操作如搅拌等操作替代。 在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳 实例。 本发明所用试剂和原料均市售可得。 本发明的积极进步效果在于: (1)本发明羧酸类化合物在应用于金属离子的萃取分离时,分离系数高,反萃酸度 低,负载率高(对Ni2 的饱和容量≥16g/L),反萃率高(一次反萃率>99%); (2)本发明羧酸类化合物作为萃取剂稳定性高、水溶性低(在萃取体系平衡pH为 7.23时所提取出油含量≤75mg/L),使得萃取工艺稳定,可以减少环境污染、降低成本; (3)本发明羧酸类化合物成本低,有重大的应用前景,可用于三元电池回收、电池 级硫酸镍制备等多种体系。 附图说明 图1为化合物BC196对各个离子的萃取率E%-pH曲线。 10 CN 111592459 A 说 明 书 6/13 页












