技术摘要:
本发明涉及一种SARS‑CoV‑2灭活疫苗及其制备方法,所述制备方法包括如下步骤:步骤(1)Vero细胞的复苏和规模化培养;步骤(2)接种工作种子批毒种、病毒培养及一次性收获病毒液,即为病毒收获液;步骤(3)第一次病毒灭活、浓缩及第二次病毒灭活后得灭活病毒浓缩液;步骤(4 全部
背景技术:
2019年12月末发生严重急性呼吸道综合症疫情,病原学检测结果证实为一种新型 冠状病毒,随后细胞分离获得新型冠状病毒株。国际病毒分类委员会将该新型冠状病毒命 名为重症急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2),WHO将该病毒导致的疾病命名为新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)。COVID-19疫情已造成全球范围的大流行,COVID-19给各国人民生命财产 安全和社会发展带来了巨大的危害。 流行病学研究表明,COVID-19冠状病毒感染后,常见呼吸道症状为发热、干咳、乏 力,肌痛、气促和呼吸困难、淋巴细胞减少症,重症和危重病例可导致肺炎、严重急性呼吸综 合征、肾衰竭,甚至死亡。 病毒主要传播途径为呼吸道飞沫传播、密切接触传播,特殊环境下的气溶胶传播, 也可能存在粪口传播途径和母婴传播。医学干预治疗手段为支持治疗和对症治疗,目前尚 无针对性抗冠状病毒感染特效药和疫苗上市。 加强预防性COVID-19疫苗研发,对疫情的应急防控和远期控制具有重要意义。预 防新冠病毒可能的广泛传播而造成的持续或重新流行,迫切需要快速研发疫苗及目标人群 接种,特别是高风险的医护人员,其他参与病原诊断、治疗、药物临床研究、防疫一线的工作 人员,及重症、病死率高的高危人群,也需要疫苗接种保护高危人群。 许多研究机构开展了疫苗的研发工作,这些疫苗包括基于反向遗传学操作的减毒 活疫苗、亚单位疫苗(主要表面抗原S蛋白)、DNA疫苗(S基因)、病毒载体疫苗(腺病毒,痘病 毒等载体)以及灭活苗。灭活疫苗是通过物理或者化学处理等方法使病毒失去感染性而制 备成的疫苗。灭活疫苗不具有致病性,但基本保持了病毒的免疫原结构,因此是安全有效的 经典疫苗手段。 目前利用细胞工厂大规模培养Vero细胞用于病毒性疫苗已有多款上市产品,包 括:口服脊灰减毒活疫苗、肠道病毒71型灭活疫苗和冻干甲型肝炎减毒活疫苗等。目前,还 没有用于预防新型冠状病毒感染的疫苗上市,利用细胞工厂培养Vero细胞,再接种特定的 新型冠状病毒毒株进行病毒培养和收获制备新型冠状病疫苗,还未见报道。
技术实现要素:
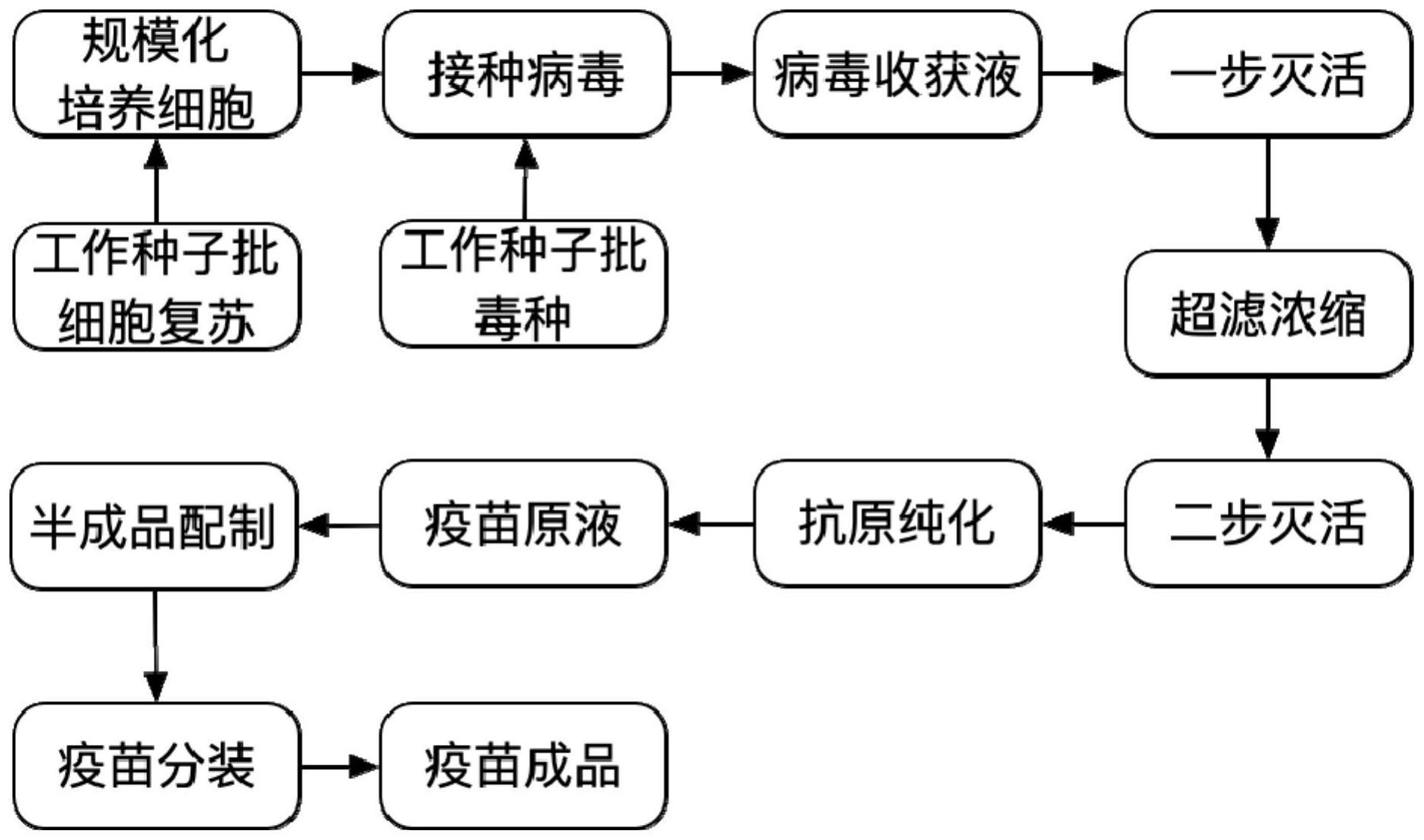
本发明首先涉及一种SARS-CoV-2病毒的灭活疫苗的制备方法,所述方法包括如下 步骤: 步骤(1)Vero细胞的复苏和规模化培养; 步骤(2)接种工作种子批毒种、病毒培养及一次性收获病毒液,即为病毒收获液; 4 CN 111569058 A 说 明 书 2/7 页 步骤(3)第一次病毒灭活、浓缩及第二次病毒灭活后得灭活病毒浓缩液; 步骤(4)灭活病毒浓缩液纯化后得疫苗原液; 具体的: 步骤(1)所述Vero细胞复苏和规模化培养为: 取工作细胞库的1支或多支同批Vero细胞,经复苏扩增、胰蛋白酶替代物消化、37 ℃±1℃培养制备的一定数量并用于接种病毒的细胞为一个细胞批。 使用的细胞培养液为含5%~10%新生牛血清的199培养液,置于细胞工厂内,37 ℃培养至均匀单层Vero细胞;随后培养3~6天,至细胞密度2~5×107个/ml,优选的,培养6 天,至细胞密度约为5×107个/ml; 步骤(2)所述的接种工作种子批毒种、病毒培养及收获为: 1)替换Vero细胞培养液为病毒维持液,所述病毒维持液为199培养液和DMEM培养 液的混合液,优选的,所述病毒维持液为199培养液和DMEM培养液按照体积比2:1混合的混 合液,每100 L病毒维持液加入0 .1~1 0m l工作毒种,工作毒种病毒滴度不低于 6 .00LgCCID50/ml;优选的,每1ml工作毒种加入100L病毒维持液中,工作毒种滴度为 8.00LgCCID50/ml;; 2)将病毒维持液加入细胞工厂中,培养条件为37℃±1℃;培养3~6天,观察细胞 病变,细胞病变CPE达到80%以上时,一次性收获病毒液,即为病毒收获液; 步骤(3)所述的病毒的第一次病毒灭活、浓缩及第二次病毒灭活具体为: 1)病毒收获液立即加入甲醛灭活:甲醛溶液直接加入盛装病毒收获液的容器中, 使终浓度37%甲醛溶液与病毒收获液的积比1:1000~10000,置37℃下灭活3~8天; 或者2)于2~8℃放置后用β-丙内酯灭活:病毒收获液温度达到2~8℃后,β-丙内 酯与病毒收获液体积比1:2000~8000,置于2~8℃下灭活2~4天; 第一次病毒灭活完毕后,采用100~300KD膜包超滤浓缩20~80倍得病毒浓缩液; 随后对病毒浓缩液进行第二次病毒灭活操作得灭活病毒浓缩液,灭活步骤同第一 次灭活,如二次采用β-丙内酯灭活时,灭活完成后将灭活病毒液置37℃水解至少2小时,以 确保β-丙内酯完全水解; 步骤(4)所述的灭活病毒浓缩液纯化步骤为: 将灭活病毒浓缩液采用柱色谱法进行凝胶过滤层析纯化,色谱介质为琼脂糖凝胶 Sepharose 4FF或Sepharose 6FF(优选为Sepharose 4FF),采用PH7.4、浓度为0.01mol/L的 PBS溶液洗脱,每次上样量不超过层析柱体积的10%,280nm紫外监测收集第一峰,即为目的 蛋白峰,即获得SARS-CoV-2病毒疫苗原液,原液置于2~8℃保存; 所述的最终接种病毒的细胞工厂为10和/或40层细胞工厂。 进一步的,所述的SARS-CoV-2病毒疫苗原液经检定合格后,在配制容器中按铝终 浓度为0.80~1.20mg/ml加入氢氧化铝佐剂,在混匀的状态下加入原液,补加pH 7.2~7.4 磷酸盐缓冲液至新型冠状病毒特异性抗原含量为200~800WU/ml(WU代表新型冠状病毒灭 活抗原单位)所需体积,混匀,即为半成品。分装在预灌封注射器或者西林瓶中,0.5ml/支。 本发明还涉及由所述方法制备获得的SARS-CoV-2病毒灭活疫苗。 本发明的有益效果在于: 1、采取两步病毒灭活,规模化制备新型冠状病毒灭活疫苗过程中,由于病毒收获 5 CN 111569058 A 说 明 书 3/7 页 液体积较大,封闭化管道操作过程中,可能存在部分病毒收获液粘附于管壁或瓶壁,从而导 致存在灭活死角,基于此,选择超滤浓缩后的病毒浓缩液进行第二次病毒灭活,进一步降低 生物安全风险;两次灭活确保疫苗的生物安全。 2、本发明选择100~300kD超滤膜包对灭活的病毒收获液进行灭活病毒抗原浓缩 富集处理,同时去除部分小分子杂蛋白;超滤浓缩后,采取了Sepharose 4FF或Sepharose 6FF为凝胶过滤层析介质,去除与病毒颗粒分子量相差较大的大部分牛血清、宿主细胞DNA 以及宿主细胞蛋白,大大减少了疫苗原液中杂质含量,在保证疫苗效力的同时最大限度提 高了疫苗的纯度,降低了疫苗内杂质的含量,从而降低了人体由于接种而引起不良反应的 几率。 3、本发明制备的新型冠状病毒灭活疫苗在体外相对效力测定、体内效力、异常毒 性、热稳定性试验、内毒素含量、牛血清白蛋白残留量、Vero细胞DNA残留量、Vero细胞蛋白 质残留量等方面均达到工艺设计要求,这得益于优化的工艺,要点是细胞经细胞工厂培养, 换无血清病毒维持液接种病毒,操作简单,并且大幅度的降低了成本,有利于细胞病变的控 制并能够大幅度提高病毒收获液的病毒滴度,从而有效提高疫苗的效力;收获的病毒液经 两次病毒灭活,确保最终原液不含有活的病毒;病毒液经超滤、凝胶过滤,最大限度降低了 疫苗原液中杂质含量、保证了单位蛋白中有效抗原含量高,从而保证了疫苗的效力。 附图说明 图1、接种工作毒株3天后的Vero细胞照片,图中明显可见细胞染毒病变。 图2、疫苗制备工艺流程图。 图3、4FF填料凝胶过滤层析图谱。 图4、6FF填料凝胶过滤层析图谱。 图5、疫苗供试品的抗体效价GMT值。












