技术摘要:
本发明涉及一种流感病毒和2019新型冠状病毒抗体联合检测装置及其制备方法,属于医疗检测设备领域。由固相有流感病毒A抗原、流感病毒B抗原、新型冠状病毒S抗原和羊抗鼠IgG多克隆抗体的硝酸纤维素膜、吸附有高特异性抗人IgM抗体的玻璃纤维膜、样品垫、吸水纸等其它辅料粘 全部
背景技术:
流行性感冒是由流感病毒感染引起的一种急性呼吸道传染病,经呼吸道迅速传 播,潜伏期短,季节性明显,极易造成大范围暴发流行,控制难度大。流感病毒分为甲(A)、乙 (B)、丙(C)3型,其中甲型流感病毒、乙型流感病毒感染较常见,传染性强,传播迅速,对人类 健康产生严重的威胁。由于流感病毒传播速度快,且病毒容易发生变异,每年都会发生不同 规模的流行,甚至每隔10~15年发生一次全球大流行。世界卫生组织(WHO)推测全球每年约 有多达65万人死于流感相关的呼吸系统疾病。流感的流行不仅对人群健康造成严重威胁, 也产生巨大的社会和经济损失。流感临床主要表现为发热、头痛、肌痛和全身不适,可伴咳 嗽、咳痰等呼吸系统症状,也可伴呕吐、腹泻等消化系统症状。儿童、孕产妇、老年人及患有 各种慢性病或体质虚弱者患流感后易出现严重并发症或加重原有的慢性病,甚至引起相应 器官功能衰竭而危及生命。因此,了解流感的特征有利于尽早识别、及时治疗。 流感病毒的变异以甲型最为重要,常与世界性大流行有密切联系。一般来讲,流感 病毒的抗原性变异就是指H和N抗原结构的改变,在亚型内部经常发生小变异(量变),称为 抗原漂移。抗原变异仅发生于甲型病毒。它可能是由于同一细胞感染了人类和动物的2种病 毒,病毒之间发生基因重配而产生的。由此产生的病毒血凝素和神经氨酸酶发生全新结合, 而使得人群没有免疫力。抗原转变是造成流感全球大流行的原因。甲型流感病毒大约每隔 十几年发生1次大变异,自1933年以来甲型病毒已经历了4次抗原转变:1933~1946年为 H0N1(原甲型,A0),1946~1957年为H1N1(亚甲型,A1), 1957~1968年为H2N2(亚洲甲型, A2),1968年以后为H3N2(香港型,A3)。一般新旧亚型之间有明显的交替现象,在新的亚型出 现并流行到一个地区后,旧的亚型就不再能分离到。乙型流感染毒间同样有大变异与小变 异,但未划分成亚型转变。丙型流感病毒尚未发现抗原变异。 乙型流感病毒虽然未造成过流感大流行,但同甲型流感病毒一样每年在全球季节 性流行,导致了各地的局部流行,并能引起重症和死亡病例,在某些特定情况下所导致的疾 病负担甚至超过甲型流感病毒。 冠状病毒是一个大型病毒家族,已知可引起感冒以及中东呼吸综合征(MERS)和严 重急性呼吸综合征(SARS)等较严重疾病。新型冠状病毒(Coronavirusdisease-19 COVID- 19,2019-nCoV)是以前从未在人体中发现的冠状病毒新毒株。人感染了冠状病毒后常见体 征有呼吸道症状、发热、咳嗽、气促和呼吸困难等。在较严重病例中,感染可导致肺炎、严重 急性呼吸综合征、肾衰竭,甚至死亡。目前对于新型冠状病毒所致疾病没有特异治疗方法, 4 CN 111579792 A 说 明 书 2/10 页 但许多症状是可以处理的,因此需根据患者临床情况进行治疗。 流感病毒A型B型与2019-nCoV临床治疗方案有所差异,因此需要进行鉴别诊断出 究竟是感染了哪种病毒,然后针对性治疗;因此2019-nCoV、流感病毒A型和B型 IgM抗体联 合定性检测项目能够及时、便捷、精准检测出感染了哪种病毒,给临床诊疗带来极大收益, 也给各级医疗机构、疾控中心等场景提供一个有力的、全面的、精准的筛查和诊断工具。其 次其检测样本为全血或者血清、血浆,取材方便安全;2019-nCoV、流感病毒A型和B型IgM抗 体为现症感染指标,不存在假阳性问题,因此更加精准,对临床诊断价值非常大。 流感病毒的确认一般采用鸡胚或MDCK细胞分离培养和血凝抑制法,操作繁琐且费 时费力,难以满足快速诊断需要。随着快速诊断技术的发展和应用,目前市场上流感及2019 新型冠状病毒产品类型基本可以分为3大类:核酸诊断类(PCR法)、酶联免疫吸附法(ELISA 法)和胶体金免疫层析法。PCR法准确度最高,是确诊的首选方法,但检测成本较高,检测时 间较长;ELISA法是医院检验科和疾控系统实验室的经典方法;胶体金法速度最快、技术成 熟稳、简便易行,适合于各级医疗机构、疾控中心等场合的普遍筛查和诊断。 胶体金免疫层析技术(gold immunochromatography assay,GICA)是一种将胶体 金标记技术和蛋白质层析技术结合的以微孔滤膜为载体的固相膜免疫分析技术。胶体金免 疫层析技术是一种常用的免疫层析检测方法,由于其操作简单、省时、制造成本较低、结果 易判读等特点,非常适合于现场检测,广泛用于生物、医药、食品等领域。由于胶体金免疫层 析技术是一步完成检测,因此检测过程的干扰因素较多,其灵敏度低是限制胶体金免疫层 析应用范围的主要因素,传统的胶体金免疫层析技术的检测限高于 ELISA等方法。 在胶体金免疫层析检测中,蛋白质固着于硝酸纤维素膜(NC膜)作为待测样本的捕 获试剂。由于检测结果完全取决于捕获试剂在膜上达到良好的吸附效果,因此蛋白质在膜 上均一、良好的吸附对胶体金检测结果非常重要。如果NC膜上结合的蛋白量不足或者蛋白 结合力不够强,就会出现相当多的问题,在检测结果的检测线上非常明显。如果膜上结合的 蛋白量太低,那么在结果中检测线显色较弱而且检测灵敏度降低。如果蛋白不能牢固的吸 附于NC膜,那么在蛋白吸附于NC膜以前发生扩散,从而导致检测线较宽、显色较弱而不是鲜 艳而清晰,使检测结果难以解释。在极端条件下,如果蛋白与 NC膜的物理吸附作用太弱,流 过的蛋白检测物和表面活性剂溶液可能将固着的蛋白从 NC膜上洗掉,从而显示较宽或者 根本不清晰的检测线,难以解释检测结果。
技术实现要素:
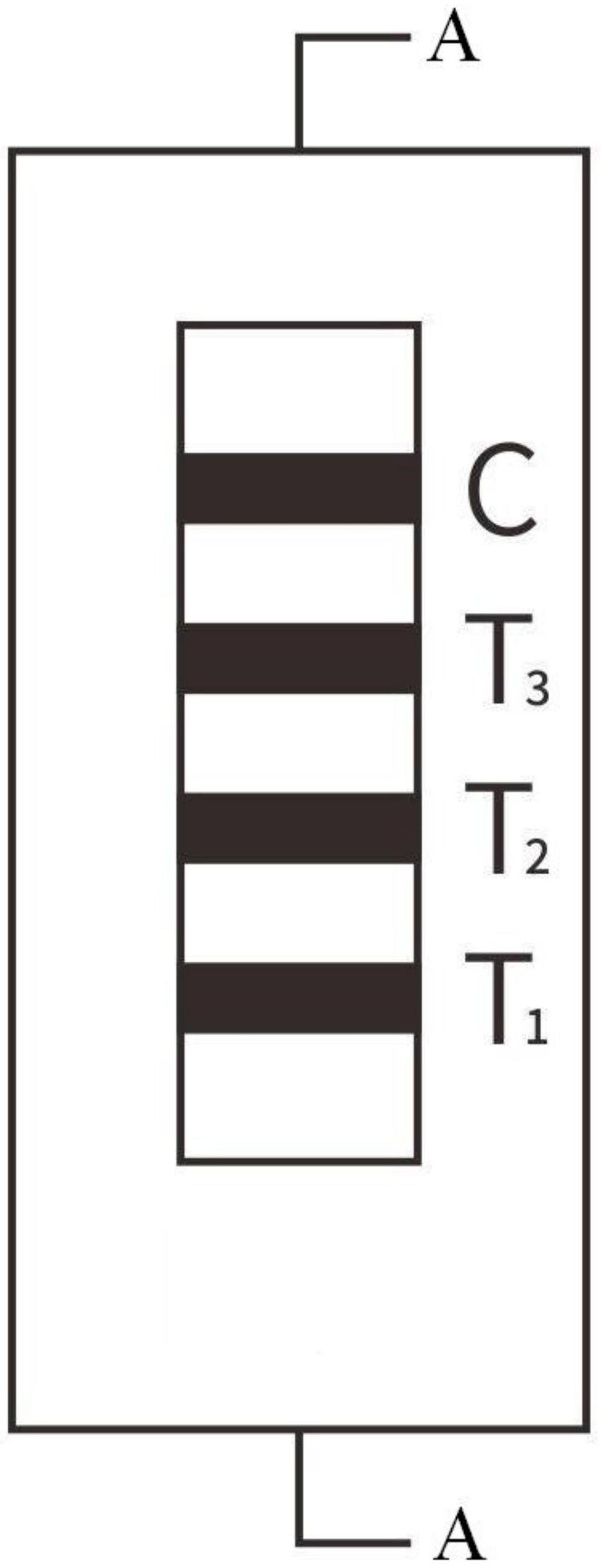
本发明提供一种流感病毒和2019新型冠状病毒抗体联合检测装置及其制备方法, 以解决现有技术存在的NC膜吸附蛋白量不足、结合力不强的问题。本发明制备的 2019- nCoV、流感病毒A型和B型IgM抗体三合一定性联合检测装置,提高了对呼吸道疾病患者进行 合理综合判定,能够快速、准确进行呼吸道感染疾病的病情风险判断。 本发明采取的技术方案是:样品垫1、免疫胶体金玻璃纤维膜2、免疫硝酸纤维素膜 3、吸收垫4分别粘贴在塑料板5,所述免疫硝酸纤维素膜3的两端分别与吸收垫4、免疫胶体 金玻璃纤维膜2搭接,所述免疫胶体金玻璃纤维膜2的另一端与样品垫1搭接;所述免疫硝酸 纤维素膜3上设置第一检测线T1、第二检测线T2、第三检测线T3、和质控线C;所述的第一检 测线T1上固相有流感病毒A抗原;所述的第二检测线T2上固相有流感病毒B抗原;所述的第 5 CN 111579792 A 说 明 书 3/10 页 三检测线T3上固相有高特异性2019新型冠状病毒S 抗原;所述免疫硝酸纤维素膜3上设置 的检测线T1、T2、T3可以纵向排列在同一条免疫硝酸纤维素膜3上,形成一个联合检测装置; 所述免疫硝酸纤维素膜3上设置的检测线T1、T2、T3也可以分别设置在三条免疫硝酸纤维素 膜3上,并列排列形成一个联合检测装置;所述的质控线C上喷点羊抗鼠IgG多克隆抗体。 一种流感病毒和2019新型冠状病毒抗体联合检测装置的制备方法,包括下列步 骤: (a)采用柠檬酸三钠还原法制备胶体金; (b)采用步骤(a)中制得的胶体金标记抗人IgM抗体,获得免疫胶体金; (c)采用喷金缓冲液稀释步骤(b)的免疫胶体金获得免疫胶体金溶液,用免疫胶体 金溶液喷涂于玻璃纤维垫,制得免疫胶体金玻璃纤维膜; (d)将硝酸纤维素膜用聚乙二醇丙三醇处理液预处理后,喷点与油酸修饰的硫化 锌纳米颗粒结合的流感病毒A抗原、流感病毒B抗原、2019新型冠状病毒S抗原作为检测线, 喷点羊抗鼠IgG抗体作为质控线,制得免疫硝酸纤维素膜; (e)将预处理的样品垫、步骤(c)制备的免疫胶体金玻璃纤维膜、步骤(d)制备的免 疫硝酸纤维素膜、吸水纸依次粘贴在胶板上,切裁制得检测试剂条,最后将检测试剂条装入 塑料外壳。 本发明步骤(a)所述的采用柠檬酸三钠还原法制备的胶体金颗粒粒径为20~ 60nm。 本发明步骤(c)所述的喷金缓冲液由Tris-HCL液、蔗糖、海藻糖、牛血清白蛋白 BSA组成,pH值8.5,其中Tris-Hcl浓度为0.02mol/L,蔗糖浓度为5~20%,海藻糖浓度为1~ 5%,牛血清白蛋白BSA浓度为0.5~1%。 本发明步骤(d)所述的将硝酸纤维素膜用聚乙二醇丙三醇处理液预处理是:用聚 乙二醇丙三醇处理液浸泡硝酸纤维素膜1h,并慢速振荡摇晃,取出后用蒸馏水清洗3 遍,最 后在真空干燥箱中干燥; 步骤(d)所述的硫化锌纳米颗粒分别结合流感病毒A抗原、流感病毒B抗原、2019 新型冠状病毒S抗原是:以油酸修饰的ZnS作为载体,取1mL流感病毒A抗原、流感病毒B抗原、 2019新型冠状病毒S抗原溶液,搅拌1小时后,分别以12000rpm, 8500rpm和7000rpm离心10 分钟收集,去离子水各洗2遍。 本发明步骤(d)所述的聚乙二醇丙三醇处理液由聚乙二醇丙三醇稀释到浓度为 0.5%组成,经0.22μm滤膜过滤,备用; 本发明步骤(d)所述的聚乙二醇丙三醇处理液由聚乙二醇丙三醇和多聚赖氨酸 (SIGMA,150KD~300KD)混合组成,其中聚乙二醇丙三醇浓度为0.5%,多聚赖氨酸浓度为 0.5%组成,经0.22μm滤膜过滤,备用; 本发明步骤(d)所述的聚乙二醇丙三醇处理液由聚乙二醇丙三醇、多聚赖氨酸 (SIGMA,150KD~300KD)、PEG20000混合组成,其中聚乙二醇丙三醇浓度为0.5%,多聚赖氨 酸浓度为0.5%组成,PEG20000浓度为0.1%,经0.22μm滤膜过滤,备用; 本发明步骤(d)所述的油酸修饰的硫化锌纳米颗粒制备方法:取油酸无水乙醇溶 液15ml加入到15ml浓度为0.3mol/L的醋酸锌水溶液中,40℃水浴搅拌,用氨水调节pH值,再 加入15ml浓度为0.3mol/L的硫化钠水溶液,反应5min后,加入5ml SDS水溶液,待混合均匀 6 CN 111579792 A 说 明 书 4/10 页 后,将该反应液倒入90ml水热釜中。水热釜密闭后放入恒温干燥箱内,在一定温度下恒温反 应一定时间。待反应结束,降温至50℃,取出产物。用丙酮,去离子水,乙醇洗涤,离心分离, 在50℃下真空干燥2h得到粉体ZnS,存放待用。 本发明步骤(e)所述的预处理的样品垫采用的样品垫处理液由Tris-HCL液、牛血 清白蛋白BSA、酪蛋白、表面活性剂(烷基酚聚氧乙烯醚)组成,其中Tris-HCL液浓度为 0.1mol/L,牛血清白蛋白BSA浓度为0.5~1%,酪蛋白浓度为0.1~0.2%、表面活性剂浓度 为0.5~1%。 乙二醇与环氧氯丙烷用碱催化其反应,产物用稀盐酸中和,四氯化碳萃取,减压蒸 馏,得到聚乙二醇丙三醇(PEGG) ,为淡黄色粘稠物。PEGG能与水以任意比例混溶, 也能溶于 一般的有机溶剂如乙醇、丙酮、四氢呋喃、氯仿,有一定的表面活性。聚乙二醇丙三醇的结构 中含有多个羟基可供偶联,活化过程简单,方便NC膜表面固定蛋白。常规条件下,单位面积 的NC膜上结合抗体的数量是有限的,采用聚乙二醇丙三醇处理之后,可以让单位面积的NC 膜上结合抗体数量增加,进而可以实现更高的检测灵敏度。 在改善NC膜对蛋白吸附基础上,探讨蛋白对NC膜吸附效果也是提高胶体金灵敏度 的另一途径。油酸/十二烷基硫酸钠修饰的ZnS不仅具有纳米级的粒径尺寸、且具有良好的 水溶性与生物相容性,利用其外表面的功能性基团,在水介质中均匀分散,可与生物大分子 相结合。硫化锌纳米颗粒具有较好的稳定性、易于制备、生物相容性较好及较低的免疫原性 等优势,在生物医学领域研究较为广泛。但在胶体金免疫层析技术中尚未有报道应用。本研 究探讨了硫化锌纳米颗粒对NC膜包被抗体的影响,先将划膜用的抗体先与硫化锌纳米颗粒 结合,封闭,离心纯化,去掉未结合的抗体,然后复溶到一定比例,然后划膜,这样一个硫化 锌粒子可以结合多个抗体,从而增加了包被抗体效率,灵敏度也会大大提高。 为了提高胶体金免疫层析技术的灵敏度,我们通过对硝酸纤维素膜用聚乙二醇丙 三醇处理液进行了预处理,将包被NC的抗体与硫化锌纳米颗粒结合,达到了提高试纸灵敏 度的目的。 本发明的有益效果在于: 1、本发明的检测装置结构简单,构思新颖,将流感病毒A抗原、流感病毒B抗原、 2019新型冠状病毒S抗原包被于硝酸纤维膜膜上,特异性强,既能同时检测标本中流感病毒 A型、流感病毒B型、2019新型冠状病毒IgM抗体,又没有增加生产操作的复杂度。 2、免疫胶体金制备步骤中,通过配合合适的喷金缓冲液和样品垫处理液,可保证 免疫胶体金释放完全的基础上,有效的提高了反应的灵敏度,同样的阈值下,还可降低免疫 胶体金的用量,节约成本。 3、本发明对硝酸纤维素膜进行预处理,对包被硝酸纤维素膜的抗体进行了修饰, 提高了检测试纸灵敏度、特异性。 4、本发明的检测装置不需要任何特殊仪器设备,检测成本低。 5、本发明的检测装置操作简便,不需要专业人员操作。实用性强。 附图说明 图1是本发明的结构示意图,图中检测线T1、T2、T3纵向排列在同一条免疫硝酸纤 维素膜3,形成一个联合检测装置; 7 CN 111579792 A 说 明 书 5/10 页 图2是图1的A-A剖视图; 图3是本发明的另一种结构示意图,图中检测线T1、T2、T3分别设置在三条免疫硝 酸纤维素膜上,并列排列形成一个联合检测装置; 图4是图3的B-B剖视图; 图5是图3的C-C剖视图; 图6是图3的D-D剖视图。












