技术摘要:
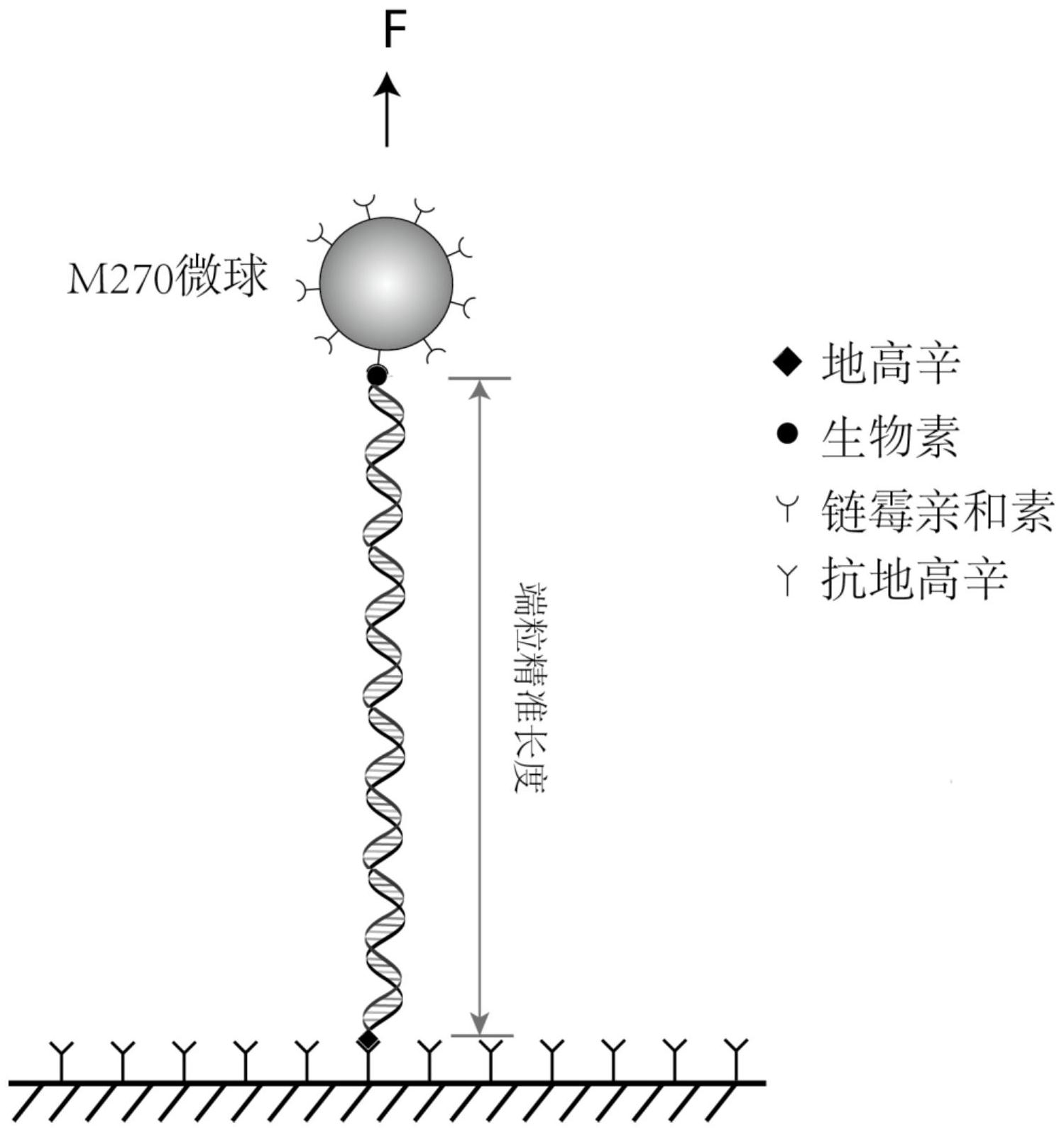
本发明涉及一种测量人端粒精准长度的单分子力学方法。首先,提取目标细胞的基因组DNA;使用组合酶切,消化基因组,保留端粒DNA;分别采用地高辛和生物素对端粒DNA两端进行亲和标记,从而获得可用于单分子力学测量的端粒DNA结构。其次,将端粒结构固定于链霉亲和素包被 全部
背景技术:
端粒是人类寿命的时钟,其长度决定了细胞的命运。端粒位于真核细胞染色体末 端,在保持染色体的完整性和控制细胞的分裂周期上起着重要的作用。端粒的DNA序列为 5′-TTAGGG-3′的高度重复序列。随着细胞分裂次数的增加,端粒长度因复制损失或DNA损伤 修复而变短。当端粒短于关键长度后,会激活凋亡机制,导致细胞凋亡。因此,端粒也被称为 细胞命运的生物钟。测量端粒的精准长度,对于流行病学调查、端粒生物学研究、以及靶向 端粒的药物研发有非常重要的作用。 目前有多种测量端粒长度的方法,但都有欠精准,比如DNA印记法(Southern blot ,SB)、杂交保护分析法(hybridization protection assay ,HPA)、荧光原位杂交 (FISH)、流式细胞计量-荧光原位杂交(Flow-FISH)、寡核苷酸引物原位DNA合成法(PRINS)、 定量PCR(Q-PCR)、单个端粒长度分析(STELA)等。上述方法都是间接测量端粒的长度,并受 到高杂背景噪音的困扰。SB、HPA、FISH、Flow-FISH、PRINS需要与探针进行杂交,检测发光强 度间接计算端粒长度;Q-PCR根据T/S率测定端粒长度;STELA是在单个染色体水平上基于 PCR的端粒测量方法。 单分子力谱技术近年兴起,可用于研究DNA长度对力谱的响应。单分子力谱实验, 譬如基于单分子磁镊技术,可以精确测量在可控外力下DNA长度的相应变化。单分子磁镊的 高通量属性,允许在体外同时测量成百上千的DNA分子,可迅速积累统计量。 本方法发明了一种直接测量人端粒精准长度的非标记单分子力学方法,而不需要 与荧光探针结合检测荧光强度,也不需要通过PCR反应测量端粒的长度,是一种避免了高杂 背景噪音的方法。至目前为止,基于单分子力谱测量人端粒精准长度的方法未见报道。
技术实现要素:
为解决上述技术问题,本发明提供了一种测量人端粒精准长度的单分子力学方 法。 本发明采用的技术方案是:将细胞基因组DNA进行组合酶切,保留端粒,经亲和标 记后,使用单分子力谱测量端粒的精准长度。本发明选择的组合酶是MseI/NdeI/BfaI/ CviAII。端粒两端的亲和标记采用地高辛修饰和生物素修饰。端粒结构的生物素修饰端与 链霉亲和素包被的微球磁珠相连,端粒结构的地高辛修饰端与反应池表面铺敷的地高辛抗 体相连,端粒DNA得以固定在反应池内。在单分子磁镊装置上通过调制磁场强度对微球磁珠 施加皮克牛顿级的力,并实时监测磁珠的位置。在MatLab软件环境中分析力与磁珠位置的 关系曲线,测定端粒DNA结构的长度(即磁珠位置最高点与最低点之间的差值)。基于蠕虫模 型,对实测长度进行纳米碱基对的换算,最终获得端粒的长度。本发明可以用于测量人端粒 3 CN 111549098 A 说 明 书 2/7 页 长度,为测量端粒长度提供了一条更新、更精准的技术路线。 本发明提供的测量人端粒精准长度的方法的具体步骤如下所示: 1)对人慢性髓系白血病细胞K562细胞进行细胞复苏、细胞换液、细胞传代。 2)对K562细胞进行基因组的提取。 3)对基因组进行片段化和修饰。 4)对修饰后的端粒结构进行力学拉伸,测量端粒的长度,将长度转化为碱基对数, 测得端粒精确长度。 步骤1)中细胞复苏:从液氮中取出K562细胞于37℃水浴中持续摇晃,使细胞快速 解冻。细胞解冻后,补加2ml完全培养基(RPMI medium添加终浓度为10%的胎牛血清,100U/ ml青霉素和100mg/ml链霉素溶液),700rpm离心。弃去上清液,加入5ml完全培养基重悬细 胞,转入60mm培养皿中,于37℃、5%CO2培养箱中静置培养24小时。细胞换液:从培养箱中取 出培养皿置于生物安全柜中。用移液枪吸取并弃去上清液,沿培养皿侧壁加入5ml完全培养 基,轻摇混匀并继续培养24小时。细胞传代:从培养箱中取出细胞培养皿,置于生物安全柜 中。用1ml移液枪吸取培养基反复吹打使贴壁细胞从培养皿底部完全脱落,将细胞移至50ml 离心管中,700rpm离心5分钟,弃去上清液。取5ml完全培养基重悬细胞,补加15ml完全培养 基并将细胞悬液分至2个100mm培养皿,于培养箱中继续培养24小时。 步骤2)中人慢性髓系白血病细胞K562细胞基因组的提取为:使用DNeasy Blood and Tissue Kit基因组提取试剂盒进行细胞基因组的提取。详细使用方法见试剂盒使用说 明书。提取的基因组DNA样品通过1%琼脂糖凝胶电泳评价所得基因组的完整性。 步骤主要为:收集细胞(约5x106个)并用PBS(pH 7.4)清洗两遍,用200μl PBS溶液 重悬细胞,加入20μl protein K溶液,涡旋混匀;向细胞悬液中加入200μl缓冲液LA,涡旋混 匀,于56℃水浴10分钟。使细胞悬液变澄清;将溶液转移至吸附柱内,12000rmp离心至液体 完全转移至收集管。弃去废液后用缓冲液AW1洗一次,用缓冲液AW2洗两次。将吸附柱置于60 ℃烘箱烘干吸附柱中残留液体;加入70μl去离子水洗脱目标基因组,用NANODROP 8000测定 样品浓度;使用1%琼脂糖凝胶电泳试验评估基因组的完整性,电泳条件设置为电压200伏 特、电流150毫安,电泳时间为50分钟,电泳缓冲液为1×TAE。 步骤3)中提取的基因组首先被限制性内切酶消化,消化后的基因组被片段化。使 用Klenow fragment(3′-5′exo-)聚合酶将含有地高辛(Digoxigenin)修饰的dUTP (Digoxigenin-11-dUTP)引入DNA片段5′末端。使用含生物素修饰的寡核苷酸探针识别含有 端粒重复序列的特定DNA片段。标记后的样品直接用于单分子力学测量,主要步骤如下:取 20μg基因组DNA于0.2ml PCR小管中,加入5μl 10×Cutsmart缓冲液,加入10个单位的限制 性核酸内切酶CviAII,用去离子水补足至50μl,于25℃反应12小时;向上述反应体系中分别 加入10个单位的限制性内切酶Ndel、Msel和Bfal,于37℃反应12小时;80℃加热20分钟灭活 限制性核酸内切酶。取2μg消化后的产物片段用于DNA末端地高辛修饰,加入2μl 10×NEB缓 冲液2,分别加入终浓度为0.2mM的dATP和0.2mM Digoxingenin-11-dUTP,以及10个单位的 klenow fragment(3′-5′exo-),用去离子水补足体积至20μl,将反应混合物置于37℃反应 12小时;将上述所得样品与生物素修饰探针混合并进行梯度退火试验,本试验所得产物可 通过与链霉亲和素包被的磁球结合实现进一步纯化。 步骤4)中对于单分子磁镊实验,力坡实验的力学操纵模式为:整个过程为力线性 4 CN 111549098 A 说 明 书 3/7 页 增加后线性降低,力从0皮牛顿线性增加至17皮牛顿,力的增速为4皮牛顿/秒,然后力从17 皮牛顿线性降低至0皮牛顿,力的降低速度为4皮牛顿/秒。 本发明中使用单分子磁镊实时采集磁珠位置图像,采样频率为200Hz,对磁珠位置 变化反应的分子长度进行柱状图统计。通过相应力下纳米碱基对转换系数,获得DNA的碱基 对数,DNA长度随着力变化的关系符合公式1, 其中F为力,x为长度,P为持续长度,L0为轮廓长度,k为玻尔兹曼常数,T为温度,S 为弹性拉伸模量,根据Bosco,A.所述(PMID:24225314),工作条件下P为51.1纳米,K为4.1皮 牛顿·纳米,S为1006皮牛顿,据此计算出的转换系数为0.33纳米/碱基对。 本发明具有的优点和积极效果是:本方案提供了一种测量人端粒精准长度的单分 子力学方法;组合酶切最大可能消化了亚端粒区,将亚端粒区对长度测量的影响降到最低; 在端粒两端引入地高辛修饰和生物素修饰,构建可用于力学操控的端粒结构物;应用单分 子磁镊测量端粒长度对力谱的响应,借助蠕虫模型,换算端粒的碱基对长度,从而获得端粒 的精准长度。本方案可用于人群端粒长度的流行病学调查,临床患者端粒长度的评分,分子 细胞生物学实验,以及药物药理和毒理研究。 附图说明 图1是从K562细胞基因组中制备端粒结构的流程图; 图2是单分子磁镊测量端粒DNA长度的实验装置; 图3是单分子磁镊控力模式; 图4是端粒长度对力响应关系图; 图5是力与纳米碱基对转化系数曲线图; 图6是端粒长度统计分布图。












