技术摘要:
本发明公开了TENT5D作为靶标在检测和治疗无头精子症中的应用。本发明中,TENT5D突变引起TENT5D功能蛋白缺失,可能影响精子头尾连接,最终诱导无头精子症和不育的形成。
背景技术:
据2020年1月17日国家统计局发布的数据显示:2019中国大陆的人口出生率仅为 10.48‰,创1949年有记录以来最低,且二孩及以上孩次的比例高达59.5%。更加严峻的是, 我国育龄妇女平均初育年龄已经从1990年的23.4岁提高到到2017年的26.8岁,在经济发达 省份更是推迟到30岁以后,并有继续走高趋势。我国生育政策发挥成效的同时,也为生殖医 学带来了前所未有的挑战。乔杰组基于中国人群的不孕不育流行病学研究数据表明,目前 我国年龄在20-49岁夫妇的不孕不育的发生率已经达到了25%左右。在不孕不育的夫妇中, 男性因素约占40-50%左右不育。 临床上导致男性不育的因素很多,精子发生异常是重要原因之一,包括无精子症、 少精子症、弱精子症、畸形精子症及混合前述几种类型等。根据2010年最新版世界卫生组织 标准,畸形精子症被定义为正常形态精子占比低于4%。严重的畸形精子症近年来成为研究 热点,特别是以下几种单一类型的畸形精子症:圆头精子症(globozoospermia)、大头精子 症(macrozoospermia)、无头精子症(acephalic spermatozoa)和精子鞭毛多发形态异常症 (multiple morphological abnormalities of the sperm flagella)等。其中无头精子症 又被称为大头针状精子(pinhead spermatozoa)或断头精子(decapitated spermatozoa), 无头精子症患者的精子头部缺失或伴有少量精子头部松动。这种单一类型的畸形精子症患 者多发生在近亲结婚的家系中,且往往具有家族富集的特点,特别是在家系中发现两个兄 弟都有类似的表型,因此无头精子症由遗传因素导致的可能性较大。 无头精子症由于受到的关注较少,易被漏诊或与圆头精子症混淆,因此对该病的 认识非常有限。以往研究认为中心粒不能迁移并正常附着在精子的尾端核孔上,会导致精 子无头或头与尾部中段连接异常。虽然研究者们已经利用扫描电镜和透射电镜将无头精子 的形态描述得非常详细,但是人类无头精子症的致病原因一直是未知的。 2016年Zhu等人的研究发现SUN5基因突变可能导致人类无头精子症,后续包括申 请人及其合作团队在内的多个研究小组也陆续发现SUN5基因突变引起无头精子症,并且进 一步通过小鼠遗传学和分子生物学等手段揭示了SUN5蛋白在锚定精子头尾过程中的重要 作用。随后,科研人员通过全外显子组测序技术首次在一个近亲结婚家系的无头精子症患 者中发现BRDT突变,并初步揭示了该基因突变导致无头精子症发生的潜在机制。有研究人 员首次发现并报道了DNAH6基因突变可能会导致无头精子症的发生。近期,科研人员在另一 个近亲结婚家系中定位到一个无头精子症相关新基因TSGA10。TSGA10是睾丸高度特异表达 基因,通过免疫荧光染色我们发现该蛋白定位于精子头尾连接处。与SUN5突变导致的无头 精子症不同的是,TSGA10突变导致的无头精子症的头尾断裂区域位于精子尾部中段 (midpiece)区,而不是SUN5突变研究中所示的头尾连接颈部区域。因此TSGA10突变导致头 3 CN 111575364 A 说 明 书 2/9 页 精子症的分子机制可能是不同的。2018年科研人员发现PMFBP1(定位于精子头尾连接处颈 部)纯合无义突变(p.gln802*)通过阻碍头尾结合部(HTCA)的发育而导致无头精子发生, Zhu F等也几乎同时发现PMFBP1基因突变会导致无头精子症发生。2019年,科研人员再次发 现中心体蛋白CEP112突变会导致无头精子症发生。在上述文献报道中,SUN5、PMFBP1基因突 变并不影响IVF助孕结局,而TSGA10、DNAH6、BRDT、CEP112基因突变可能影响IVF助孕结局。 综上所述,截至目前,科研人员已发现SUN5、DNAH6、BRDT、PMFBP1、TSGA10、CEP112多个无头 精子症相关基因。其中SUN5基因突变可能占所有无头精子症患者中的30-50%,其余已经报 道的基因突变约占10-20%,这意味着还有大量的无头精子症患者的遗传学致病因素并未 揭示。
技术实现要素:
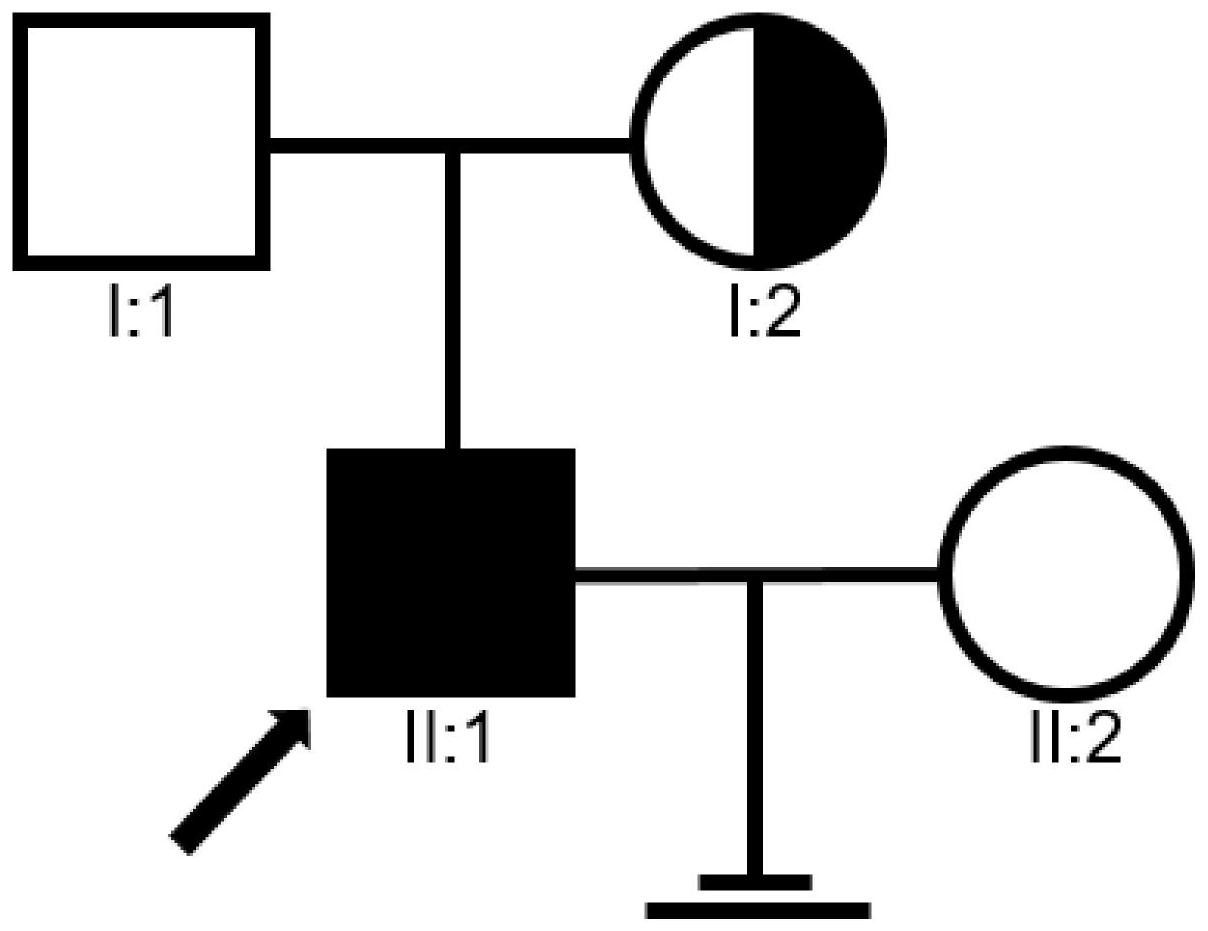
本发明的目的在于克服现有技术缺陷,提供TENT5D作为靶标在检测和治疗无头精 子症中的应用。 本发明的技术方案如下: TENT5D作为检测靶标在制备诊断无头精子症的试剂盒中的应用。 TENT5D作为治疗靶标在制备治疗无头精子症的试剂盒中的应用。 TENT5D突变的拮抗物质在制备防治无头精子症的药物中的应用。 一种诊断无头精子症的试剂盒,包括能够检测TENT5D是否突变的试剂。 在本发明的一个优选实施方案中,所述能够检测TENT5D是否突变的试剂包括PCR 检测TENT5D是否突变的试剂。 一种治疗无头精子症的试剂盒,包括能够治疗TENT5D突变的试剂。 在本发明的一个优选实施方案中,所述能够治疗TENT5D突变的试剂包括TENT5D突 变的拮抗物质。 一种防治无头精子症的药物,其有效成分包括TENT5D突变的拮抗物质。 在本发明的一个优选实施方案中,其有效成分为TENT5D突变的拮抗物质。 进一步优选的,还包括药学上可接受的辅料。 本发明的有益效果是:本发明中,TENT5D突变引起TENT5D功能蛋白缺失,可能影响 精子头尾连接,最终诱导无头精子症和不育的形成。 附图说明 图1为本发明实施例1中TENT5D基因突变无头精子症患者及家系图。其中,携带 TENT5D基因突变的无头精子症表型患者的家系分析,黑色方块表示不育的患者,半黑圆形 表示该家族中杂合突变携带者。 图2为本发明实施例1中TENT5D基因在人体各个组织中的表达丰度图。其中,在The Human Protein Atlas网站中TENT5D基因在人体各个组织中的RNA表达丰度。数据分别来自 Consensus dataset、HPA dataset和GTEx dataset。 图3为本发明实施例1中患者TENT5D基因突变位点在基因组和蛋白结构域上的位 置。其中,(A)显示了TENT5D突变位点在基因组中的位置,(B)显示了TENT5D突变位点在 TENT5D的蛋白结构域上的位置,绿色框显示DUF1693结构域。 4 CN 111575364 A 说 明 书 3/9 页 图4为本发明实施例1中Sanger测序验证TENT5D基因突变符合X-连锁隐性遗传模 式的结果图。其中,Sanger测序确认患者是TENT5D基因c.G823T:p.E275X杂合突变携带者; 其父亲该位点未突变;其母亲是c.G823T:p.E275X杂合突变携带者。 图5为本发明实施例1中TENT5D基因突变无头精子症患者精子巴氏染色图。其中, Control为对照的精子,Patient为患者的精子,与正常对照相比,TENT5D基因突变的患者精 子形态明显异常,绝大部分精子头部缺失。 图6为本发明实施例1中TENT5D基因突变无头精子症患者精子透射电镜超微结构 图。其中,LC,纵向截面;对照精子结构完整的,患者的精子头部缺失;MP,中段精子的横截 面;对照和患者的精子均有完整的“9 2”微管结构,对照精子周围有完整的线粒体鞘(MS)包 围,患者精子的线粒体鞘(MS)不完整;PP,主段精子的横截面;对照和患者的精子均有完整 的“9 2”微管结构,周围均有完整的纤维鞘(FS)包围。 图7为本发明实施例1中患者精子中TENT5D蛋白的表达及定位结果图。其中,(A) Western Blot实验检测患者精子中TENT5D蛋白的表达;在对照精子中检测到明显的TENT5D 阳性条带,但是患者的精子样品中没有检测到TENT5D的表达;(B)免疫荧光染色实验分析患 者精子中TENT5D蛋白的表达及定位;在对照中TENT5D在精子头尾连接处高表达;在患者精 子的头部或鞭毛上均未观察到TENT5D的表达。蓝色:DAPI;绿色:Ac-Tubulin;红色:TENT5D 图8为本发明实施例1中小鼠中Tent5d基因在各个组织中的表达丰度。其中显示 NCBI数据库中Tent5d基因在小鼠各个组织中的表达丰度,Tent5d基因成年小鼠的睾丸组织 中特异性高表达。 图9为本发明实施例1中.CRISPR-Cas9技术构建TENT5D敲除小鼠模型gRNA设计。其 中具体显示了TENT5D敲除小鼠模型gRNA引物位置及序列。 图10为本发明实施例1中TENT5D基因敲除小鼠PCR结果图。其中,与对照组相比, TENT5D基因敲除小鼠PCR条带位置有明显差异,条带大小有显著降低。 图11为本发明实施例1中Tent5d基因敲除小鼠体重及生殖系统发育结果图。其中, Tent5d基因敲除的雄性小鼠的体重(A)、睾丸重量(B)、附睾重量(C)及附睾重量与体重比 (D);与对照组相比,Tent5d基因敲除成年小鼠体重、睾丸重量、附睾重量、附睾与体重的比 值均未见明显异常。 图12为本发明实施例1中TENT5D基因敲除小鼠睾丸HE染色图。其中,对照组成年小 鼠睾丸曲细精管内有各期生精细胞,包括:精原细胞、各级精母细胞、圆形精子和长形精子; 与对照组相比,Tent5d基因敲除小鼠睾丸曲细精管内有各期生精细胞,并未见明显异常。 图13为本发明实施例1中Tent5d基因敲除小鼠精子数量图。其中,(A)Tent5d基因 敲除小鼠附睾内精子数量与对照组相比明显降低(附睾的WT和KO精子依照精子鞭毛统计); (B)Tent5d基因敲除小鼠精子的无头比例与对照相比显著增加(WT和KO精子依照精子鞭毛 统计)。其中***:P<0.001。 图14为本发明实施例1中Tent5d基因敲除小鼠的精子形态图。其中,巴氏染色结果 显示,Tent5d基因敲除小鼠精子精子数量明显减少,精子头部缺失。 图15为本发明实施例1中Tent5d基因敲除小鼠的精子超微结构图。其中,LC处对照 精子头尾连接处连接完好,而Tent5d基因敲除小鼠的精子头部缺失。MP段透射电镜结果显 示,对照和Tent5d基因敲除小鼠的精子鞭毛轴丝均有完整的“9 2”微管结构,但是Tent5d基 5 CN 111575364 A 说 明 书 4/9 页 因敲除小鼠精子周围的线粒体鞘(MS)完整性遭到破损;在PP段Tent5d基因敲除小鼠的精子 也有完整的“9 2”微管结构,周围有完整的纤维鞘(FS)包围;Tent5d基因敲除小鼠精子超微 结构与对照组相比在头尾连接处断裂、头部缺失、线粒体鞘(MS)完整性遭到破坏。LC:纵切 横截面;MP,中段精子的横截面;PP,主段精子的横截面。