技术摘要:
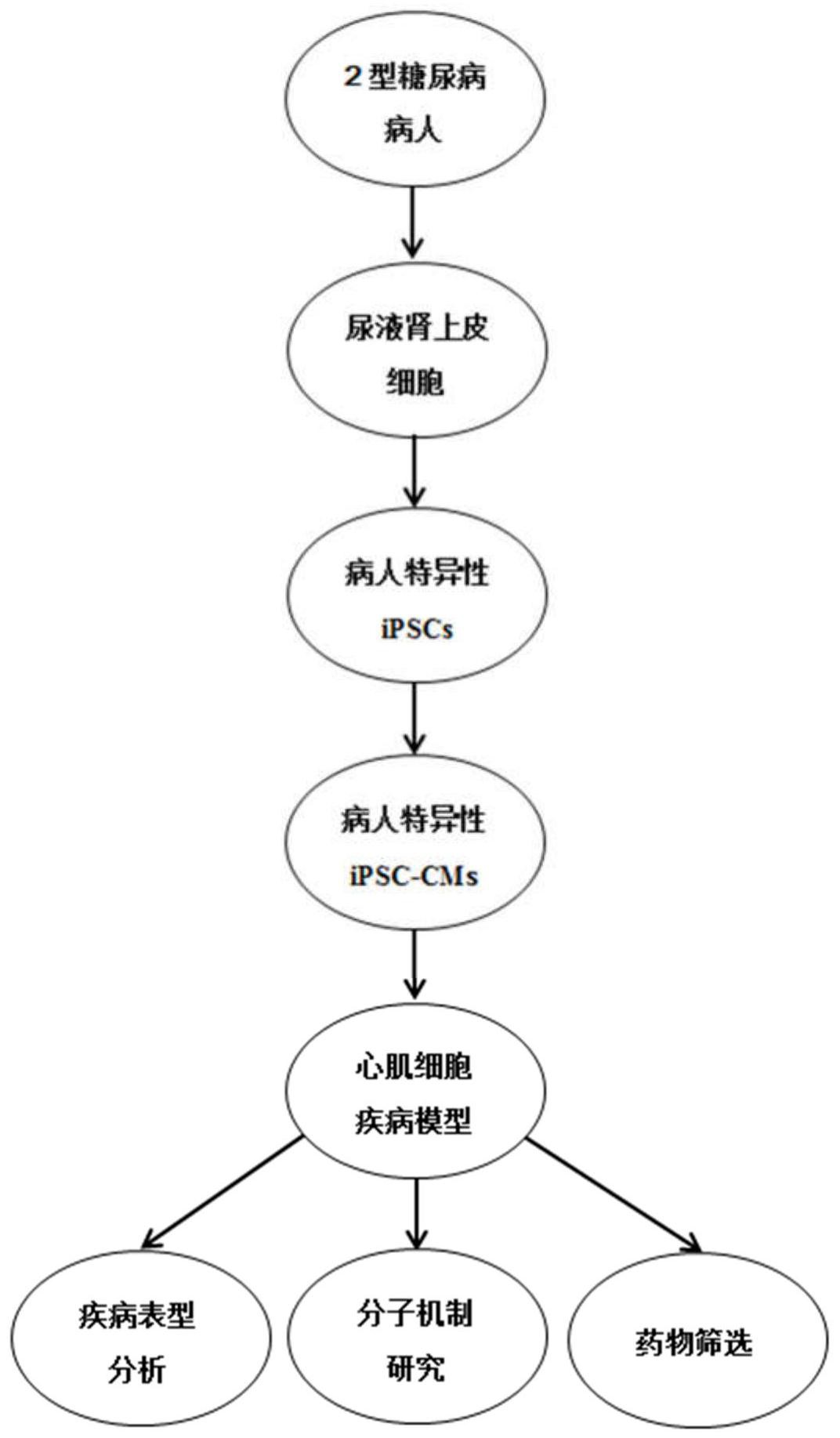
本发明公布了一种“人源性”糖尿病心肌病疾病模型的建立方法。本方法首先获取病人的尿液肾上皮细胞,然后将尿液肾上皮细胞重编程为iPSCs,进而将其进行定向分化获得病人特异性的心肌细胞(Cardiomyocytes,CMs),再利用这些心肌细胞建立一个稳定的二维体外心肌细胞疾病 全部
背景技术:
糖尿病是胰岛素分泌绝对或相对不足,并以高血糖、高血脂为病理特征的代谢紊 乱综合征。我国糖尿病患病率高达9.4%,远远超出全球平均水平,继发于糖尿病的心血管 并发症已成为糖尿病患者的主要死亡原因。其中,糖尿病心肌病是糖尿病患者的主要心脏 并发症之一,发病率高,危害大,与糖尿病病人心血管疾病的高发生率和高病死率密切相 关。糖尿病心肌病是糖尿病引起心脏微血管病变和心肌代谢紊乱所致的心肌广泛局灶性坏 死。早期通常表现为心肌顺应性降低和舒张期充盈受阻的舒张功能不全,晚期以收缩功能 不全为主,易发生充血性心力衰竭。大量的研究在动物模型中探讨了糖尿病发生中的心脏 功能异常以及可能的发生机制,其中包括:心肌代谢障碍、心脏电生理异常、心脏局部肾素- 血管紧张素系统异常、蛋白激酶C代谢异常、细胞外基质增生及心肌间质纤维化等。然而,糖 尿病心肌病发生的分子机制仍不明确。目前缺乏糖尿病心肌病合适的人源性疾病模型,造 成大多数研究只能在糖尿病动物模型中开展,阻碍了将这些研究结果向人类疾病的转化。 人诱导多能干细胞(induced pluripotent stem cells,iPSCs)的出现为转化医 学和再生医学提供了强大的动力和革命性的模式转变,拉近了干细胞用于临床疾病治疗的 距离,在疾病模型的建立、疾病分子机制的研究以及新药研发等方面具有巨大的潜在价值。 2006年,Takahashi和Yamanaka通过对4个特定转录因子 (Oct3/4,Sox2,c-Myc和Klf4,也称 为Yamanaka因子)的逆转录病毒介导的转导,建立了第一个诱导多能干细胞(iPSCs),最终 分化成小鼠成纤维细胞。这些由小鼠衍生的iPSCs的性质被发现与人胚胎干细胞的性质相 同。此后不久,人类体细胞被成功地重新编程到为iPSCs。由于iPSCs具有多能干细胞的明显 特征,包括无限的自我更新和多能性,它们被用于广泛的应用领域中,如细胞替代再生疗 法、发展生物学研究、疾病建模和药物筛选。最令人兴奋的iPSCs研究领域之一是疾病建模, 即iPSCs是由患有遗传疾病的病人产生的,即病人特异性iPSCs。将病人特异性iPSCs分化为 与疾病相关的细胞,为研究者提供了稳定、可再生的靶细胞替代来源进行疾病建模。到目前 为止,许多关于各种疾病的研究已经证明,病人特异性iPSCs模型系统可以再现与实际病人 相似的疾病表型,这些系统可以帮助我们更好地理解疾病的机制,并可能产生新的治疗策 略。
技术实现要素:
为此,本发明所要解决的技术问题在于现有的糖尿病心肌病疾病模型主要是动物 模型,具有明显的种属差异,其研究结果不能直接应用于人类疾病。从而本申请提出应用糖 尿病心肌病病人的尿液肾上皮细胞重编程为iPSCs,再将其定向分化为心肌细胞以建立稳 4 CN 111575227 A 说 明 书 2/7 页 定的携带特定突变位点的糖尿病心肌病体外疾病模型。该方法不需要繁琐的动物培养及建 模技术,利用与人的遗传背景相同的优势,其拥有人类心脏的电生理学特性,拥有人类心肌 细胞生化和分子生物学特性,拥有动物模型无法比拟的优势,纯化方便并且可以长时间体 外培养,可批量生产满足高通量实验需求缩短实验周期,以利于广泛用于疾病表型分析和 功能学研究,疾病分子机制研究,治疗药物筛选和安全性评估。 在本发明的实施例公开了一种“人源性”糖尿病心肌病疾病模型的建立方法,包括 如下步骤: A)2型糖尿病病人尿液肾上皮细胞的获得和培养; B)采用非整合型仙台病毒将病人的尿液肾上皮细胞重编程为病人特异性 iPSCs; C)将病人特异性iPSCs定向分化为病人特异性心肌细胞;得到“人源性”糖尿病心 肌病疾病模型。 作为本发明的优选方案,所述步骤A)具体包括如下步骤: A1)病人尿液的收集; A2)尿液肾上皮细胞的分离; A3)尿液肾上皮细胞的贴壁扩增; A4)尿液肾上皮细胞的传代培养。 作为本发明的优选方案,所述的步骤B)具体为: B1)在24孔板中种植尿液肾上皮细胞,每日更换新鲜尿液扩增培养基; B2)当细胞密度达到50-80%进行病毒感染,首先给细胞更换新鲜尿液扩增培养 基,然后取分装好的仙台病毒,冰上溶化,完全溶化后加入细胞中,水平晃动24孔板使培养 基和病毒均匀分布; B3)感染24小时后撤掉病毒液,更换新鲜的89%DMEM 10%FBS 1%双抗的培养基; 感染第2天不做任何处理,之后隔日以89%DMEM 10%FBS 1%双抗的培养基换液; B4)感染第7天,吸弃陈旧培养基后使用DPBS漂洗一遍,单孔加入0.25ml TrypLE消 化酶,置于5%CO2的37℃恒温细胞培养箱中3-5分钟,终止消化并 300g离心收集细胞,以 89%DMEM 10%FBS 1%双抗的培养基重悬细胞,接种于Matrigel包被的培养皿中,静置于 细胞培养箱中继续培养; B5)24小时后细胞贴壁,使用mTeSR培养基继续每日换液培养,直至在显微镜下观 察有克隆出现; CB6)待克隆长至适合挑取的大小,用枪头在显微镜下挑取单个克隆转移到 Matrigel包被12孔板中,此时的iPSCs为P1代细胞,继续使用mTeSR培养基培养; B7)克隆在12孔板中扩增7至10天后可进行传代,以0.5ml/孔的Accutase 消化细 胞,每孔细胞种植至Matrigel包被的6孔板的1个孔中,此时的iPSCs为 P2代细胞,并继续用 mTeSR培养基培养;待细胞长至80%,进行传代冻存,以 1:6-1:12的稀释比例传代培养; B8)待iPSCs传代至P19-21代。 作为本发明的优选方案,所述的步骤C)具体包括如下步骤: C1)第-5-0天iPSCs的培养; C2)第0-1天完成iPSCs向中胚层的诱导分化; C3)第2-3天完成中胚层向心脏中胚层的诱导转分化; 5 CN 111575227 A 说 明 书 3/7 页 C4)第3-5天完成中胚层向心肌细胞的诱导分化; C5)第7天以后以心肌细胞完全培养基持续培养,每日换液,第7-10天可看到成片 跳动的心肌细胞,第30天后,得到建立完成的“人源性”糖尿病心肌病疾病模型。其中,得到 “人源性”糖尿病心肌病疾病模型主要是心肌细胞的成熟过程。 作为本发明的优选方案,所述的步骤C1)具体包括如下步骤: C11)首先将iPSCs按1:8-1:12稀释比例接种至6孔板中; C12)每日更换mTeSR培养基; C13) ,至细胞密度达到80%左右进行分化操作。 作为本发明的优选方案,所述的步骤C2)中: 在分化开始的第0天,小心吸走陈旧培养基,使用心肌分化培养基 RPMI B27- Insulin清洗一遍,每孔加入含8μM的CHIR的心肌分化培养基2ml。心肌分化培养基(RPMI B27-Insulin)为RPMI 1640添加不有胰岛素的B27 (B27-Insulin)组成,体积比为500ml RPMI 1640:10ml B27-Insulin。 作为本发明的优选方案,所述的步骤C3)中: 持续作用2天后即第2天更换为新的心肌分化培养基,每孔2ml;第3天吸走陈旧培 养基,加入含5μM的IWR-1的心肌分化培养基,每孔2ml。 作为本发明的优选方案,所述的步骤C4)中:加入含5μM的IWR的心肌分化培养基持 续作用2天后即第5天,更换新的心肌分化培养基,每孔2ml。 作为本发明的优选方案,所述的步骤C5)中:持续作用2天后即第7天更换新的心肌 细胞完全培养基RPMI B27 Insulin,以心肌细胞完全培养基持续培养,每日换液,第7-10天 可看到成片跳动的心肌细胞,第20-30天,得到建立完成的“人源性”糖尿病心肌病疾病模 型。心肌细胞完全培养基 (RPMI B27 Insulin)为RPMI 1640添加含有胰岛素的B27(B27 Insulin)组成,体积比为500ml RPMI 1640:10ml B27 Insulin。 本发明的有益效果在于:本发明使用与人的遗传背景相同糖尿病心肌病病人特异 性的心肌细胞进行疾病表型分析和功能学研究,疾病分子机制研究,治疗药物筛选和安全 性评估,有望将研究成果迅速运用于现有的临床治疗过程中,实现科研与临床地快速转化, 推动医学研究的快速发展和应用。 附图说明 以下附图仅旨在于对本发明做示意性说明和解释,并不限定本发明的范围。 其中: 图1为本发明1个实施例的一种2型糖尿病病人特异性的iPSC的建立和多能性特征 鉴定的代表图; 图2为本发明1个实施例的一种2型糖尿病病人特异性iPSC衍生的心肌细胞(iPSC- CMs)具有心肌细胞肥大表型的代表图; 图3为本发明1个实施例的一种2型糖尿病病人特异性iPSC-CMs具有脂质沉积表型 的代表图; 图4为本发明1个实施例的一种对2型糖尿病病人特异性iPSC-CMs具有心律失常表 型的代表图; 6 CN 111575227 A 说 明 书 4/7 页 图5为本发明1个实施例的一种2型糖尿病病人特异性iPSC-CMs具有线粒体结构和 功能异常表型的代表图; 图6为本发明1个实施例的一种使用高糖髙脂诱导2型糖尿病病人特异性 iPSC- CMs出现凋亡信号增加表型的代表图; 图7为本发明方法的流程示意图。












