技术摘要:
本申请实施例公开了一种抑制细菌生物被膜形成的方法,具体为使用有效量的所述香豆素‑查尔酮复合物处理细菌。在抑制细菌被膜形成的同时可以减少细菌的毒性,并且与抗生素联用可以增强细菌对于抗生素的敏感性。本申请实施例还公开了一种组合物,所述组合物包括有效量的 全部
背景技术:
生物被膜(或称“菌膜”)通常是指由胞外聚合物包裹的微生物群体,并且在自然、 工业和医疗等领域中普遍存在。生物被膜可以增强微生物的存活性,使它们能够共同适应 不断变化的条件。例如,在医学研究中,研究表明约65%的人类细菌感染与生物被膜有关, 并且生物被膜中微生物的抗生素抗性比游离状态的微生物高数百甚至数千倍。生物被膜细 菌对抗生素和宿主免疫系统具有很强的抵抗力,从而导致严重的临床问题,引起许多慢性 和难治性感染疾病。 生物被膜最重要的特征之一是自我分泌的EPS(Extracellular Polymeric Substances,胞外多聚物),主要由多糖、蛋白质和细胞外DNA(eDNA)组成,其作为基质或凝 胶,将生物被膜细胞保持在一起,保护细胞免受抗生素和流体中的剪切力环境。通过形成基 质包裹的多细胞聚集体,细胞也可以逃避哺乳动物宿主中巨噬细胞的吞噬。EPS不仅促进微 生物(例如,细菌)附着于各种表面(例如,生物医学材料或生物体的粘膜表面),还可以捕获 抗生素或减少抗生素渗入微生物所形成的细菌群落。因此,在某些情况下,大多数药物只能 杀死生物被膜外层的微生物,但是生物被膜内的微生物却能够逃避抗生素的杀伤作用而得 以持续生存下去,这也是细菌产生耐药性的一个主要原因。因此,生物被膜是一种潜在的持 续感染源,其可能引起与临床生物被膜相关的难治性感染。 细菌的另外一个特征则是能够产生具有毒性的毒力因子,如铜绿假单胞菌能够产 生嗜铁素、绿菌素和蛋白酶等多种毒力因子来侵染受感染的寄主细胞。而毒力因子的产生 则受到一套精确调控的系统控制。目前已知研究最为广泛的是微生物群体感应系统 (Quorum sensing,QS)。在铜绿假单胞菌中,存在着至少三种以上的QS系统,分别是LasR/ LasI,RhlR/RhlI和PQS系统。三个系统分别相互作用并调节不同的毒力因子的表达,最终达 到控制细菌毒力的效果。因此,近些年来研究人员针对这三个系统开发了很多化学抑制剂 以达到阻止该类病原细菌引起的侵染。然而仍然存在许多问题,如成本高、效果不够理想以 及抑制机理不清楚等问题。因此,迫切需要开发用于有效抑制由微生物形成的生物被膜的 制剂(例如,组合物)和方法。
技术实现要素:
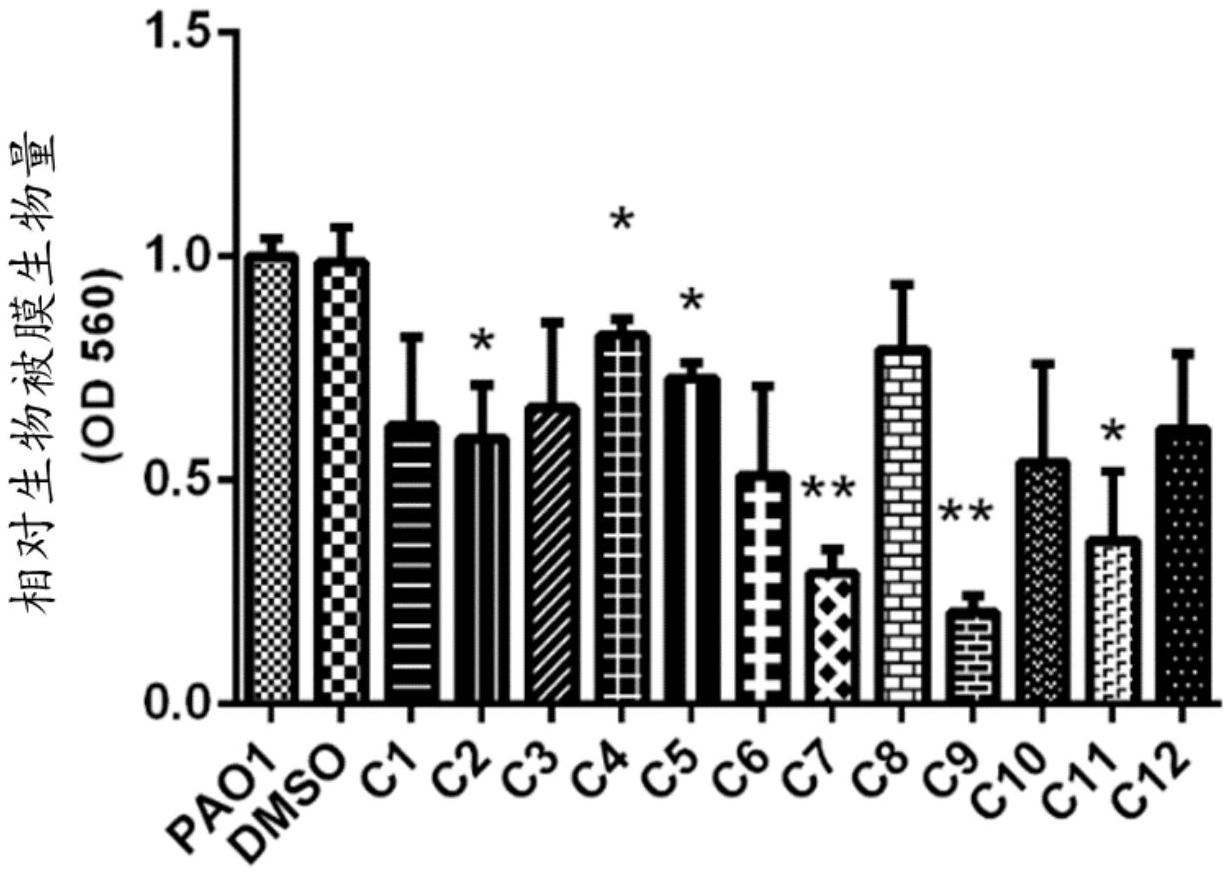
本申请一方面提供了一种抑制细菌生物被膜形成的方法。所述方法包括使用有效 量的香豆素-查尔酮复合物处理细菌,所述香豆素-查尔酮复合物的分子结构如下: 或 5 CN 111615387 A 说 明 书 2/15 页 其中,R1选自-H、-CH3、-OCH3、-Cl、-Br、-F、-OH、-NO2;R2选自-OCH3、-Cl、-Br、-NO2。 在一些实施例中,所述香豆素-查尔酮复合物通过在转录水平上减少细菌内Ps1多 糖的产生抑制生物被膜形成。 在一些实施例中,所述香豆素-查尔酮复合物通过降低细胞内c-di-GMP的水平抑 制生物被膜形成,所述c-di-GMP能促进游离微生物转换为生物被膜。 在一些实施例中,所述香豆素-查尔酮复合物通过减少群体感应抑制生物被膜形 成,其中通过下调细菌的群体感应基因的表达以达到减少群体感应调控的毒力因子,所述 群体感应基因包括lasR,rhlR或pqsR中的至少一个。 在一些实施例中,所述有效量的香豆素-查尔酮复合物的浓度约为5mM。 在一些实施例中,在其他条件相同时,所述有效量的香豆素-查尔酮复合物抑制至 少30%的生物被膜的生成。 在一些实施例中,所述有效量的香豆素-查尔酮复合物进一步减少细菌的毒性。 在一些实施例中,所述细菌包括革兰氏阴性细菌。 在一些实施例中,所述革兰氏阴性细菌包括铜绿假单胞菌或大肠杆菌。 在一些实施例中,所述细菌包括革兰氏阳性细菌。 在一些实施例中,所述革兰氏阳性细菌包括金黄色葡萄球菌。 在一些实施例中,在其他条件相同时,所述有效量的香豆素-查尔酮复合物抑制至 少50%的生物被膜的生成。 在一些实施例中,在其他条件相同时,所述有效量的香豆素-查尔酮复合物抑制至 少60%的生物被膜的生成。 在一些实施例中,所述细菌为金黄色葡萄球菌,且在其他条件相同时,所述有效量 的香豆素-查尔酮复合物抑制至少30%的金黄色葡萄球菌生物被膜的生成。 在一些实施例中,所述细菌为大肠杆菌,且在其他条件相同时,所述有效量的香豆 素-查尔酮复合物抑制至少60%的大肠杆菌生物被膜的生成。 在一些实施例中,所述细菌为铜绿假单胞菌,且在其他条件相同时,所述有效量的 香豆素-查尔酮复合物抑制至少70%的铜绿假单胞菌生物被膜的生成。 在一些实施例中,所述香豆素-查尔酮复合物的结构式如下: 本申请的另一方面提供一种用以抑制生物被膜形成的组合物。所述组合物包括有 效量的香豆素-查尔酮复合物,其分子结构如下: 或 6 CN 111615387 A 说 明 书 3/15 页 其中,R1选自-H、-CH3、-OCH3、-Cl、-Br、-F、-OH、-NO2;R2选自-OCH3、-Cl、-Br、-NO2。 在一些实施例中,所述组合物被配置为在转录水平上减少Ps1多糖的产生。 在一些实施例中,所述组合物被配置为通过降低细胞内c-di-GMP的水平抑制生物 被膜形成,所述c-di-GMP能够促进游离生物转换为生物被膜。 在一些实施例中,所述组合物被配置为通过减少群体感应抑制生物被膜形成,其 中通过下调细菌的群体感应基因的表达以达到减少群体感应调控的毒力因子,所述群体感 应基因包括lasR,rhlR或pqsR中的至少一个。 在一些实施例中,所述有效量的香豆素-查尔酮复合物的浓度约为5mM。 在一些实施例中,在其他条件相同时,所述有效量的香豆素-查尔酮复合物抑制至 少30%的生物被膜的生成。 在一些实施例中,所述组合物进一步被配置为减少所述细菌的毒性。 在一些实施例中,所述细菌包括革兰氏阴性细菌。 在一些实施例中,所述革兰氏阴性细菌包括辋绿假单胞菌或大肠杆菌。 在一些实施例中,所述细菌包括革兰氏阳性细菌。 在一些实施例中,所述革兰氏阳性细菌包括金黄色葡萄球菌。 在一些实施例中,所述细菌为金黄色葡萄球菌,且在其他条件相同时,所述有效量 的香豆素-查尔酮复合物抑制至少30%的金黄色葡萄球菌生物被膜的生成。 在一些实施例中,所述细菌为大肠杆菌,且在其他条件相同时,所述有效量的香豆 素-查尔酮复合物抑制至少60%的大肠杆菌生物被膜的生成。 在一些实施例中,所述细菌为铜绿假单胞菌,且在其他条件相同时,所述有效量的 香豆素-查尔酮复合物抑制至少70%的铜绿假单胞菌生物被膜的生成。 在一些实施例中,所述组合物进一步包括抗生素,所述抗生素包括以下至少一种: 阿莫西林、多西环素、四环素、米诺环素、头孢氨苄、头孢呋辛、环丙沙星、莫西沙星、克林霉 素、林可霉素、克拉霉素、阿奇霉素、磺胺吡啶、磺胺沙唑、达巴万辛、奥托拉万辛、庆大霉素、 妥布霉素、美罗培南、多利培南、甲硝唑、阿奇霉素、左氧氟沙星。 在一些实施例中,所述组合物进一步被配置为增强所述细菌对所述抗生素的敏感 性。 在一些实施例中,所述组合物进一步被配置为降低所述抗生素的最小抑菌浓度以 及最小生物被清除浓度。 在一些实施例中,其特征在于,所述有效量的香豆素-查尔酮复合物的浓度约为 5mM。 在一些实施例中,所述组合物包含的香豆素-查尔酮复合物的结构式如下: 7 CN 111615387 A 说 明 书 4/15 页 附图说明 本申请将以示例性实施例的方式进一步说明,这些示例性实施例将通过附图进行 详细描述。这些实施例并非限制性的,在这些实施例中,相同的编号表示相同的结构,其中: 图1是所述香豆素-查尔酮复合物(C1-C12)对于细菌生物被膜的抑制效果的示意 图; 图2是空白组、对照组和所述香豆素-查尔酮复合物C9处理后的实验组的细菌生长 曲线; 图3是空白组、对照组和所述香豆素-查尔酮复合物C9处理后的实验组的对于细菌 运动性的影响的示意图; 图4是空白组、对照组和所述香豆素-查尔酮复合物C9处理后的实验组的Psl多糖 产生的示意图; 图5是空白组、对照组和所述香豆素-查尔酮复合物C9处理后的实验组的pslA:: lacZ的转录活性的示意图; 图6是空白组、对照组和所述香豆素-查尔酮复合物C9处理后的实验组的细胞内c- di-GMP水平的示意图; 图7是空白组、对照组和所述香豆素-查尔酮复合物C9处理后的实验组的细胞内c- di-GMP水平的另一示意图; 图8A至图8D是空白组、对照组和所述香豆素-查尔酮复合物C9处理后的实验组的 细胞内QS基因表达的示意图; 图9是所述香豆素-查尔酮复合物C9与QS调节子的结合的示意图; 图10是空白组、对照组和所述香豆素-查尔酮复合物C9处理后的实验组的细菌的 毒力的示意图; 图11A至图11C是所述香豆素-查尔酮复合物C9的稳定性的示意图; 图12是所述香豆素-查尔酮复合物C9抑制金黄色葡萄球菌和大肠杆菌形成的细菌 生物被膜的示意图; 图13是所述香豆素-查尔酮复合物C9增强抗生素药物的敏感性的示意图; 图14A至图14B是所述香豆素-查尔酮复合物C9降低细菌生物被膜对药物的最小抑 菌浓度的示意图。 图15A至图15B是所述香豆素-查尔酮复合物C9降低细菌生物被膜对药物的最小生 物被膜浓度的示意图。












