技术摘要:
本发明涉及本发明涉及miRNA运载体系验证方法,先对炔键修饰的双链miR‑34a的生物活性测试反应,并在miR‑34a被成功负载到碳点表面之后,然后进行在体外在还原性环境中对miR‑34a释放表征测试反应;根据癌细胞内还原性物种的浓度高于细胞外还原性物种浓度,分别测试在不 全部
背景技术:
人工合成的miRNA类似物(miRNA mimics)以及miRNA抑制剂(miRNA inhibitor)被 证明是有效的调控生物体内miRNA水平的生物活性大分子,越来越多的应用在miRNA的人为 调控以及临床研究当中。然而由于负电性影响,人工合成的miRNA类似物以及miRNA抑制剂 自身很难通过细胞膜而进入到细胞内部,因此需要发展运输载体实现miRNA类似物以及 miRNA抑制剂的细胞内运输,但对于其运送体系的效率及表征等还没有准确的验证方法,基 于本课题组前期对miRNA运载工具的研究,我们设计了一种还原响应型的miRNA输运体系验 证方法。
技术实现要素:
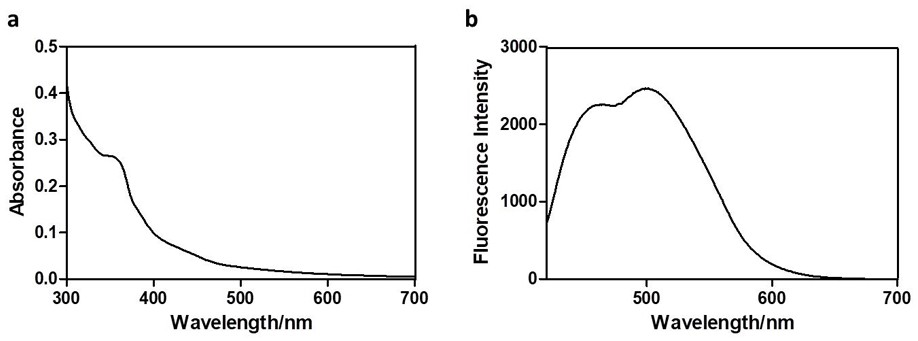
本发明目的是为了克服现有技术的不足而提供一种验证方法设计合理、验证手段 清晰且结果精准度高的miRNA运载体系验证方法。 下面关于后续技术方案表述中涉及的专业名词解释如下: miRNA是MicroRNA 的简称,属于一类由内源基因编码的长度约为22 个核苷酸的非编 码单链RNA分子; PBS是磷酸缓冲盐溶液(phosphate buffer saline),一般作为溶剂,起溶解保护试剂 的作用; Cu(I)是指一价铜的化合物,Cu(II)的化合物主要是氧化物和氢氧化物,卤化物,硫化 物,配合物等; Click反应是指点击化学(Click chemistry),又译为“链接化学”、“速配接合组合式化 学”,是由化学家巴里·夏普莱斯(K B Sharpless)在2001年引入的一个合成概念,主旨是 通过小单元的拼接,来快速可靠地完成形形色色分子的化学合成; Luciferase Assay是指荧光素酶报告基因法; MTT法又称MTT比色法,是一种检测细胞存活和生长的方法; DMEM是一种含各种氨基酸和葡萄糖的培养基; GSH是指谷胱甘肽(glutathione,r-glutamyl cysteingl glycine)是一种含γ-酰胺 键和巯基的三肽,由谷氨酸、半胱氨酸及甘氨酸组成,存在于几乎身体的每一个细胞; SIRT1是指人类信息沉默因子1,属于一种需要烟酰胺腺嘌呤双核苷酸(NAD )参与反应 的去乙酰化酶,该蛋白通过催化多种蛋白和转录因子来参与许多重要的生理过程。 ×g是指离心力单位数值,通常离心力常用地球引力的倍数来表示,因而称为相对 离心力“RCF”或者用数字乘“g”来表示,例如25000×g,则表示相对离心力为25000。 为达到上述目的,本发明采用了如下技术方案。 一种miRNA运载体系验证方法,具体包括如下步骤: 4 CN 111607619 A 说 明 书 2/7 页 步骤一:先利用荧光素酶报告基因法对炔键修饰的双链miR-34a的生物活性测试反应, 通过并在miR-34a被成功负载到碳点表面之后,然后进行在体外在还原性环境中对miR-34a 释放表征测试反应; 步骤二:根据细胞外各种酶发挥作用差异情况,癌细胞内还原性物种的浓度高于细胞 外还原性物种浓度,分别测试该输运系统在10 mM以及2μM的GSH环境下miR-34a的释放数 据; 步骤三:在所述步骤二测试过负载miR-34a的碳点可以在体外进行释放数据后,然后进 行细胞实验测试其向细胞内输运miRNA效率数据; 步骤四:在所述步骤三中测算过细胞内运输miRNA效率指标参数后,接下来测试该输运 系统对癌细胞中miR-34a的运输以及可控性释放数据,最后验证运输到细胞内的miR-34a正 常发挥功能反应数据;最终得到该基于碳点的还原响应型miRNA输运系统验证结果。 作为本发明的进一步改进,所述步骤一中对炔键修饰的双链miR-34a的生物活性 测试,具体包括利用miRNA可以通过与靶基因3’-UTR中的一个段位点进行不完全互补配对 从而抑制该靶基因翻译,将靶基因中的该段位点插入到基因的3’-UTR,使miRNA与该段位点 结合后抑制荧光素酶的产生,miRNA活性越高或表达量越大则荧光素酶产生的量越少,通过 加入过量的荧光素酶底物检测生物发光信号便可检测出细胞内荧光素酶的表达量,从而测 试反应出细胞内miRNA的活性以及表达量数据。 作为本发明的进一步改进,所述步骤三中输运miRNA效率数据的测试,具体包括如 下: 首先,通过MTT实验验证表征修饰连接子的碳点作为载体的生物相容性,验证得到在浓 度达到200 μg/mL,该载体仍然具有较低的细胞毒性; 随后,将负载了miR-34a的碳点(miR-34a loaded carbon dots, MLCDs)与人宫颈癌细 胞HeLa共孵育24 h后,通过QPCR检测细胞内miR-34a的表达情况,验证得到当HeLa细胞与负 载了miR-34a的碳点共孵育时,细胞内miR-34a的表达才会明显上调; 最后,通过激光共聚焦显微镜检测负载了Cy3标记miR-34a的碳点与HeLa细胞共孵育24 h后,Cy3标记的miR-34a以及碳点在细胞内的分布数据,发现24 h后,在细胞内可以检测到 miR-34a的信号以及碳点的荧光信号,且两者不能完全重合,最终验证了该体系可实现向细 胞内运输miR-34a,同时该体系在细胞内也可被还原从而释放出miR-34a。 作为本发明的进一步改进,所述步骤四中验证运输到细胞内的miR-34a正常发挥 功能数据,具体包括如下: 首先,利用Luciferase Assay验证运输到细胞内的miR-34a可以正常发挥功能,同样 的,将miR-34a的靶基因SIRT1的3’UTR可以与miR-34a结合的一段序列克隆至Luciferase报 告质粒的Luciferase的3’UTR端,构建得到pMIR-miR-34a Luciferase报告质粒,将该报告 质粒转染到HeLa细胞中,4 h后加入负载有miR-34a的碳点共孵育48 h后检测细胞内 luciferase信号变化数据;当加入负载有miR-34a的碳点共孵育48 h后细胞内luciferase 信号降低,验证利用该输运系统运输进细胞的miRNA可以正常发挥功能; 随后,进行再次验证,将检测加入负载有miR-34a的碳点共孵育48 h后细胞内SIRT1蛋 白的表达水平数据,当加入负载有miR-34a的碳点共孵育48 h后细胞内SIRT1蛋白的表达量 下调,再次验证利用该输运系统运输进细胞的miRNA可以正常发挥功能。 5 CN 111607619 A 说 明 书 3/7 页 由于上述技术方案的运用,本技术方案具有的有益技术效果: (1)本技术方案利用miRNA的3’末端氨基与炔基琥珀酰亚胺酯之间的氨交换反应,合成 了3’炔键修饰的miR-34a,通过高效液相色谱以及冷冻干燥机对产物进行纯化,纯化后的3’ 炔键修饰的miR-34a可通过质谱进行表征,为实现对其表征效果验证提供了基础; (2)本技术方案通过MTT实验表征了修饰后连接子的碳点作为载体的生物相容性,从 MTT实验结果可以看出,即使浓度达到200 μg/mL,该载体仍然具有较低的细胞毒性; (3)本技术方案还将负载了miR-34a的碳点(miR-34a loaded carbon dots, MLCDs)与 人宫颈癌细胞HeLa共孵育24 h后,通过QPCR检测细胞内miR-34a的表达情况可以发现,仅当 HeLa细胞与负载了miR-34a的碳点共孵育时,细胞内miR-34a的表达才会明显上调; (4)本技术方案同时通过激光共聚焦显微镜检测负载了Cy3标记miR-34a的碳点与HeLa 细胞共孵育24 h后,Cy3标记的miR-34a以及碳点在细胞内的分布情况,发现24 h后,在细胞 内可以检测到miR-34a的信号以及碳点的荧光信号,且两者不能完全重合,提示该体系可以 实现向细胞内运输miR-34a的目的,同时该体系在细胞内可以被还原从而释放出miR-34a。 附图说明 附图1为本发明氨基修饰碳点的紫外与荧光光谱,以及紫外吸收光谱 (b) 405 nm 波长激发下的荧光光谱测试图; 附图2为本发明碳点的TEM以及 DLS表征结果图; 附图3为本发明负载有miR-34a的碳点在不同浓度GSH环境下对miR-34a的释放情况检 测结果示图; 附图4为本发明不同浓度的碳点与HeLa细胞共孵育48 h后通过MTT检测细胞活力变化 情况示意图; 附图5为本发明通过qRT-PCR检测与叠氮修饰的碳点、游离的miR-34a、负载有miR-34a 的碳点孵育24 h后,HeLa细胞内miR-34a表达量变化情况示意图; 附图6为本发明转染Luciferase报告基因的HeLa细胞分别转染miR-34a以及Alkyne- miR-34a,48 h后细胞内Luciferase信号变化情况示意图; 附图7为本发明转染Luciferase报告基因的HeLa细胞分别经过叠氮修饰的碳点、游离 的miR-34a、负载有miR-34a的碳点处理48 h后细胞内Luciferase信号变化情况示意图; 附图8为本发明HeLa细胞分别经过叠氮修饰的碳点、游离的miR-34a、负载有miR-34a的 碳点处理48 h后细胞内SIRT1蛋白变化情况示意图。












