技术摘要:
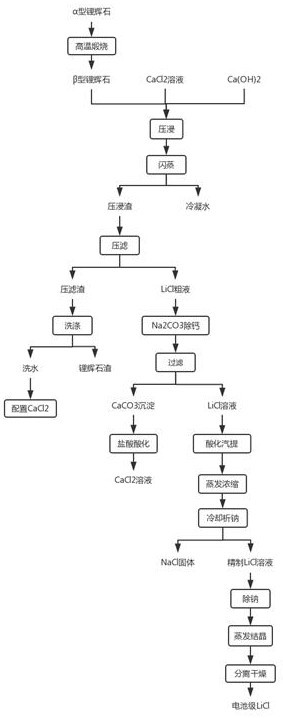
本发明公开了一种锂辉石压浸制备电池级氯化锂的方法,以锂辉石为原料,包含如下制备步骤:将高温煅烧转型后的β锂辉石与CaCl2溶液和少量的Ca(OH)2溶液在高温高压下压浸反应,闪蒸、压滤得到LiCl粗液,经Na2CO3除钙后过滤得到LiCl溶液,然后经过酸化汽提、蒸发浓缩、冷 全部
背景技术:
氯化锂是一种白色,具有NaCl型面心晶格的规则晶体。它吸湿性很强,极易溶于 水,溶于甲醇、乙醇、吡啶等有机溶剂。氯化锂的用途广泛,主要用于电解制备金属锂、铝的 焊剂和钎剂及非冷冻型空调机中的吸湿剂等。氯化锂是制取金属锂的原料,电解生产金属 锂是氯化锂消耗量最大的领域。金属锂及其合金和化合物在原子能工业、冶金工业、电池、 玻璃、化工、航天工业等许多领域具有广泛的应用。由于近年来锂电池和生物制药行业的高 速发展,高纯度的金属锂和锂化合物的需求也大大增加,而氯化锂作为金属锂的主要原料, 氯化锂的品质高低对金属锂的品质有根本的影响。 氯化锂的制备原料与其它锂及锂的化合物原料相同,主要从锂辉石、锂云母以及 含锂离子的盐湖卤水、地下卤水和海水中获得。我国主要采用锂辉石提锂制备。锂辉石是一 类含锂矿物,其主要成分为Li2O、SiO2、Al2O3等,其中锂辉石精矿中Li2O含量约为6.3%~ 7.5%。锂辉石提锂的方法主要有硫酸酸化焙烧法、石灰石烧结法、纯碱压煮法等。硫酸烘焙 法是将高温转型后的β锂辉石与一定比例的硫酸混合在250~300℃下进行焙烧,酸化焙烧 料用水浸出,同时加入Ca0或CaCO3进行中和,得到Li2SO4溶液;将Li2SO4溶液与CaCl2反应可 得到LiCl粗液,然后经过除杂就能得到LiCl产物。硫酸焙烧法是目前国内外提锂的主要方 法,发展较为成熟,工业应用也最广泛。石灰石烧结法是将锂辉石和石灰石按一定的重量比 配料,混合磨制调配后在1000~1200℃下烧结生产铝酸锂和硅酸钙,再经湿磨粉碎,用洗液 浸出铝酸锂,经沉降过滤,浸出液蒸发浓缩后,加入纯碱生成碳酸锂;碳酸锂加入盐酸酸化 可制备氯化锂。石灰石烧结法的优点是辅料价廉易得、流程简单;缺点是浸出液浓度低,蒸 发耗能大,锂的回收率低。纯碱压煮法是用过量的Na2CO3溶液在一定压力下处理β锂辉石,将 其中的锂置换为碳酸锂结晶;然后再用盐酸酸化碳酸锂制备氯化锂;该方法流程较短,成本 较低,但工艺所需条件较为苛刻。 硫酸酸化焙烧法、石灰石烧结法、纯碱压煮法等制备LiCl方法通常是先提锂制备 成Li2SO4、Li2CO3、LiAlO2等中间产物然后再转换生成LiCl,无法从锂辉石中直接生成LiCl。 在转换过程中容易引入新的杂质,除杂比较困难,增加了许多工序,制备方法较为复杂。而 且产物通常杂质较多,无法达到电池级氯化锂的标准,需要进一步精制。
技术实现要素:
本发明的目的在于针对现有技术的缺陷和不足,提供一种锂辉石压浸制备电池级 氯化锂的方法,无需高温焙烧锂辉石,没有生成中间产物,且部分原料可循环使用,具有工 艺简单、能耗少、成本低等优点。 为实现上述目的,本发明采用的技术方案是:它包含以下步骤: 3 CN 111592017 A 说 明 书 2/6 页 S1、高温转型:将锂辉石放入1000~1100℃高温下焙烧,使锂辉石转化由α型为活 泼的β型锂辉石; S2、压浸:将转型后的β锂辉石与CaCl2溶液和少量的Ca(OH)2混合后放入高压反应 釜中密封,加热搅拌; S3、闪蒸:将高温高压的压浸流体减压进入闪蒸罐中,流体汽化后气液分离;其中 水蒸气可液化得到冷凝水,冷凝水可回收后用于洗涤过滤和配置 CaCl2溶液,循环使用; S4、压滤:将闪蒸得到的液体组分进行加压过滤,得到压滤渣和LiCl粗液; S5、洗涤:压滤渣经冷凝水洗涤后过滤,可得到锂辉石矿渣和洗水部分,其中洗水 部分可用于配置CaCl2溶液; S6、NaCO3除钙:LiCl粗液中加入纯碱后混合均匀,生成CaCO3沉淀后过滤去除钙杂 质,并除去溶液中的Mg、Fe杂质; S7、酸化汽提:采用过量的盐酸调节溶液PH=2~3,使溶液酸化后再用汽提法除去 生成的CO2;采用汽提法收集反应生成的CO2,可减少设备腐蚀,同时防止气体进入设备造成 设备压强过大; S8、蒸发浓缩:将处理后的溶液三效蒸发浓缩至LiCl质量百分比浓度 35%~ 45%; S9、冷却析钠:将浓缩溶液冷却至常温,析出部分NaCl晶体;过滤分离除去氯化钠 固体,得到低钠含量的氯化锂溶液; S10、钠离子吸附剂除钠:采用离子筛型钠离子吸附剂吸附除钠; S11、蒸发结晶:将除杂后的LiCl溶液蒸发结晶; S12、分离干燥:采用离心机将晶体过滤分离,通过盘式干燥机干燥后进行包装,最 终得到电池级氯化锂产品。 进一步地,步骤S2中,加热温度控制在160~200℃之间,压力设置在 1 .2~ 1.8MPa,搅拌转速为300-500r/min,压浸时间约为0.5-3h。 进一步地,步骤S6中,LiCl粗液中加入纯碱后产生的Na2CO3,调节溶液 PH=9~10, 除杂后溶液中Ca2 含量低于0.0001%; 进一步地,步骤S6中生成的CaCO3可回收后用盐酸酸化制备CaCl2溶液用于步骤1 中,循环使用; 进一步地,步骤S10中钠离子吸附剂的制备方法为:将钠盐和含锰物质混合经煅烧 后得到前驱体NaxMnO2,将前驱体与盐酸混合,混合比例为n (NaxMnO2):n(HCl)=(1:0.1~ 0.01),然后再经过洗涤、过滤、干燥,最终得到离子筛型钠离子吸附剂。 本发明与其它氯化锂产品制备方法相比,具有以下特点: 1、锂辉石与氯化钙溶液主要发生如下反应: CaO H2O→Ca(OH)2 在高压反应釜中按反应方程式计量比加入烧结过的β锂辉石、水、氯化钙溶液和少 量的氢氧化钙,其中CaCl2约过量5~10%,Ca(OH)2添加量约为锂辉石含量的1~2%,加入水 调整固液比为1:3~1:4;加入少量Ca(OH)2可以提高 LiCl的转化率;锂辉石与氯化钙溶液 的反应为可逆反应,由于同离子效应影响,溶液中含有少量的Ca(OH)2可以使溶液中CaCl2含 4 CN 111592017 A 说 明 书 3/6 页 量降低,有利于反应方向向生成LiCl方向移动,提高氯化锂的生成率。 2、溶液酸化汽提反应方程式为: 加入过量的盐酸调整溶液PH至2~3可除去多余的CO 2-3 离子,采用汽提法吸收生成 的CO2经冷凝液吸收净化后放空至大气,可减少酸性气体对设备的腐蚀,同时防止CO2进入设 备中造成高压影响生产安全。 3、由于氯化锂溶液中钠离子与锂离子性质相似,所以氯化钠是氯化锂生产制备工 艺中和后期最难去除的杂质;常用的去除方法有溶液萃取法、离子交换法、盐析法等;但这 些方法大多需要引入新的杂质,后期处理较复杂。本发明主要采用冷却析钠和离子吸附剂 吸附两种方法共同作用除氯化钠: (1)利用同离子效应和锂、钠氯化物体系溶解度随温度变化,采用常温析钠法去除 NaCl,经过常温析钠的氯化锂溶液钠离子含量低于1g/l; (2)采用离子筛型钠离子吸附剂除杂,本发明中所述的离子筛型钠离子吸附剂对 钠离子的去除率在98%以上,较高时可达到99%,适合高浓度氯化锂溶液除钠,将使用过的 离子筛型离子吸附剂残渣与盐酸混合后你能实现再生,可以重复使用。 这两种方法工艺简单,不会引入新的杂质,除杂效果好;经两种方法除杂后得到的 氯化锂中钠杂质含量低于0.0015%,满足电池级氯化锂中钠杂质含量要求。 4、使用CaCl2、Ca(OH)2等原料价格低廉、来源广泛,且制备工艺过程中产生的冷凝 水、CaCO3、离子筛型钠离子吸附剂等中间产物均可回收处理后重复使用,节约了物料,实现 了资源的循环利用,大大降低了成本。 5、本发明区别于传统的锂辉石制备氯化锂方法,不需要先制备硫酸锂、碳酸锂、铝 酸锂等中间产物后再与盐酸反应生成氯化锂,直接通过锂辉石与 CaCl2溶液压浸反应一步 法得到氯化锂溶液;制备的电池级氯化锂的成分质量百分比浓度满足(LiCl)≥99.50%,Na ≤0.0015%,K≤0.05%,Fe≤0.0003%, Ca≤0.0025%,Ba≤0.01%,SO 2-4 ≤0.002%,Mg≤ 0.0005%,Cu≤0.0005%,盐酸不溶物≤0.003%,白度≥85,满足电池级无水氯化锂的标 准。 采用上述方案后,本发明有益效果为:本发明所述的一种锂辉石压浸制备电池级 氯化锂的方法,工艺简单、尤其是除钠的方法简单有效,杂质含量低、能耗低、成本低、产品 质量稳定。 附图说明 为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现 有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本 发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可 以根据这些附图获得其他的附图。 图1是本发明锂辉石压浸法制备电池级氯化锂的工艺流程图。












