技术摘要:
本发明总体上涉及包含酮洛芬赖氨酸盐和甘露醇的速释药物组合物。特别地,本发明涉及为片剂形式的速释药物组合物。本发明还提供了用于制造这样的组合物的方法。
背景技术:
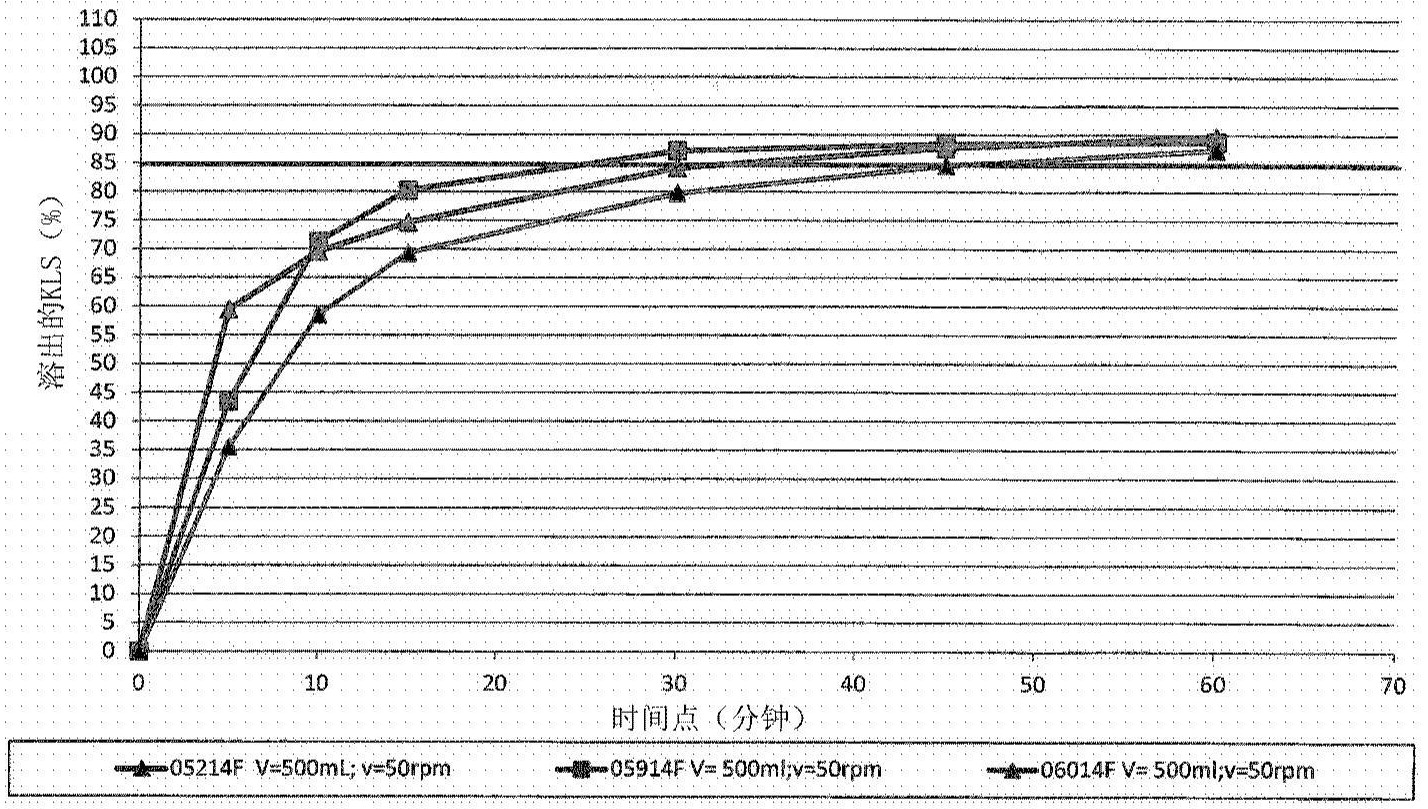
酮洛芬是具有镇痛和解热作用的丙酸类的非甾体抗炎药(nonsteroidal anti- inflammatory drug,NSAID)之一。 酮洛芬通常被开处方用于关节炎相关炎性疼痛或导致齿龈炎症的严重牙痛。酮洛 芬表面贴剂正用于治疗肌肉骨骼疼痛。 酮洛芬还可以以还可包含其他药剂的乳膏剂、软膏剂、液体剂、喷雾剂或凝胶剂的 形式用于治疗一些疼痛,尤其是神经疼痛,例如坐骨神经痛、疱疹后神经痛和神经根病变的 牵涉性痛。 已评估了酮洛芬赖氨酸盐(ketoprofen lysine salt,KLS)发挥与母体药物 (parent drug)酮洛芬相同的抗炎、镇痛和解热活性。 已显示用氨基酸赖氨酸对酮洛芬进行盐化可显著地提高酮洛芬在水中的溶解度 谱,这允许液体和固体经口剂型的开发。 根据文献并根据生物药剂学分类系统(Biopharmaceutical Classification System,BCS),由于酮洛芬的高通透性和溶解度谱(其在pH:1.2下最高剂量下为低溶解度), 其被分配至BCS II类。尽管进行了这种评估,但如果我们考虑例如40mg的酮洛芬赖氨酸盐 的剂量(即对应于25mg酮洛芬),我们可看到该剂量在pH:1.2下也是完全可溶的。 酮洛芬赖氨酸盐在37℃下于pH:1.2下的溶解度为0.29mg/mL,对应于138ml(即低 于要求的250ml)的剂量/溶解度比。 因此,基于文献和实验数据,例如可将40mg的酮洛芬赖氨酸盐的剂量分配至具有 高溶解度和高通透性特征的BCS I类。 特别期望提供适合于药物物质的速释的组合物,该组合物是稳定的并且具有良好 的溶出谱和良好的一般耐受性。另外,本发明的目的是提供具有良好的化学和机械特性,例 如良好的均匀性、脆碎度、硬度(对破碎具有抗性)和崩解时限的组合物。 定义 除非另外定义,否则本文中使用的所有技术术语、符号和其他科学术语均旨在具 有由本公开内容所属领域的技术人员通常所理解的含义。在一些情况下,为清楚和/或为易 于参考起见,本文中定义了具有通常所理解的含义的术语;因此,本文中包含这样的定义不 应被解释为表示相对于本领域通常所理解的含义的实质性区别。 在本说明书的框架内以及在所附权利要求书中,除非在另外指出的情况下,否则 表示量、数量、百分比等的所有数字在所有情况下均应理解为前面存在术语“约”。另外,数 值实体的所有范围均包含最大数值与最小数值的所有可能的组合以及其中所有可能的中 间范围,除下文中具体指出的那些之外。 3 CN 111587108 A 说 明 书 2/9 页 术语“包含”、“具有”、“包括”和“含有”应理解为开放式术语(即,意指“包括但不限 于”),并且应被视为也为术语如“基本上由……组成”及其变化形式、“由……组成”及其变 化形式提供支持。 术语“基本上由……组成”及其变化形式应理解为半封闭式术语,意指不包括实质 上影响本发明的基本特征和新特征的其他成分(因此可包含任选的赋形剂)。 术语“由……组成”及其变化形式应理解为封闭式术语。 出于本发明的目的,术语“速释”旨在指示在pH为1至pH为6.8的介质中在小于1小 时内从组合物中释放酮洛芬赖氨酸盐总量的组合物。 本文中使用的术语“粒度分布”(particle size distribution,PSD)是指颗粒物 的不同粒级中的每一种的按体积计的相对百分比。本申请的粒度分布可使用激光衍射设 备,例如Malvern 2000来测量。粒度通过测量由均匀的颗粒混悬液散射的激 光的角分布来确定。尺寸分布使用由Gustav Mie开发的光散射理论从光散射数据中确定。 其他类型的设备也适合于确定粒度分布。激光衍射结果可由基于体积分布的d(0.9)和/或d (0.5)和/或d(0.1)中位数粒度值表示。 d(0.5)是以微米表示的尺寸,其将所述分布分为一半高于该直径和一半低于该直 径。因此,包含150μm至250μm的d(0.9)意指按体积计90%的颗粒的体积低于该范围内的值。 同样地,大于65μm的d(0.5)意指按体积计50%的颗粒的直径大于65μm;并且大于1.5μm的d (0.1)意指按体积计10%的颗粒的直径大于1.5μm。 发明概述 在酮洛芬赖氨酸盐速释片剂的开发期间,本发明人已令人惊讶地发现在pH 1.2下 较高的崩解速率(药典(Pharmacopoeia))与较高的溶出速率(药典)不相关。 通常,由于崩解时限的快速完成和药物物质释放谱的良好可预测性,崩解时限是 筛选速释片剂的优选测试。通常随后对具有最佳崩解速率的片剂进行溶出测试。 本发明人已发现,即使基于甘露醇的片剂比基于CaHPO4的片剂呈现出更高的崩解 时限值,但是基于甘露醇的片剂出乎意料地示出更快速的溶出谱。 更特别地,根据第一方面,本发明涉及速释药物组合物,其包含作为活性成分 (active principle)的粒度分布具有150μm至250μm的d(0.9)和/或大于65μm的d(0.5)和/ 或大于1.5μm的d(0.1)的酮洛芬赖氨酸盐(KLS),和甘露醇,其中酮洛芬赖氨酸盐与甘露醇 的比为约100∶100至约100∶250。 有利地,本发明的速释组合物适合于用于与水一起经口施用的固体剂型,优选片 剂。 本发明的速释药物组合物,优选为片剂形式的本发明速释药物组合物,具有良好 的硬度、脆碎度、崩解时限和良好的内容物均匀性,以及良好的溶出谱和良好的一般耐受 性。 本发明的第二方面提供了用于通过直接压制制备根据第一方面的药物组合物的 方法。 附图简述 图1示出了在pH 1.0下的包含不同超级崩解剂的根据本发明的批次的溶出谱; 图2示出了在pH 1.0下的包含不同填充剂和超级崩解剂的根据本发明的批次的溶 4 CN 111587108 A 说 明 书 3/9 页 出谱; 图3示出了在pH 1.0下的包含不同填充剂和超级崩解剂的批次(参考)的溶出谱; 图4示出了在pH 1.0下的经染色的和未经染色的包衣片剂的溶出谱; 图5示出了在pH 1.0下的根据本发明的批次的溶出谱; 图6示出了在pH 1.0下的以不同压制力生产的片剂的溶出谱; 图7示出了未微粉化的酮洛芬赖氨酸盐的粒度分布; 图8示出了微粉化的酮洛芬赖氨酸盐的粒度分布; 图9示出了在pH 1.0下的具有不同粒度分布的酮洛芬赖氨酸盐的批次的溶出谱。 发明详述 如将在实验部分中详细公开的,本发明人已发现包含甘露醇和具有特定粒度分布 的酮洛芬赖氨酸盐的药物组合物允许获得适合于与水一起经口施用的速释片剂。 因此,本发明的第一目的是速释药物组合物,其包含作为活性成分的粒度分布具 有150μm至250μm的d(0.9)和/或大于65μm的d(0.5)和/或大于1.5μm的d(0.1)的酮洛芬赖氨 酸盐(KLS),和甘露醇,其中酮洛芬赖氨酸盐与甘露醇的比为约100∶100至约100∶250。 甘露醇用作用于直接压制的黏合剂和用作填充剂。 根据本发明的一个优选实施方案,甘露醇的粒度分布具有最多35%大于150μm, 和/或最少70%大于75μm。 根据本发明的药物组合物,其还包含至少一种超级崩解剂。 超级崩解剂可以以酮洛芬赖氨酸盐的量的按重量计25%至50%,优选30%至 45%,并且更优选35%至40%的量存在。 适合于本发明的超级崩解剂可选自包含以下的组:交联的聚乙烯吡咯烷酮(交聚 维酮)、交联的羧甲基纤维素钠(交联羧甲基纤维素)、羟基乙酸淀粉钠、预胶凝淀粉,及其混 合物。优选的超级崩解剂是交聚维酮。 在一个优选的实施方案中,根据本发明的药物组合物还包含至少一种润滑剂和/ 或至少一种助流剂。 本文中所述的润滑剂可选自包含以下的组:硬脂酸镁、硬脂酸、滑石、月桂基硫酸 钠、硬脂富马酸钠、山嵛酸甘油酯,及其混合物。优选的润滑剂是月桂基硫酸钠和硬脂富马 酸钠。 可使用亲水性润滑剂如硬脂富马酸钠以保持崩解时限尽可能短,以确保API的即 时(prompt)释放。特别地,其提供更快的溶出速率、更硬的片剂、过度共混(over-blend)的 防止、更快的制剂开发以及规模扩大且增强的润滑效率。 润滑剂可以以组合物的按重量计0至4 .0%,优选1 .5%至2 .5%,并且更优选 1.75%至2.25%的量存在。 本文中所述的助流剂可选自包含以下的组:胶态二氧化硅、滑石,及其混合物。优 选的助流剂是胶态二氧化硅。 助流剂可以以组合物的按重量计0%至2.0%,优选0.5%至1.5%,并且更优选 0.75%至1.25%的量存在。 可使用润滑剂和助流剂以提高在前几分钟内的API的溶出速率,以在API的释放方 面中具有快速作用。 5 CN 111587108 A 说 明 书 4/9 页 根据本发明的速释药物组合物为片剂形式。 本发明人已令人惊讶地发现,对黏合剂和崩解剂的特定混合的选择促进了片剂在 水性环境中的崩裂(breakup),从而提高了可用的表面积并促进了药物物质的更快速释放。 根据本发明的速释片剂可通过在7kN至15kN,优选7kN至10kN的压片强度下直接压 制来获得。 另一些成分,例如包衣膜也可用于感官顺应性。用于本发明的合适的膜包衣系统 可以是基于Opadry HPMC的或基于PVA的,优选基于PVA的。 Opadry是聚乙烯醇或羟丙基甲基纤维素、聚乙二醇(polyethylene glycol)/聚乙 二醇(macrogol)、二氧化钛、滑石和色素的混合物。 染料的存在不影响片剂的溶出速率。 本发明的第二目的是用于制备根据本发明的速释片剂的方法,其包括以下步骤: a)提供粒度分布具有150μm至250μm的d(0.9)和/或大于65μm的d(0.5)和/或大于 1.5μm的d(0.1)的酮洛芬赖氨酸盐颗粒,和甘露醇,其中酮洛芬赖氨酸盐与甘露醇的比为约 100∶100至约100∶250; b)将步骤a)的成分在合适的混合器中混合以获得均匀混合物; c)任选地将步骤b)的共混物与至少一种超级崩解剂和/或至少一种润滑剂和/或 至少一种助流剂混合,直至获得均匀粉末; d)将步骤c)的粉末混合物压制成片剂; e)任选地对步骤d)的片剂进行包衣。 阶段b)和c)-粉末混合 须使用1mm的筛目尺寸(mesh size),对每种成分进行筛分以去除可能的团粒。 将API与助流剂的总量的一部分混合;然后添加超级崩解剂、润滑剂之一(例如 SDS)和一部分的填充剂,并且将其与第一级分混合。该过程将模仿API的几何稀释,并且将 有助于其在最终混合物中的均匀分散。 最后的步骤由添加另一些润滑剂(例如硬脂富马酸钠)、助流剂和填充剂的剩余部 分组成。 阶段d)-压片 测试不同的转速和压制力以获得具有期望的技术特性(破碎强度、厚度、平均质 量、脆碎度、崩解时限、API的溶出速率)的片剂。 对推片力和片剂外观的评价与选择最佳条件相关。 阶段e)-膜包衣 为了获得掩味(taste-masking)膜包衣,选择低黏度聚合物,考虑就颜色均匀性、 外观和重量而言的片剂的视觉外观,选择该低黏度聚合物的量。 出于产品的独特识别,并且出于顺应性目的,选择蓝色。染料的存在不影响溶出速 率。 为了在施用期间掩盖API味道,并且为了具有可识别的和有吸引力的产品,可添加 非功能性的膜包衣系统。 适合于本发明的膜包衣系统可以是基于Opadry HPMC的(Opadry II 57U18539)或 基于PVA的(Opadry II 85F18422),优选基于PVA的。 6 CN 111587108 A 说 明 书 5/9 页 Opadry是聚乙烯醇或羟丙基甲基纤维素、聚乙二醇/聚乙二醇、二氧化钛、滑石和 色素的混合物。 为了评估Opadry包衣掩盖片剂异味(off-taste)的能力,在膜的沉积期间监测染 料的均匀分布。观察到,在施加6mg/片剂的Opadry之后,产生的着色在片剂之间均匀且一 致。这被视为包衣过程结束的信号。片剂的重量增加表明在片剂表面上施加了均匀的包衣 膜层,从而使片剂本身具有掩味效果。 选择片剂的最终重量(156mg)和小尺寸(7mm直径)以提高患者的顺应性,从而实现 产品的容易的吞咽。 本发明的可能的速释药物组合物提供于以下实施例中,但是,所述实施例仅旨在 举例说明而不限制本发明。 实施例 实施例1 制备并测试如表1中所述的根据本发明的制剂。如上报道,使用直接压制制备片 剂。 表1 成分 05214F 05914F 06014F 甘露醇(Pearlitol 100) 62.00% 62.00% 62.00% KLS 26.67% 26.67% 26.67% 交聚维酮 10.00% - - 交联羧甲基纤维素钠 - 10.00% - 羟基乙酸淀粉钠 - - 10.00% 硬脂富马酸钠 1.33% 1.33% 1.33% 在pH 1 .0下的包含不同超级崩解剂的批次的溶出谱示出于图1中。根据 Ph.Eur.2.9.3现行版(37℃、900ml、50rpm),对在5、10、15、30、45和60分钟之后采样的12个 片剂进行溶出测试。由于pH 1.0对应于最类似于胃条件(发生溶出的地方)的谱以及其中与 pH 4.5和6.8相比KSL产生了较低可溶性,因此pH 1.0可被认为是关键的,并且为此选择其 作为pH溶出介质。另外,根据本发明的制剂旨在在胃中快速溶出并且具有即时生物利用度。 如图1中所示,虽然交联羧甲基纤维素及时提供了最高的KLS平稳(plateau)浓度, 但交聚维酮似乎在溶出的前几分钟内更快。 实施例2 制备并测试如表2中所述的根据本发明的制剂。如上报道,使用直接压制制备根据 本发明的片剂。 所述制剂使用这些浓度的超级崩解剂进行制备: -交聚维酮(10.00%) -交联羧甲基纤维素钠(5.00%) 交聚维酮(5.00%) -交联羧甲基纤维素钠(10.00%) 在相同条件下测试两种不同的稀释剂,以观察超级崩解剂的行为是否随着磷酸钙 而不是甘露醇的存在而改变。 7 CN 111587108 A 说 明 书 6/9 页 表2 在pH1.0下的包含不同稀释剂和超级崩解剂的批次的溶出谱示出于图2和图3中。 根据本发明使用甘露醇作为稀释剂制备的片剂(图2)相对于使用磷酸钙制备的那 些(图3)显示出更快的溶出。基于甘露醇的片剂在胃中快速溶出并具有即时生物利用度。 实施例3 制备并测试如表3中所述的根据本发明的制剂。如上报道,使用直接压制和最终的 膜包衣制备根据本发明的片剂。 表3 图4中示出的结果指示染料的存在不影响片剂的溶出速率。 实施例4 制备并测试如表4中所述的根据本发明的还包含胶态二氧化硅和月桂基硫酸钠的 组合物。 表4 成分 08114F KLS 26.67% 甘露醇 60.00% 交聚维酮 10.00% SLS 1.00% 胶态无水二氧化硅 1.00% 硬脂富马酸钠 1.33% 8 CN 111587108 A 说 明 书 7/9 页 图5中示出的结果指示在7KN下压制的、示出于表4中的组合物改善了在pH 1 .0下 片剂中API的溶出谱。 实施例5 制备并测试如表5中所述的根据本发明的包含细颗粒级的月桂基硫酸钠(例如 Kolliphor SLS细)的组合物。 表5 使用相同的原料(bulk),使用不同的压制力(7KN和10KN)来生产片剂。图6中示出 的溶出谱显示这两种压制力均使片剂具有良好的溶出性能。 实施例6 制备并测试如表5中所述的根据本发明的制剂。 在三种不同的pH(pH 1 .0、4 .5和6 .8)下评价溶出谱。基于指南CPMP/EWP/QWP/ 1401/98Rev.1中报道的要求设置溶出参数。结果示出于表6至8中。 表6 溶出速率测试(Dissolution Rate Test,DRT)-溶出介质pH 1.0 时间(分钟) 溶出的KLS(%) 变异系数(CV%) 0 0.00 0 5 91.33 2 10 99.19 1 15 100.00 1 30 100.21 2 9 CN 111587108 A 说 明 书 8/9 页 45 100.02 2 60 99.36 2 表7 溶出速率测试(DRT)-溶出介质pH 4.5 时间(分钟) 溶出的KLS(%) CV% 0 0.00 0 5 93.17 3 10 97.72 3 15 98.33 2 30 97.59 2 45 96.61 2 60 95.69 1 表8 溶出速率测试(DRT)-溶出介质pH 6.8 时间(分钟) 溶出的KLS(%) CV% 0 0.00 0 5 95.82 3 10 97.47 2 15 101.84 2 30 101.88 2 45 100.86 2 60 99.67 2 如以上溶出谱中所示,根据本发明的制剂确保了API在每个受试pH下的全部完全 的释放。 实施例7 使用两种不同的酮洛芬赖氨酸盐(微粉化和未微粉化)并测试其溶出行为。 所使用的KLS是未微粉化的(批次30003605),其中其粒度分布示于图7中;以及是 微粉化的(批次AA00707),其中其粒度分布示于图8中。 用上述KLS生产的制剂示出于表9中。 表9 05214F 06714F 甘露醇(Pearlitol 100) 62.00% 60.00% KLS-批次30003605 26.67% - KSl-批次AA00707 - 33.67% 交聚维酮 10.00% 5.00% 硬脂富马酸钠 1.33% 1.33% 图9中示出的溶出谱指示微粉化KLS的使用不提高片剂的溶出速率。此外,微粉化 的KLS将导致更差的产品工业化,由于微粉化的KLS倾向于黏附至壁,并且使得待压制的原 10 CN 111587108 A 说 明 书 9/9 页 料具有差的流动特性。 因此,根据本发明的粒度分布允许获得在胃中快速溶出并且具有即时生物利用度 的速溶片剂。 11 CN 111587108 A 说 明 书 附 图 1/9 页 图1 12 CN 111587108 A 说 明 书 附 图 2/9 页 图2 13 CN 111587108 A 说 明 书 附 图 3/9 页 图3 14 CN 111587108 A 说 明 书 附 图 4/9 页 图4 15 CN 111587108 A 说 明 书 附 图 5/9 页 图5 16 CN 111587108 A 说 明 书 附 图 6/9 页 图6 17 CN 111587108 A 说 明 书 附 图 7/9 页 图7 18 CN 111587108 A 说 明 书 附 图 8/9 页 图8 19 CN 111587108 A 说 明 书 附 图 9/9 页 图9 20












