技术摘要:
本文描述的技术涉及例如通过检测一些循环肿瘤细胞(CTC)标记基因的表达方面的改变来对CTC进行检测的方法。还可靶向CTC标记基因的异常表达(例如CTCs表达指征方面的改变),从而治疗癌症。
背景技术:
循环肿瘤细胞(CTCs)从原发肿瘤脱落进入血流,介导癌症向远端器官的扩散(转 移)。因此,血流中存在的循环肿瘤细胞(CTCs)最终导致癌症扩散至远端器官。然而,CTCs极 为罕见,估计每毫升血液的一百亿正常血细胞中有1到10个肿瘤细胞。就这一点而言,循环 肿瘤细胞的分离和分子分析产生了明显的技术挑战(Pantel等,Nat Rev Cancer 2008 8: 329-340;Yu等,J Cell Biol 2011 192:373-382)。
技术实现要素:
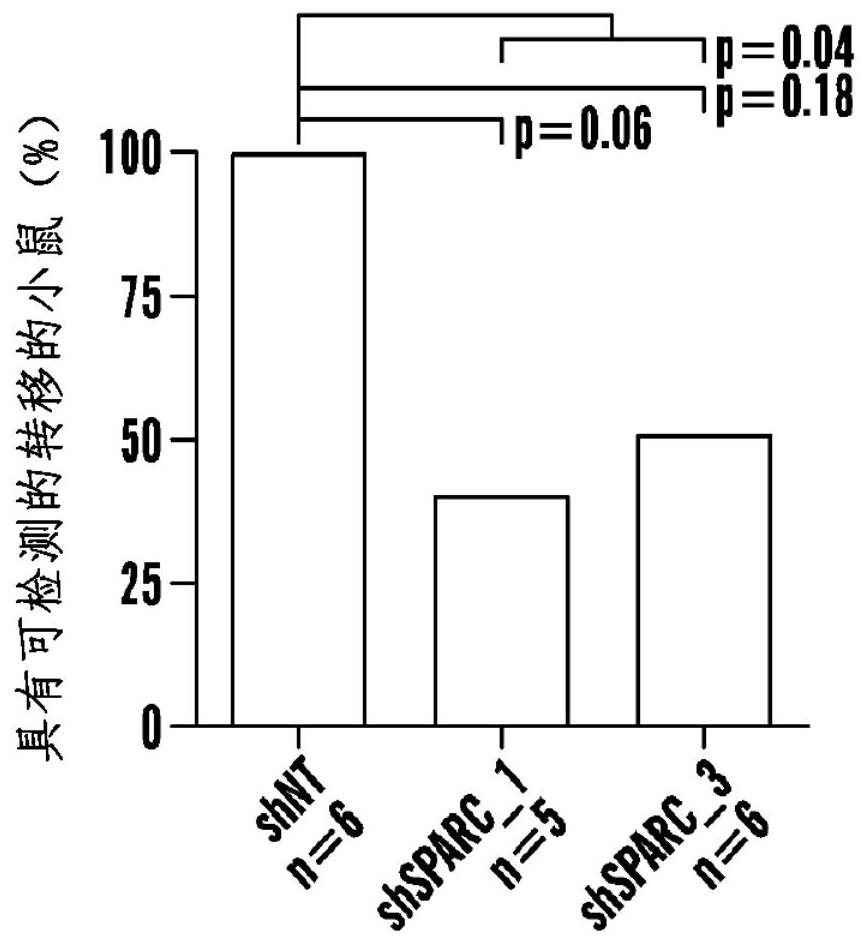
如本文所述,本发明人识别了大量基因,该基因的表达为CTCs所特有的。具体而 言,这些基因的表达区别了CTCs与原发肿瘤细胞。因此,本文提供了与CTCs的检测相关的方 法和测定法(assays),包括诊断和预后的方法和测定法。进而,本文提供了靶向这些CTCs标 记(例如用来抑制转移)来对癌症进行的治疗。 在一个方面,本文所述的为检测样本中的循环肿瘤细胞(CTCs)的方法,所述方法 包括:测量所述样本中的PC-CTC标记基因表达产物的水平;以及,如果检测到的所述标记基 因表达产物的水平高于参比水平,则确定存在PC-CTCs。在一些实施方式中,所述CTCs为胰 腺癌CTCs。在一些实施方式中,所述方法进一步包括从所述样本中分离所述CTCs的第一步 骤。在一些实施方式中,所述表达产物为核酸。在一些实施方式中,利用选自于由如下所组 成的组中的方法对所述表达产物的水平进行确定:RT-PCR;定量RT-PCR;Northern印迹;基 于微阵列的表达分析;下一代测序以及RNA原位杂交。在一些实施方式中,所述表达产物为 多肽。在一些实施方式中,利用选自于由如下所组成的组中的方法对所述表达产物的水平 进行确定:Western印迹;免疫沉淀;酶联免疫吸附测定法(ELISA);放射性免疫测定法 (RIA);夹心测定法;荧光原位杂交(FISH);免疫组织学染色;放射性免疫分析测定法;免疫 荧光测定法;质谱法;FACS以及免疫电泳测定法。在一些实施方式中,所述CTC标记基因选自 4 CN 111729090 A 说 明 书 2/165 页 表7或表8。在一些实施方式中,所述CTC标记基因选自于由如下所组成的组:ABI3BP; ADAMTS5;ADAMTSL1;ANG;ARSA;C1RL;C3;C4A;C4B;CCDC80;CD109;CHI3L1;CLEC3B;CMTM3; CMTM7;COL14A1;COL1A2;COL3A1;COL4A6;CSF1;DAG1;DCN;DMKN;FBLN1;FGF1;FMOD;GPC3; GPC4;HMGB1;IFNAR2;IGFBP5;IL16;LAMA4;LTBP4;MFAP1A;NID2;OGN;PDAP1;PF4;PLAT; PODN;PRELP;RSPO1;SERPING1;SLURP1;SOD3;SPARC;SPOCK2;SPON2;SULF1;SULF2;TGFB2; TGM2;THBD;THBS1;THSD4;TIMP2;TNXB;TPT1;TWSG1和WNT4。在一些实施方式中,所述CTC标 记基因选自于由如下所组成的组:ALDH1A1;ALDH1A2;IGFBP5;KLF4;DCN;SPARC;WNT;TGFB2; VEGF;COL1A2;COL3A1和TIMP2。在一些实施方式中,所述CTC标记基因选自于由如下所组成 的组:ALDH1A2;IGFBP5;KLF4;DCN和SPARC。 在一个方面,本文所述的为对受试者中的癌症进行治疗的方法,所述方法包括:向 受试者给予治疗有效量的CTC标记基因靶向治疗剂(therapy)。在一些实施方式中,所述癌 症为胰腺癌。在一些实施方式中,所述CTC标记基因靶向治疗剂包括CTC标记基因的抑制剂。 在一些实施方式中,所述抑制剂为抗体试剂。在一些实施方式中,所述抑制剂为抑制性核酸 试剂。在一些实施方式中,所述CTC标记基因靶向治疗剂包括CTC标记基因结合抗体试剂和 化疗剂。在一些实施方式中,所述受试者为被确定具有升高水平的存在于血液和/或癌间质 中的CTC标记基因和/或升高水平的CTCs的受试者。 在一个方面,本文所述的为确定受试者是否有可能对CTC标记基因靶向治疗剂的 治疗作出响应的方法,所述方法包括:对存在于血液和/或癌间质中的CTC标记基因表达产 物的水平进行测量;以及如果与参比水平相比,所述表达产物的水平升高,则确定受试者有 可能对所述治疗作出响应。在一些实施方式中,所述方法进一步包括从所述样本中分离所 述CTCs的第一步骤。在一些实施方式中,所述癌症为胰腺癌。在一些实施方式中,所述表达 产物为核酸。在一些实施方式中,利用选自于由如下所组成的组中的方法对所述表达产物 的水平进行确定:RT-PCR;定量RT-PCR;Northern印迹;基于微阵列的表达分析;下一代测序 以及RNA原位杂交。在一些实施方式中,所述表达产物为多肽。在一些实施方式中,利用选自 于由如下所组成的组中的方法对所述表达产物的水平进行确定:Western印迹;免疫沉淀; 酶联免疫吸附测定法(ELISA);放射性免疫测定法(RIA);夹心测定法;荧光原位杂交 (FISH);免疫组织学染色;放射性免疫分析测定法;免疫荧光测定法;质谱法;FACS以及免疫 电泳测定法。在一些实施方式中,所述PC-CTC标记基因选自表7或表8。在一些实施方式中, 所述CTC标记基因选自于由如下所组成的组:ABI3BP;ADAMTS5;ADAMTSL1;ANG;ARSA;C1RL; C3;C4A;C4B;CCDC80;CD109;CHI3L1;CLEC3B;CMTM3;CMTM7;COL14A1;COL1A2;COL3A1; COL4A6;CSF1;DAG1;DCN;DMKN;FBLN1;FGF1;FMOD;GPC3;GPC4;HMGB1;IFNAR2;IGFBP5;IL16; LAMA4;LTBP4;MFAP1A;NID2;OGN;PDAP1;PF4;PLAT;PODN;PRELP;RSPO1;SERPING1;SLURP1; SOD3;SPARC;SPOCK2;SPON2;SULF1;SULF2;TGFB2;TGM2;THBD;THBS1;THSD4;TIMP2;TNXB; TPT1;TWSG1和WNT4。在一些实施方式中,所述CTC标记基因选自于由如下所组成的组: ALDH1A1;ALDH1A2;IGFBP5;KLF4;DCN;SPARC;WNT;TGFB2;VEGF;COL1A2;COL3A1和TIMP2。在 一些实施方式中,所述CTC标记基因选自于由如下所组成的组:ALDH1A2;IGFBP5;KLF4;DCN 和SPARC。 在一个方面,本文所述的为监测对受试者进行的治疗的方法,所述方法包括:向有 需要的受试者给予癌症治疗剂;对存在于血液和/或癌间质中的CTC标记基因表达产物的水 5 CN 111729090 A 说 明 书 3/165 页 平进行测量;以及如果与参比水平相比,CTC标记基因表达产物的水平降低,则确定受试者 作出响应,而如果与参比水平相比,CTC标记基因表达产物未降低,则确定受试者不对所述 治疗作出响应。在一些实施方式中,所述癌症为胰腺癌。在一些实施方式中,所述参比水平 为给予步骤之前的患者中的所述基因表达产物的水平。在一些实施方式中,所述方法进一 步包括从所述样本中分离所述CTCs的第一步骤。在一些实施方式中,所述表达产物为核酸。 在一些实施方式中,利用选自于由如下所组成的组中的方法对所述表达产物的水平进行确 定:RT-PCR;定量RT-PCR;Northern印迹;基于微阵列的表达分析;下一代测序以及RNA原位 杂交。在一些实施方式中,所述表达产物为多肽。在一些实施方式中,利用选自于由如下所 组成的组中的方法对所述表达产物的水平进行确定:Western印迹;免疫沉淀;酶联免疫吸 附测定法(ELISA);放射性免疫测定法(RIA);夹心测定法;荧光原位杂交(FISH);免疫组织 学染色;放射性免疫分析测定法;免疫荧光测定法;质谱法;FACS以及免疫电泳测定法。在一 些实施方式中,所述PC-CTC标记基因选自表7或表8。在一些实施方式中,所述CTC标记基因 选自于由如下所组成的组:ABI3BP;ADAMTS5;ADAMTSL1;ANG;ARSA;C1RL;C3;C4A;C4B; CCDC80;CD109;CHI3L1;CLEC3B;CMTM3;CMTM7;COL14A1;COL1A2;COL3A1;COL4A6;CSF1; DAG1;DCN;DMKN;FBLN1;FGF1;FMOD;GPC3;GPC4;HMGB1;IFNAR2;IGFBP5;IL16;LAMA4;LTBP4; MFAP1A;NID2;OGN;PDAP1;PF4;PLAT;PODN;PRELP;RSPO1;SERPING1;SLURP1;SOD3;SPARC; SPOCK2;SPON2;SULF1;SULF2;TGFB2;TGM2;THBD;THBS1;THSD4;TIMP2;TNXB;TPT1;TWSG1和 WNT4。在一些实施方式中,所述CTC标记基因选自于由如下所组成的组:ALDH1A1;ALDH1A2; IGFBP5;KLF4;DCN;SPARC;WNT;TGFB2;VEGF;COL1A2;COL3A1和TIMP2。在一些实施方式中,所 述CTC标记基因选自于由如下所组成的组:ALDH1A2;IGFBP5;KLF4;DCN和SPARC。 附图说明 图1A-图1C展示了CTCs的分离和表征。图1A描绘了CTC-iChip负IFD系统的示意图。 图1B描绘了正常小鼠和癌症小鼠模型之间的小鼠WBC耗竭(depletion)的一致性的图。WBC 耗竭以log10示出。图1C描绘了借助免疫荧光染色(CK /CD45-/DAPI )从正常小鼠和KPC小 鼠计算的CTC的图表。 图2描绘了单细胞样本的主成分分析的示意图。 图3A-3B展示了上皮、间充质和干细胞基因在CTC-c细胞vs肿瘤中的差异化表达。 描绘了在CTC-c细胞vs肿瘤中下调(图3A)和上调(图3B)的基因的箱形图。条=中位值,箱形 线=四分位数,标度以log10(rpm)计。 图4A-图4C展示了CTC-iChip表征。图4A描绘了偏转的WBC的百分数(y轴)作为每 WBC的抗-CD45珠的数量(x轴)的函数的图表。图4B描绘了加入正常的小鼠血液中的小鼠 PDAC细胞系NB508的回收的图(示出4个独立实验)。图4C描绘了来自使用NB508细胞系的同 基因型(syngeneic)正位PDAC肿瘤的所捕获的CTCs/mL血液的图。 图5A描绘了KPC小鼠的基因型和表征的表。图5B描绘了细胞系(NB508、MEF)、CTCs、 WBC和来自匹配的原发肿瘤的经稀释的块状RNA (bulk RN A)的总的特有的比对 (alignment),以及具有经比对的读数的百分比(%)的单细胞测序的质量度量学的图表。图 5C描绘了使用单细胞原发肿瘤(TuGMP3)、癌细胞系(NB508)和全部的CTCs(簇1、3、4、5和9) 之间的以及各簇(右侧)的平均的簇内相关系数的单细胞异质性的图表。圆圈=平均值,范 6 CN 111729090 A 说 明 书 4/165 页 围=95%CI。 图6描绘了与块状原发肿瘤(bulk primary tumors)和单细胞原发肿瘤相比,CTC- c中富集的ECM蛋白基因的箱形图。条=中位数,箱形线-四分位数,标度以log10(rpm)计。 图7描绘了来自3个患者的人胰腺CTCs表达谱热图。利用上皮基因定义CTCs,并示 出富集的胞外蛋白。以log10标度示出表达。 图8描绘了人胰腺癌细胞系中的SPARC表达的定量RT-PCR的图表。 图9描绘了侵袭测定法。观察到具有针对SPARC的shRNA(ShF1和ShF3)的PDAC2和 PDAC3细胞系侵袭穿过基底胶(Matrigel)减少。shNT=非靶标shRNA。 图10描绘了通过非靶标shRNA(NT)和SPARC shRNA(SHF1)的体内荧光素酶成像而 具有可检测转移的小鼠的数量的图表。 图11描绘了确定CTC异质性的过程的示意图。 图12A-图12C展示了在原发肿瘤的上皮和间质组分中发现的CTC富集的基因。描绘 的是Aldh1a2干细胞(图12A)和CTC高度富集的基因Klf4(图12B)和Igfbp5基因(图12C)的表 达箱形图。条=中位数,箱形线=四分位数,标度以log10(rpm)计。 图13展示了跨过不同的上皮癌的人和小鼠CTCs表达高水平的ECM蛋白基因。描绘 了在人PDAC CTC、乳腺(br)CTC和前列腺(pr)CTC等中高度表达的ecm基因的表达箱形图。 条,中位数;箱形线,四分位数;标度以log10(rpm)计。经holm校正的p值<0 .05(*)、0.01 (**)、0.001(***)。 图14A-图14E展示了人PDAC中的SPARC的表达增强了侵袭和转移。图14A描绘了通 过MTT确定的PDAC3细胞系增殖的图表。图14B描绘了每43个视野中计数的PDAC3 shNT vs shSPARC中的肿瘤球的图表(误差棒表示SD)。图14C描绘了通过每203个视野的核的数目定 量的shSPARC和shNT细胞系的侵袭的图。p值<0.01(**)、0.001(***)、0.0001(****)。误差棒 表示SD。图14D描绘了尾静脉接种PDAC3细胞系3周后通过体内荧光素酶成像而可检测的肺 转移的百分数的图。示出Fisher精确检验的p值。图14E描绘了具有来自PDAC3细胞系的正位 (orthotopic)胰腺肿瘤的小鼠中的归一化的转移负荷的图表。误差棒表示SD(*p<0.05)。 图15描绘了胰腺CTCs在转移级联中的作用的简要模型。示出了胰腺CTCs的异质性 子类,并关注最显著的典型CTC群体,所述典型CTC群体被富集用于上皮(角蛋白)和间质 (Sparc)基因的共表达。 图16A描绘了借助qRT-PCR的PDAC2 shRNA细胞系的图表。平均值随着最大和最小 RQ(误差棒)示出。图16B描绘了shNT和shSPARC稳定品系之间的借助MTT测定法的在PDAC2细 胞系方面类似的增殖率的图表。图16C描绘了shNT和shSPARC细胞系之间在2周时形成的肿 瘤球侵袭测定(误差棒=STD)类似的图表。在4×放大视野下进行定量(误差棒=SD)。通过 在48小时时的侵袭测定法确定经由shSPARC_1和3降低的迁移行为(图16D)。












