技术摘要:
本发明公开了一种建立了人鼻中隔鳞状癌细胞模型的方法,用于经鼻给药体外渗透性评估,主要包括以下步骤:1)选择人鼻中隔鳞状癌细胞RPMI 2650细胞系;2)确定合适的培养方法;3)建立体外渗透性评估的实验方法;4)选择模型药物对实验体系的验证。本发明所建立的体外人鼻中 全部
背景技术:
鼻黏膜是鼻炎、鼻塞等上呼吸道疾病局部给药的重要靶点,由于其自身的特点,也 被认为是一种非侵入性全身给药的替代途径。鼻黏膜具有丰富的血管分布和高通透性,加 上能够避开首过代谢,使药物能够快速吸收。筛选鼻内给药候选药物和药物制剂需要使用 合适和可靠的鼻屏障模型,该模型允许进行渗透性试验,以预测药物吸收和生物利用度。虽 然切除的鼻组织在组织学、细胞类型分布、药物转运蛋白表达等方面与鼻黏膜最接近,但其 有效性差、异质性高,不适合高通量筛选。此外,使用切除的动物组织可能引起伦理上的关 注,同时也存在种属间的差异。原发人鼻上皮细胞在形态和生化上与切除组织最接近。然 后,在培养2周后,原发人鼻上皮细胞的跨膜电阻值(TEER)大于500Ωcm2,远大于报道的人 类或动物切除鼻黏膜组织(40~120Ωcm2和90~180Ωcm2),这可能影响原发人鼻上皮细胞 作为生理相关鼻屏障模型的适用性。当永生化细胞系作为鼻屏障模型时,可获得遗传稳定 性和更高的可重复性,为细胞的广泛增值提供了来源。 近十年来,最值得研究的作为鼻屏障模型的细胞系为RPMI 2650细胞系。它起源于 人鼻中隔的间变性鳞状细胞癌,由于其在体外连续培养过程中保持了高度的稳定性,因此 不表现政策二倍体核型的改变。一些研究小组试图将这种人鼻上皮细胞系作为合适的鼻屏 障体外模型进行优化。该细胞系在细胞表面产生粘液物质和鼻屏障完整性方面与正常的人 类鼻上皮相似,其TEER值与切除的人和动物鼻组织相似。 当体外细胞模型被用来作为药物吸收的筛选工具,以及评估药物转运的功能时, 必须确认其作为合适的生理和药理上皮屏障模型的适用性和可靠性。此外,有必要使用足 够大的一组适当选择的模型药物来确定模型的预测能力。新的美国FDA从2017年12月和ICH 从2018年6月规定的体外渗透方法的适用性建立使用至少20个模型药物覆盖完整的渗透率 范围(低、中和高渗透),并且在整个渗透实验中验证细胞层的完整性。 目前,使用Caco-2细胞模型评估人肠道药物渗透研究已经非常普遍,但使用来自 于鼻上皮永生细胞,用于鼻黏膜药物渗透研究还鲜有报道。如何建立完整的细胞模型,并且 验证模型的适用性和可靠性在国内还属空白。
技术实现要素:
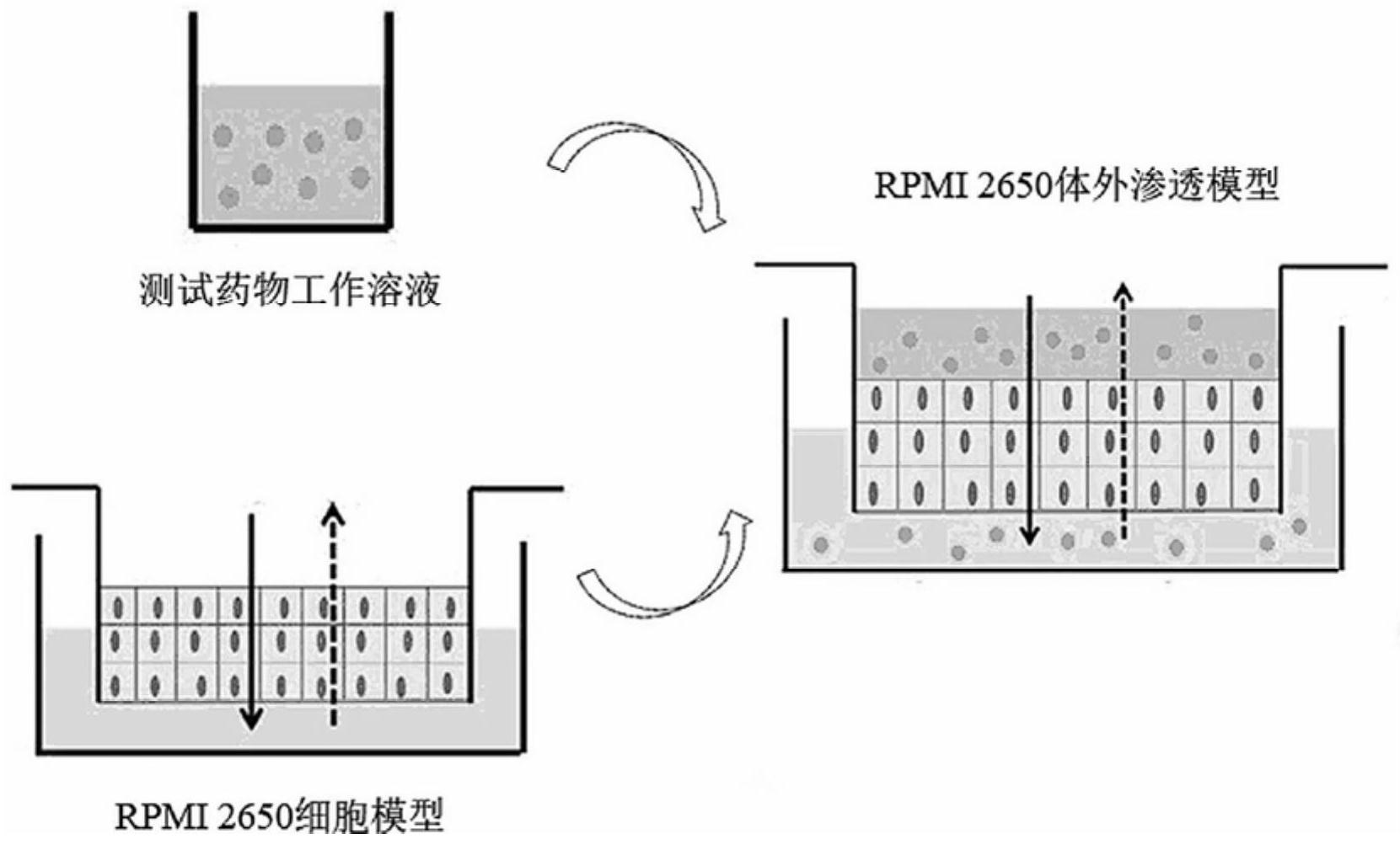
为解决上述技术问题,本发明提供了一种建立人鼻中隔鳞状癌细胞模型的方法, 包括以下步骤: 1)选择人鼻中隔鳞状癌细胞RPMI 2650细胞系; 2)确定合适的培养方法; 3)建立体外渗透性评估的实验方法; 3 CN 111575238 A 说 明 书 2/4 页 4)选择模型药物对实验体系进行验证。 其中,步骤1)中,RPMI 2650细胞常被认为是经鼻制剂开发早期上皮细胞模型的合 理选择,因为它避免了原代细胞引入的可变性;RPMI 2650细胞系来源于美国菌种保藏中心 (ATCC),鳞状细胞是构成RPMI 2650细胞多层结构的唯一细胞类型。尽管原发鼻细胞在形态 学上与体内鼻黏膜更为相似,RPMI 2650细胞常被认为是经鼻制剂开发早期鼻上皮细胞模 型的合理选择,因为它避免了原代细胞引入的可变性。 其中,步骤2)中,RPMI 2650细胞培养在A-MEM培养基中,培养基添加2%的 GlutaMAXTM和2.5%的FBS,在37℃、5%CO2和95%相对湿度的聚苯乙烯组织培养瓶中培养; 细胞每周换液三次;在培养瓶中达到80%~90%融合后,RPMI 2650细胞接种到聚对苯二甲 酸乙二醇酯(PET)薄膜的24孔细胞培养板( 24孔培养板),接种密度为2* 105cells/cm2。 其中,步骤3)中,通过测量TEER值、选用五种不同分子量(3~5kDa ,10kDa ,20kDa , 40kDa和70kDa)FITC-葡萄聚糖(FD)的Papp值用于评估细胞完整性;同时,在实验结束时,选 择荧光黄和TEER值检测细胞模型紧密连接完整性 其中,步骤3)中,细胞接种后,先进行TEER的测量,只有多层RPMI2650细胞TEER值 大于34Ωcm2时,细胞模型被认为合适用于双向渗透研究;除了TEER值,零渗透性标记化合 物也可用于细胞完整性,模型药物的渗透性和零渗透性标记物在两个方向进行评估,包括A 侧到B侧和B侧到A侧两个方向;在整个实验过程中,RPMI 2650细胞均培养在24孔细胞培养 板中,在37℃、5%CO2和95%空气湿度环境中培养;接收室按30、60、90、120和180min分别吸 出100μL样品,供给室在0和180min分别吸出20μL样品,取出的样品体积用缓冲溶液代替;样 品采集后,用缓冲液轻轻冲洗RPMI多层膜,并测量电阻值;为了评估RPMI 2650细胞的完整 性,细胞随后与20μM的荧光黄(Lucifer Yellow,简称:LY)溶液孵育1h(在渗透性测定中保 持细胞多层完整性对于获得可靠的结果至关重要,本发明选择一种细胞旁路标记物荧光 黄,它仅通过紧密连接运输用于评估多层的完整性),在接收室吸取100μL样品进行荧光检 测;除了使用LY外,在药物渗透性实验结束时同时测量TEER值,来评估细胞培养模型中紧密 连接的完整性,渗透性的计算公式为:Papp=kd*(1/A*C0),其中kd为药物渗透到接收室的 量随时间变化的线性斜率,A是细胞单层膜的表面积,C0为药物在供给室的初始浓度;化合 物的外排比ER的计算公式为ER=Papp B-A/Papp A-B,其中Papp B-A是B侧到A侧的渗透速 率,Papp A-B是A侧到B侧的渗透速率;当LY的Papp小于7*10-6cm/s或者TEER值大于25Ωcm2, 模型才可靠。 其中,步骤4)中,依据ICH和US-FDA关于体外渗透性测定方法适用性论证指南,对 此RPMI 2650细胞系模型对经鼻给药渗透性测定的适用性进行评估,指南推荐至少使用5种 模型药物(低、中和高渗透药物)以表征整个渗透速率范围,通过至少3次重复来提供药物渗 透性的可靠性。除了步骤3)的5个零渗透标记物外,本发明选用7个低渗透药物: enalaprilat、acyclovir、chlorothiazide、nadolol、oxacillin、famotidine、azilsartan, 7个中等渗透药物:ranitidine、amiloride、atenolol、hydrochlorothiazide、furosemide、 losartan、rosuvastatin和9个高渗透药物:theophylline、propranolol、verapamil、 antipyrine、carbamazepine、rosiglitazone、ketoprofen、ropinirole、metoprolol来验证 此细胞模型渗透性评估的适用性。 4 CN 111575238 A 说 明 书 3/4 页 通过上述技术方案,本发明所建立的体外人鼻中隔鳞状癌细胞模型,适合用于经 鼻给药的体外渗透性评估,有助于经鼻给药候选化合物的筛选和制剂的开发,并且能够预 测经鼻给药后的吸收和生物利用度。 附图说明 图1为本发明实施例所公开的细胞模型建立过程示意图; 图2为本发明实施例所公开的药物渗透性示意图。