技术摘要:
本发明公开了一种地佐辛晶型,使用Cu/K‑α1测定其X射线粉末(XRD)衍射图,在2θ值为9.1±0.2和12.2±0.2处具有衍射峰,并且这些衍射峰的高度%均大于20。此外,本发明还公开了该晶型的制备方法、药物组合物和用途。该地佐辛晶型尚未见报道,其溶解性好,制备方法操作简单 全部
背景技术:
地佐辛,英文名Dezocine,CAS No .:32619-42-4,化学名为(-)-[5R-(5α,11α, 13S*)]-13-氨基-5,6,7,8,9,10,11,12-八氢-5-甲基-5,11-甲撑苯并环癸烯-3-醇,化学结 构式为 地佐辛是由瑞士Astrazeneca公司开发(US4001331),属于一种典型的阿片生物碱 类镇痛药,是κ受体激动剂,也是μ受体拮抗剂。该类药物兼有激动剂和拮抗剂的作用,通过 对受体亚型亲和力与其他阿片类药物不同而显示了不同的特点,地佐辛的镇痛作用强于喷 他佐辛,成瘾性小,具有良好的安全性和耐受性,适用于治疗手术后中等至剧烈疼痛、内脏 绞痛及晚期癌症患者的疼痛。其镇痛强度、起效时间和作用持续时间及最大镇痛效果与吗 啡相当,比杜冷丁强5-9倍,副作用轻微。目前地佐辛原料和制剂已在国内上市销售,并且市 场和医疗机构认可度不断提高,因此临床需求也不断加大。 美国专利US4001331公开了地佐辛及其多种类似物、各种盐型的制备方法;中国专 利CN102503840A为化合物制备专利,相比于专利US4001331,制备中间体Ⅱ所用氧化剂的环 境友好性、经济性较好,中间体Ⅲ的制备过程安全性更高,拆分效率更高,工艺简单高效。专 利CN101671269B公布了一种地佐辛关键中间体的制备方法,其合成方法操作更加简便,且 反应其条件温和,安全性高,成本低。中国专利CN104910002A公布了一种地佐辛中间体V的 制备方法,相比较于专利CN102503840A,其合成方法更加简便、条件温和,以7-甲氧基-2-萘 满酮为原料,成本较低;专利DE 2 1 5 9 3 2 4公开了地佐辛注射液制备方法;专利 201510080325 .X报道了一种地佐辛口服制剂及其制备方法,处于实质性审查中;专利 201410405193.9公布了一种地佐辛冻干粉针剂及其制备方法,相比较于注射剂,其安全隐 患更低,稳定性更好,处于实质性审查中;专利201410470463.4公开了一种地佐辛冻药物组 合物及其制备方法,相比较于专利201410405193.9,其杂质含量低,且无有机溶剂,临床应 用更安全,目前处于实质性审查中;专利201410804930.2公开了一种地佐辛注射液的制备 方法,目前处于实质性审查中。 以上专利只涉及到地佐辛及类似物的合成工艺、中间体制备、制剂等方面,未涉及 化合物晶型方面。多晶型现象在药物中广泛存在。同一药物的不同晶型在溶解度、熔点、密 5 CN 111606816 A 说 明 书 2/10 页 度、稳定性等方面有显著的差异,从而不同程度地影响药物的稳定性、均一性、生物利用度、 疗效和安全性。尤其是溶解度方面,目前的地佐辛药品溶解度极差,不利于制剂的开发及药 物在人体内的吸收。因此,对地佐辛进行全面系统地多晶型筛选,选择溶解度高、稳定性好 的晶型是不可忽视的重要研究内容之一。因此,开发溶解度更好的地佐辛新晶型对于相关 制剂的开发及提高地佐辛的生物利用度具有重要意义。
技术实现要素:
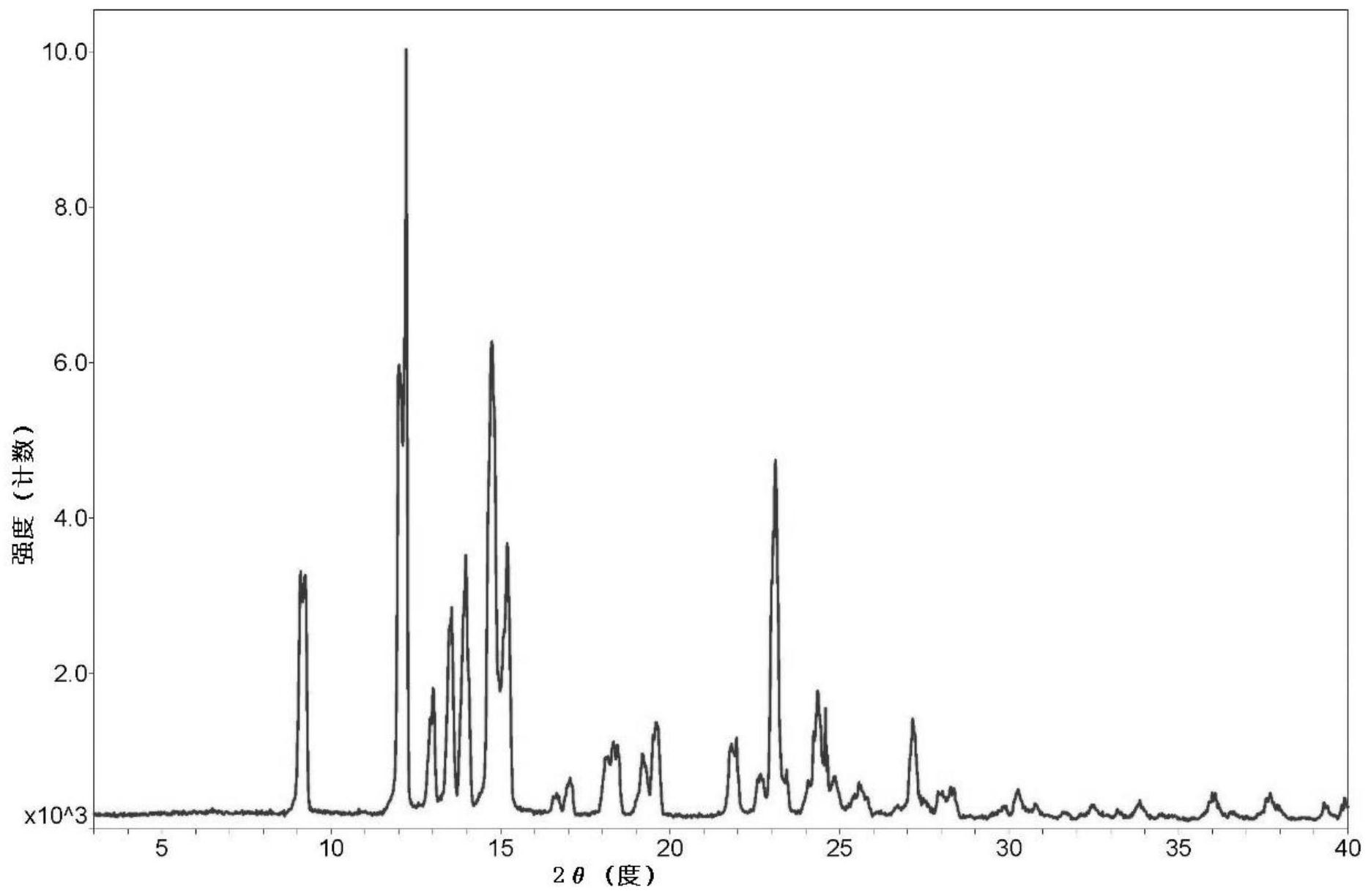
本发明人开发了一种新的地佐辛晶型,具有溶解快,人体吸收快,具有更好的稳定 性,在贮存过程中有关物质含量更低,特别的,其中不含杂质B(化学结构式II);而且,该新 晶型的制备方法,具有操作简单、重现性好、适合工业化大生产等优点。 本发明的第一目的是提供一种新的地佐辛晶型。 本发明的第二目的是提供该新晶型的制备方法。 具体地说,在本发明的实施方案中,本发明提供了一种新的地佐辛晶型,使用Cu/ K-α1测定其X射线粉末衍射图,在2θ值为9.1±0.2和12.2±0.2处具有衍射峰,并且这些衍 射峰的高度%均大于20。 在本发明的一种实施方案中,本发明提供了一种新的地佐辛晶型,使用Cu/K-α1测 定其X射线粉末衍射图,在2θ值为9.1±0.2、12.2±0.2、13.6±0.2、和23.1±0.2处具有衍 射峰,并且这些衍射峰的高度%均大于20。 在本发明的一种优选实施方案中,本发明提供了一种新的地佐辛晶型,使用Cu/K- α1测定其X射线粉末衍射图,在2θ值为9.1±0.2、12.2±0.2、13.0±0.2、13.6±0.2、14.0± 0.2、14.7±0.2、15.2±0.2、19.6±0.2、23.1±0.2、24.4±0.2、和27.2±0.2处具有衍射 峰,并且这些衍射峰的高度%均大于20。 在本发明的一种更优选实施方案中,本发明提供了一种新的地佐辛晶型,使用Cu/ K-α1测定其X射线粉末衍射图,衍射峰情况为: 6 CN 111606816 A 说 明 书 3/10 页 7 CN 111606816 A 说 明 书 4/10 页 8 CN 111606816 A 说 明 书 5/10 页 在本发明的一种特别优选实施方案中,本发明提供了一种新的地佐辛晶型,使用 Cu/K-α1测定其X射线粉末衍射图,基本上如图1a所示。 在本发明的实施方案中,本发明提供了一种新的地佐辛晶型,其DSC检测在168.40 ℃附近有吸热峰,优选地,如图2a所示。 在本发明的实施方案中,本发明提供了一种新的地佐辛晶型,其IR数据特征基本 上如图3所示。 在本发明的实施方案中,本发明提供了一种新的地佐辛晶型,其TGA数据特征基本 上如图4所示。 另一方面,在本发明的实施方案中,本发明提供了上述新的地佐辛晶型的制备方 法,其制备过程如下: 1)加热下,将地佐辛溶解于一种对地佐辛溶解度较大的溶剂A中,搅拌下,再加入 另一种对地佐辛溶解度小的溶剂B; 2)经降温、保温方式析出晶体,过滤后收集晶体,干燥后制得。 在本发明的实施方案中,本发明提供的新的地佐辛晶型的制备方法,其中步骤1) 中所述对地佐辛溶解度较大的溶剂A选自二氧六环、乙酸乙酯,优选二氧六环。 在本发明的实施方案中,本发明提供的新的地佐辛晶型的制备方法,其中步骤1) 中所述对地佐辛溶解度小的溶剂B选自乙腈、甲苯、石油醚,优选石油醚。 在本发明的实施方案中,本发明提供的新的地佐辛晶型的制备方法,其中步骤1) 中所述溶剂A的用量与地佐辛的用量比为:每克地佐辛溶解于1-30ml溶剂A中,优选2-10ml。 在本发明的实施方案中,本发明提供的新的地佐辛晶型的制备方法,其中步骤1) 中溶剂A与溶剂B的体积比为1:0.5-1:10,优选1:1-1:2.5。 在本发明的实施方案中,本发明提供的新的地佐辛晶型的制备方法,其中步骤1) 中加热溶解的温度为30-100℃,优选70-80℃。 在本发明的实施方案中,本发明提供的新的地佐辛晶型的制备方法,其中步骤2) 中降温析晶的温度为0-20℃,优选0-10℃。 在本发明的实施方案中,本发明提供的新的地佐辛晶型的制备方法,其中步骤2) 中所述干燥为真空(-0.1MPa)干燥,干燥温度为60-90℃,优选60-80℃。 在本发明的实施方案中,本发明提供的新的地佐辛晶型的制备方法,其中,步骤1) 所用的地佐辛,优选地采用专利CN102503840A中的方法制备。 第三方面,本发明提供了包含上述新的地佐辛晶型的药物组合物。 9 CN 111606816 A 说 明 书 6/10 页 第四方面,本发明提供了上述新的地佐辛晶型或其药物组合物在止痛药物中的应 用。 本发明检测了专利CN102503840A得到的地佐辛结晶(以下称作地佐辛I晶型),使 用Cu/K-α1测定其X射线粉末衍射图,如图1b所示,其衍射峰的情况如下: 10 CN 111606816 A 说 明 书 7/10 页 11 CN 111606816 A 说 明 书 8/10 页 经溶解度和稳定性试验,本发明人惊奇地发现,本发明的新的地佐辛晶型(以下简 称地佐辛II晶型)的溶解度和稳定性都显著地优于地佐辛I晶型。 i.对比地佐辛I晶型的样品,本发明中的地佐辛新晶型在0.1mol/L的盐酸溶液中 溶解性更好,溶解度提高约32%,见下表: 样品 样品量 溶剂量 溶解度 地佐辛II晶型 50mg 1.5ml 0.033g/ml 地佐辛I晶型 50mg 2.0ml 0.025g/ml ii.对比地佐辛I晶型的样品,本发明中的地佐辛新晶型的有关物质含量更低,具 体如下表所示: 样品 I晶型 实施例1 实施例2 实施例3 实施例4 实施例5 有关物质 0.08% 0.06% 0.07% 0.04% 0.06% 0.04% iii.对比地佐辛I晶型的样品,本发明中的所制备的地佐辛新晶型的稳定性更好, 其6个月有关物质变化如下: 样品 0天 1个月 3个月 6个月 地佐辛I晶型 0.08% 0.15% 0.21% 0.28% 实施例1 0.06% 0.07% 0.10% 0.13% 实施例2 0.07% 0.09% 0.10% 0.12% 实施例3 0.04% 0.05% 0.8% 0.10% 实施例4 0.06% 0.08% 0.10% 0.12% 12 CN 111606816 A 说 明 书 9/10 页 实施例5 0.04% 0.06% 0.07% 0.09% iv.对比地佐辛I晶型的样品,本发明中的所制备的地佐辛新晶型的稳定性更好, 其6个月杂质B含量变化如下: 样品 0天 1个月 3个月 6个月 地佐辛I晶型 0.03% 0.04% 0.04% 0.05% 实施例1 未检出 未检出 未检出 未检出 实施例2 未检出 未检出 未检出 未检出 实施例3 未检出 未检出 未检出 未检出 实施例4 未检出 未检出 未检出 未检出 实施例5 未检出 未检出 未检出 未检出 v.按专利CN102503840A对地佐辛晶型I进行了多次精制,其杂质B含量都相同,如 下表所示: 地佐辛晶型I 一次精制 二次精制 三次精制 杂质B含量 0.03% 0.03% 0.03% 0.03% 因此,相比于现有技术,本发明提供的地佐辛新晶型具有更好的溶解性,有利于药 物溶出及人体吸收;具有更好的稳定性,在贮存过程中有关物质含量更低;同时,该新晶型 的制备方法,具有操作简单、重现性好、适合工业化大生产等优点。 附图说明 图1a表示的是本申请实施例1新的地佐辛晶型的XRD图谱。 图1b表示的是专利CN102503840A实施例1得到的样品的XRD图谱。 图2a表示的是本申请实施例1新的地佐辛晶型的DSC图谱。 图2b表示的是专利CN102503840A实施例1得到的样品的DSC图谱。 图3表示的是本申请实施例1新的地佐辛晶型的IR图谱。 图4表示的是本申请实施例1新的地佐辛晶型的TGA图谱。












