技术摘要:
本发明公开了一种EGFRvIII和EGFR的双特异性人源抗体及其应用,涉及生物医药技术领域。本发明公开的人源抗体具有如SEQ ID NO.6‑8所示的轻链CDR和SEQ ID NO.11‑12所示的重链CDR。该人源抗体可以特异性结合人EGFR和EGFRvIII两种蛋白,具有较高的亲和力,且其为全人源抗 全部
背景技术:
EGFR(epidermal growth factor receptor)是表皮生长因子受体(HER)家族成员 之一。它是由原癌基因c-erbB1编码的一种多功能跨膜糖蛋白,分子量约为170kD,由1186个 氨基酸组成,分为胞内区、胞外区和跨膜区,EGFR人体内分布非常广泛,在哺乳动物上皮细 胞、胶质细胞、成纤维细胞等细胞膜上均有表达,EGFR其它家族成员还包括HER2、HER3和 HER4。EGFR及其家族成员在细胞生长、增殖、分化、存活和迁移中均起着非常重要生理调控 作用。 EGFR在多种肿瘤(如肺癌、乳腺癌、结肠癌、胃癌、脑癌、膀胱癌、头颈部肿瘤、卵巢 癌、肾癌和前列腺癌)存在突变或高表达,与肿瘤发生、发展和恶性增值密切相关,并因此成 为目前最为成功的肿瘤治疗靶点之一,适用于肺癌、消化道等多种肿瘤治疗。EGFR突变主要 有四种形式,包括基因扩增、框内缺失、串联重复和点突变,EGFR突变体III(EGFR variant III,EGFRvIII)最常见突变形式之一,成为神经系统肿瘤诊疗潜在靶点,也可见于多种类型 肿瘤,目前为止,尚未在正常组织中检出EGFRvIII,EGFRvIII是相关肿瘤诊断的重要标识。 特别是近年来,抗体药物治疗迅猛发展,业已成为肿瘤免疫治疗的重要工具,全球范围内, EGFR是热门靶点,至今已有多个EGFR抗体批准进入临床,包括西妥昔单抗、帕尼单抗、耐昔 妥珠单抗和尼妥珠单抗,它们对肿瘤治疗适应症和应用呈上升态势,在这些上市的EGFR单 抗中,只有帕尼单抗(Panitumumab)可以同时中和EGFRvIII和野生型EGFR抗体,减弱细胞内 活化信号,具有显著的体外和体内肿瘤活性。但目前这些抗体中,不少抗体仍具有鼠源蛋白 成分,易产生抗鼠抗体反应,反复应用时会影响效能,鉴于人源抗体药物发展大趋势,制备 特色人源EGFR单克隆抗体,在EGFR靶向的免疫导向治疗中,则具有更好应用价值和前景。目 前全人源抗体的获得仍不易。 有鉴于此,特提出本发明。
技术实现要素:
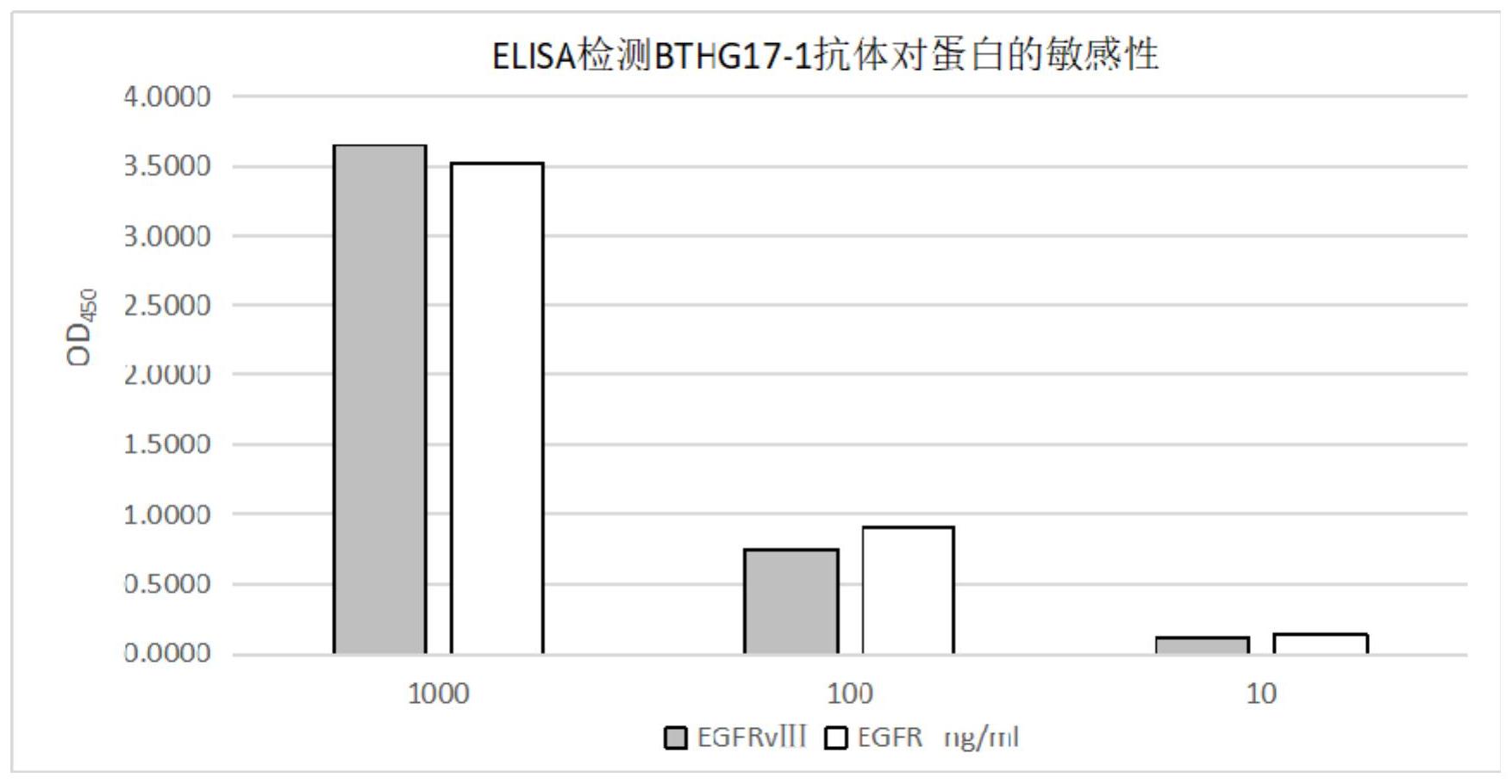
本发明的目的在于提供一种EGFRvIII和EGFR的双特异性人源抗体及其应用,本发 明所提供的人源抗体可以特异性结合EGFR和EGFRvIII两种蛋白,具有较高的亲和力,且该 抗体为全人源抗体,具有更低的免疫原性,为EGFR为靶点相关癌症治疗提供一种新的抗体 选择。 除非另外定义,在此使用的所有技术术语、注释以及其他科学术语或科学术语是 旨在具有本发明涉及领域普通技术人员所通常理解的含义。在一些情况中,为了清楚和/或 为了便于引用在此定义了具有通常理解含义的术语,并且在此包括这类定义不必解释成表 示与本领域通常理解的具有显著差异。在此说明或引用的许多技术和步骤被本领域普通技 4 CN 111548417 A 说 明 书 2/12 页 术人员良好地理解并且使用常规方法一般性地使用。除非另外说明,通常地根据制造商限 定的实验方案和/或参数来执行涉及使用可商购的试剂盒和试剂的步骤。 一方面,本发明提供一种抗EGFR或EGFRvIII的全人源抗体或其抗原结合片段,所 述人源抗体或其抗原结合片段均具有如SEQ ID NO.6-8所示的轻链CDR1、CDR2和CDR3,以及 如SEQ ID NO.11-12所示的重链CDR1、CDR2和CDR3。 目前人源化抗体已经彻底取代鼠源抗体的治疗应用,主要是通过鼠源抗体的人源 化实现,而全人源抗体则成为新一代治疗性抗体发展的大趋势。全人源抗体技术主要有转 人Ig基因鼠、抗体库技术和单个B细胞技术。噬菌体库技术具有更好的可操作性,其中诱导 性抗体库,有助于获得特定目标抗原针对性抗体,提高成功率。本发明选择肺癌患者为主 体,入组了较大样本量,构建肺癌B细胞来源的噬菌体单链抗体库,从中筛选得到上述抗 EGFR或EGFRvIII的人源抗体。该人源抗体对EGFR和EGFRvIII均具有特异性结合能力,具有 双特异性特点,且该人源抗体对EGFR和EGFRvIII蛋白具有较高的亲和力以及检测灵敏度, 由于该人源抗体的序列均为人源序列,其应用于人体靶向EGFR相关的癌症治疗时,不容易 引起体内的异源蛋白免疫反应,本发明为靶向EGFR提供了一种新的抗体选择。 术语“抗体”特别地是指包含通过二硫键连接的至少两个重链和两个轻链的蛋白 质。术语“抗体”包括天然产生的抗体以及抗体的重组形式,例如,在原核生物中表达的抗 体、未糖基化的抗体、人源抗体和嵌合抗体。每个重链由重链可变区(VH)和重链恒定区(CH) 组成。每个轻链由轻链可变区(VL)和轻链恒定区(CL)组成。重链恒定区包含三个或-在IgM- 或IgE-型抗体的情况下-四个重链恒定结构域(CH1、CH2、CH3和CH4),其中第一个恒定结构 域CH1与可变区相邻,并且可以通过铰链区连接第二个恒定结构域CH2。轻链恒定区仅由一 个恒定结构域组成。可变区可以进一步细分成超可变区,称为互补决定区(CDR),其中散布 更保守的区域,称为框架区(FR),其中每个可变区包含三个CDR和四个FR。然而,根据本发明 的术语“抗体”还包括如重链抗体(即,抗体只由一个或多个(特别是两个)重链组成)和纳米 抗体(即,抗体只由单个单体可变结构域组成)这样的抗体。 术语“人源抗体”特别地是指其中至少一个CDR源自人抗体并且其中恒定区(如果 存在)和可变区的至少一个框架区源自人抗体或人抗体共有序列的抗体。优选地,重链可变 区的所有CDR,或更优选地,重链可变区和轻链可变区的所有CDR,源自人抗体。此外,优选重 链可变区的所有框架区,或更优选地,重链可变区和轻链可变区的所有框架区源自人抗体 或人抗体共有序列。CDR优选源自相同的非人抗体。一个可变区的头三个或所有框架区优选 源自相同的人抗体或人抗体共有序列,然而,重链可变区的框架区不是必须源自与轻链可 变区的框架区相同的人抗体或人抗体共有序列。目前最优化的非异源蛋白抗体是,其全部 序列均来自于人的免疫球蛋白基因,包括来自转人Ig转基因鼠和直接从人体获取的B细胞 来源的抗体基因全序列,这样抗体称为“全人源”抗体,或简称为“人源”抗体。 可选地,在本发明的一些实施方式中,所述人源抗体或其抗原结合片段具有如SEQ ID NO.9所示的轻链可变区和SEQ ID NO.13所示的重链可变区。 可选地,在本发明的一些实施方式中,所述人源抗体的重链恒定区选自人IgG、人 IgM、人IgE、人IgA或人IgD的重链恒定区。 可选地,在本发明的一些实施方式中,所述人IgG为IgG1、IgG2、IgG3或IgG4。 可选地,在本发明的一些实施方式中,人IgA为IgA1或IgA2。 5 CN 111548417 A 说 明 书 3/12 页 可选地,在本发明的一些实施方案中,所述人源抗体的重链恒定区如SEQ ID NO.17的第141-470位所示。 可选地,在本发明的一些实施方案中,所述人源抗体的轻链恒定区选自人κ型轻链 或人λ型轻链的恒定区。 可选地,在本发明的一些实施方案中,所述人源抗体的轻链恒定区如SEQ ID NO.15的第133-239位所示。 人源抗体的恒定区可以源自任何人抗体或人抗体共有序列。特别地,重链恒定区 可以是任何类型的,如γ、δ、α、μ或ε型重链。人源抗体因此可以是任何同种型的,如IgA、 IgD、IgE、IgG或IgM,包括任何亚类,如IgG1、IgG2、IgG3、IgG4、IgA1或IgA2。优选地,人源抗 体是IgG1或IgG2抗体,更优选IgG1抗体。此外,轻链恒定区也可以是任何类型的,如κ-或λ- 型轻链。优选地,人源抗体的轻链是κ-链。 可选地,在本发明的一些实施方式中,所述抗原结合片段选自Fab、Fab’、F(ab’)2、 Fv或ScFv。 可选地,在本发明的一些实施方式中,所述EGFR突变体III的氨基酸序列如SEQ ID NO.3所示。 另一方面,本发明提供如上任一项所述的人源抗体或其抗原结合片段在制备以 EGFR为靶点治疗癌症的药物中的应用。 可选地,在本发明的一些实施方式中,所述癌症为EGFR和/或EGFR突变体III表达 呈阳性的癌症。 所述癌症包括但不限于胶质细胞瘤、头颈癌、胰腺癌、肺癌、胃肠癌、前列腺癌、卵 巢癌、乳腺癌、肾癌、视网膜癌、皮肤癌、结肠癌、肝癌和膀胱癌;任何EGFR和/或EGFR突变体 III表达呈阳性的癌症均可以适用本发明提供的人源抗体或其抗原结合片段进行治疗。 可选地,在本发明的一些实施方案中,所述胶质细胞瘤为神经胶质细胞瘤。 可选地,在本发明的一些实施方案中,结肠癌指转移性结直肠癌; 可选地,在本发明的一些实施方案中,所述肺癌为非小细胞肺癌(包括腺癌和鳞癌 等)。 另一方面,本发明提供一种治疗癌症的药物,其含有如上任一项所述的人源抗体 或其抗原结合片段。 另一方面,本发明提供一种检测EGFR或EGFRvIII的试剂,其含有如上任一项所述 的人源抗体或其抗原结合片段。 另一方面,本发明提供一种表达嵌合抗原受体的细胞,所述嵌合抗原受体具有靶 向EGFR的抗原结合结构域,所述抗原结合结构域具有如SEQ ID NO .6-8所示的轻链CDR1、 CDR2和CDR3,以及具有如SEQ ID NO.11-12所示的重链CDR1、CDR2和CDR3。 可选地,在本发明的一些实施方式中,所述嵌合抗原受体的抗原结合结构域具有 如SEQ ID NO.9所示的轻链可变区和SEQ ID NO.13所示的重链可变区。 可选地,在本发明的一些实施方式中,所述细胞为T-细胞、NK细胞、NKT细胞、单核 细胞、巨噬细胞、抗原呈递细胞、树突状细胞、中性粒细胞或干细胞等。 可选地,在本发明的一些实施方式中,所述嵌合抗原受体还具有跨膜结构域和共 刺激信号传导功能域。 6 CN 111548417 A 说 明 书 4/12 页 可选地,在本发明的一些实施方案中,所述跨膜结构域选自如下蛋白分子中的至 少一种的跨膜结构域:CD5、CD3ε、CD4、CD28、CD137、CD9、CD154、CD45、CD37、CD16、CD22、 CD134、CD33和CD8。 可选地,在本发明的一些实施方案中,所述跨膜结构域为CD8跨膜结构域。 可选地,在本发明的一些实施方案中,所述共刺激信号传导功能域包含如下共刺 激分子中的至少一种的细胞内结构域:OX40、CD134、CD5、CD3γ、CD3δ、CD3ε、CD154、CD79a、 CD137、CD22、CD66d、CD2、CD4、CD5、CD79b、CD28、ICOS、4-1BB和CD3ζ。 可选地,在本发明的一些实施方案中,所述共刺激信号传导功能域包括4-1BB的胞 内共刺激元件和CD3ζ的胞内结构域。 另一方面,本发明提供一种抗体偶联物,其含有如上任一项所述的人源抗体或其 抗原结合片段。 本发明的抗体偶联物可以利用各种标记偶联技术,对抗体进行毒素、肿瘤治疗药 物、酶、荧光素和同位素等标记。 与所述人源抗体或其抗原结合片段偶联的分子可以是成像剂,也可以是治疗剂, 或其他分子。 成像剂例如可以是放射性元素、酶、当暴露于紫外等一定的光谱照射时能发出荧 光的化学药品和其他物质。许多荧光材料是已知的并且可用作成像剂。这些成像剂包括例 如荧光素、罗丹明、金胺、德克萨斯红、AMCA蓝和荧光黄。 可检测的成像剂包括但不限于放射性标记物例如同位素3H、14C、32P、35S、36Cl、51Cr 、57Co、58Co、59Fe、90Y、121I、124I、125I、131I、111In、211At、198Au、67Cu、225Ac、213Bi、99Tc和186Re,可使 用抗体成像领域内已知的常规化学作用将其连接至本发明的抗体。成像剂还包括荧光标记 物和在本领域中常规用于MRI-CT成像的标记物。它们还包括酶标记物,例如辣根过氧化物 酶。标记物还包括化学部分例如生物素,其可通过结合至特定的关联(cognate)可检测部分 例如经标记的抗生物素蛋白而被检测。 治疗剂可以是具有毒害癌症细胞、抑制癌症细胞生长,或者阻止或降低癌症细胞 的分裂和/或转移的能力的分子,例如其包括但不限于:多花白树素(gelonin)、bouganin、 皂草毒素蛋白(saporin)、篦麻毒素(ricin)、篦麻毒素A链、bryodin、白喉毒素(diphtheria toxin)、局限曲菌素(restrictocin)、假单细胞外毒素A(Pseudomonas exotoxin A)和它们 的变异体。 治疗剂还可以是破坏DNA的分子,例如其包括但不限于:烯二炔类(例如刺孢霉素 和es pe ra m i c i n)以及非烯二炔类小分子试剂(例如博来霉素(bl e o m y c i n) 、 methidiumpropyl-EDTA-Fe(II)),以及包括但不限于:正定霉素(daunorubicin)、阿霉素 (doxorubicin)、远端霉素A(distamycin A)、顺铂(cisplatin)、丝裂霉素C(mitomycin C), 海鞘素(ecteinascidins)以及博来霉素/培洛霉素(pepleomycin)。 治疗剂还可以是破坏微管蛋白的试剂,例如包括但不限于:力索新(rhizoxin)/美 登素(maytansine)、紫杉醇(paclitaxel)、长春新碱(vincristine)和长春碱 (vinblastine)、秋水仙碱(colchicine)和peloruside A。 另一方面,本发明提供一种核酸分子,其编码如上任一项所述的人源抗体或其抗 原结合片段。 7 CN 111548417 A 说 明 书 5/12 页 在此用的术语“核酸分子”是指由天然碱基、糖和糖间(骨架)键连组成的核苷 (nucleoside)或核苷酸(nucleotide)单体的序列。该术语也包括含有非天然发生的单体或 其部分的修饰过的或取代过的序列。本发明的核酸分子可以是脱氧核糖核酸序列(DNA)或 核糖核酸序列(RNA),并可包含天然碱基,包括腺嘌呤、鸟嘌呤、胞核嘧啶、胸腺嘧啶和尿嘧 啶。也可含修饰的碱基。这些修饰的碱基的例子包括含氮和脱氮腺嘌呤、鸟嘌呤、胞核嘧啶、 胸腺嘧啶和尿嘧啶;以及黄嘌呤和次黄嘌呤。 另一方面,本发明提供一种载体,其含有如上所述的核酸分子。 在此以其最通常的意思来使用术语“载体”并且包括用于核酸的任何中间媒介物, 其能够使所述核酸例如引入原核生物和/或真核生物细胞中,并且在合适的情况下,整合至 基因组中。这种类型的载体优选在细胞中复制和/或表达。载体包含质粒、噬菌粒、噬菌体或 病毒基因组。如在此所用的术语“质粒”通常涉及染色体外基因材料的构建体,通常是环状 DNA双链,其可以独立于染色体DNA而进行复制。 另一方面,本发明提供一种重组细胞,其含有如上所述的载体。 术语“重组细胞”指的是可以用外源核酸转化或转染的任何细胞。根据本发明的术 语“重组细胞”包含原核生物(例如,大肠杆菌)或真核生物细胞(例如,哺乳动物细胞,特别 是人细胞、酵母细胞和昆虫细胞)。特别优选哺乳动物细胞,如来自人、鼠、仓鼠、猪、山羊或 灵长类动物的细胞。细胞可以源自多个组织类型,并且包含初级细胞和细胞系。核酸可以以 单拷贝形式或两个或多个拷贝形式存在于宿主细胞中,并且在一个实施方案中,在重组细 胞中表达。 可选地,在本发明的一些实施方式中,所述重组细胞为真核细胞;可选地,在本发 明的一些实施方案中,所述重组细胞为哺乳动物细胞,可选地,在本发明的一些实施方案 中,所述重组细胞为HEK293细胞。 另一方面,本发明提供一种制备如上任一项所述的人源抗体或其抗原结合片段的 方法,其包括: (a)培养如上所述的重组细胞; (b)从步骤(a)的培养产物中回收所述人源抗体或其抗原结合片段。 附图说明 为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附 图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对 范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这 些附图获得其他相关的附图。 图1为Western blot鉴定表达的EGFRvIII突变蛋白,M:蛋白分子量Marker;E2:微 量纯化测试的蛋白表达样品;S1-S4:不同表达时间的培养基上清样品,依次是第三天、第四 天、第五天、第六天。 图2为重组EGFRvIII突变蛋白纯化后的SDS-PAGE分析结果,M:蛋白分子量Marker, E1-E10:蛋白洗脱进程中是分管收集到的蛋白样品。 图3为野生型EGFR蛋白的SDS-PAGE分析结果,M:蛋白分子量Marker。 图4为抗EGFR人源全长抗体的非还原状态的SDS-PAGE分析结果,非还原状态呈现 8 CN 111548417 A 说 明 书 6/12 页 一条完整抗体条带,左:Marker,右:BTHG17-1全长抗体。 图5为抗EGFR人源全长抗体的还原状态的SDS-PAGE分析结果,还原状态呈现电泳 抗体呈两条带,左:Marker,右:BTHG17-1全长抗体。 图6为抗EGFR人源全长抗体结合EGFRvIII和EGFR的敏感性测定结果,纵坐标: OD450值;横坐标:包被蛋白浓度(/ml)。 图7为抗EGFR人源全长抗体结合肿瘤细胞表面EGFR的流式细胞术检测结果,A:自 左至右依次是A549、NCI1975和U87与标准EGFR抗体结合后,用抗鼠IgG-PE二抗染色的流式 分析直方图,单独抗鼠IgG-PE二抗染色为对照;B:自左至右依次是A549、NCI1975和U87分别 经BTHG17-1抗体或另一种同性质的BTHG17-2抗体染色后,抗人IgG-APC二抗染色的流式分 析直方图,单独抗人IgG-APC二抗染色为对照。 图8为抗EGFR人源全长抗体的亲和力测定结果,曲线从上往下是:500nm,250nm, 125nm,62.5nm,31.25nm,0nm。 图9为抗EGFR人源全长抗体的结合表位分析结果,Fortebio Octet分析,探头依次 与BTHG17-1、EGFR蛋白和另外一个抗体克隆再结合情况,如图示纵向虚线右侧的折射线:自 上至下依次为EGFR标准抗体、BTHG17-2和BTHG17-1折射图形线。 图10为基于BTHG17-1抗体构建的SCFV(EGFR)CART质粒结构,LTR:长末端重复序 列,K:Kozak序列,L:人工信号肽,CD8:CD8-Hinge和CD8跨膜区,2A:2A多肽,IgG:IgG1-Fc;M: Marker。 图11为SCFV(EGFR)CART质粒转染293T细胞的GFP蛋白表达情况,左图为质粒转染 293T细胞白光图像(200×),右图为质粒转染293T细胞的荧光显微镜图,细胞转染率超过 80%(200×)。 图12为稀释不同浓度的BTHG17-1抗体结合不同包被浓度EGFRvIII的ELISA测试数 据。 图13为pcDNA3.1质粒载体的图谱。












