技术摘要:
本发明公开了一种靶向沉默STAT3对人脑胶质瘤U251细胞缺氧诱导影响的研究方法及其应用,构建靶向STAT3基因的shRNA转染U251细胞,显微镜观察感染效率,实时荧光定量PCR及Western blotting检测STAT3的沉默效率;体外三维培养和Transwell小室侵袭实验检测STAT3基因沉默对细 全部
背景技术:
胶质瘤是人中枢神经系统最为常见的原发性肿瘤,具有发病率高、复发率高、死亡 率高及治愈率低等特点。虽经手术、放化疗等综合诊治,效果仍不理想。研究其发病机理,寻 找新的治疗靶点是目前亟待解决的课题之一。作为一个多因素参与、多基因改变、多步骤演 进的复杂过程,胶质瘤发病与周围微环境的影响密切相关。研究表明,缺氧是胶质瘤细胞周 围微环境的最显著特征。在缺氧条件下,肿瘤细胞能够通过一种不依赖于原有血管内皮细 胞的新的肿瘤内管状网络结构——血管生成拟态(vasculogenic mimicry,VM)的形成,从 而为胶质瘤细胞的恶性增殖、侵袭和转移提供良好的血液灌注。信号转导子和转录激活子3 (Signal transducers and activators of transcriptions 3,STAT3)是细胞信号转导途 径JAK-STAT通路的重要底物,其异常表达和活化对胶质瘤发生、发展及恶性转化有重要促 进作用,是一种转录因子类癌基因。 像大多数实体肿瘤一样,人脑胶质瘤是一种对周围血管依赖性极强、从而实现其 快速增殖、浸润的恶性肿瘤。瘤周微环境及微生态系统重构、血管内皮细胞群落的活化状态 在此过程中发挥着至关重要的影响,与此同时伴随着相关基质因子的表达和信号转导通路 的改变。 VM是Maniotis等研究葡萄膜黑色素瘤时发现的肿瘤特有的供血方式。一般情况下 侵袭性越强的肿瘤越容易产生VM。在包括尤文氏肉瘤、恶性食管间质瘤等一些高侵袭性的 肿瘤中,肿瘤细胞在缺氧条件下,可以在没有血管内皮细胞参与下形成特有的微循环管道, 以维持血供及增殖、侵袭能力。随着肿瘤靶向性治疗的研究和发展状况,VM作为其独有的供 血模式自然受到国内外学者广泛关注。 STAT3是细胞因子受体介导的JAK-STAT信号转导通路中的核心转录因子,掌控着 下游bcl-xl、bcl-2、c-myc、cyclinD1、survivin、mcl-1和VEGF等多种基因的转录激活,对调 节细胞的生长、分化和凋亡发挥着重要的影响。异常STAT3(异常表达、异常活化)参与了包 括胶质瘤在内的多种肿瘤的恶性转化和增殖,通过上调多种促癌基因表达,抑制肿瘤细胞 的凋亡,促进肿瘤细胞的增殖,最终导致恶性肿瘤的发生和发展,被确定为一种重要的转录 因子类癌基因。研究表明,靶向性阻断STAT3信号通路,可以有效下调胶质瘤细胞中多种致 癌基因的表达水平,明显抑制肿瘤细胞增殖。STAT3是胶质瘤基因治疗研究中非常有效的分 子靶点。我们的前期研究表明JAK-STAT信号通路在胶质瘤细胞与人脑微血管内皮细胞之间 的Crosstalk机制中发挥了重要作用,但是能否通过影响胶质瘤VM形成来发挥作用目前报 道尚少。 4 CN 111607616 A 说 明 书 2/7 页
技术实现要素:
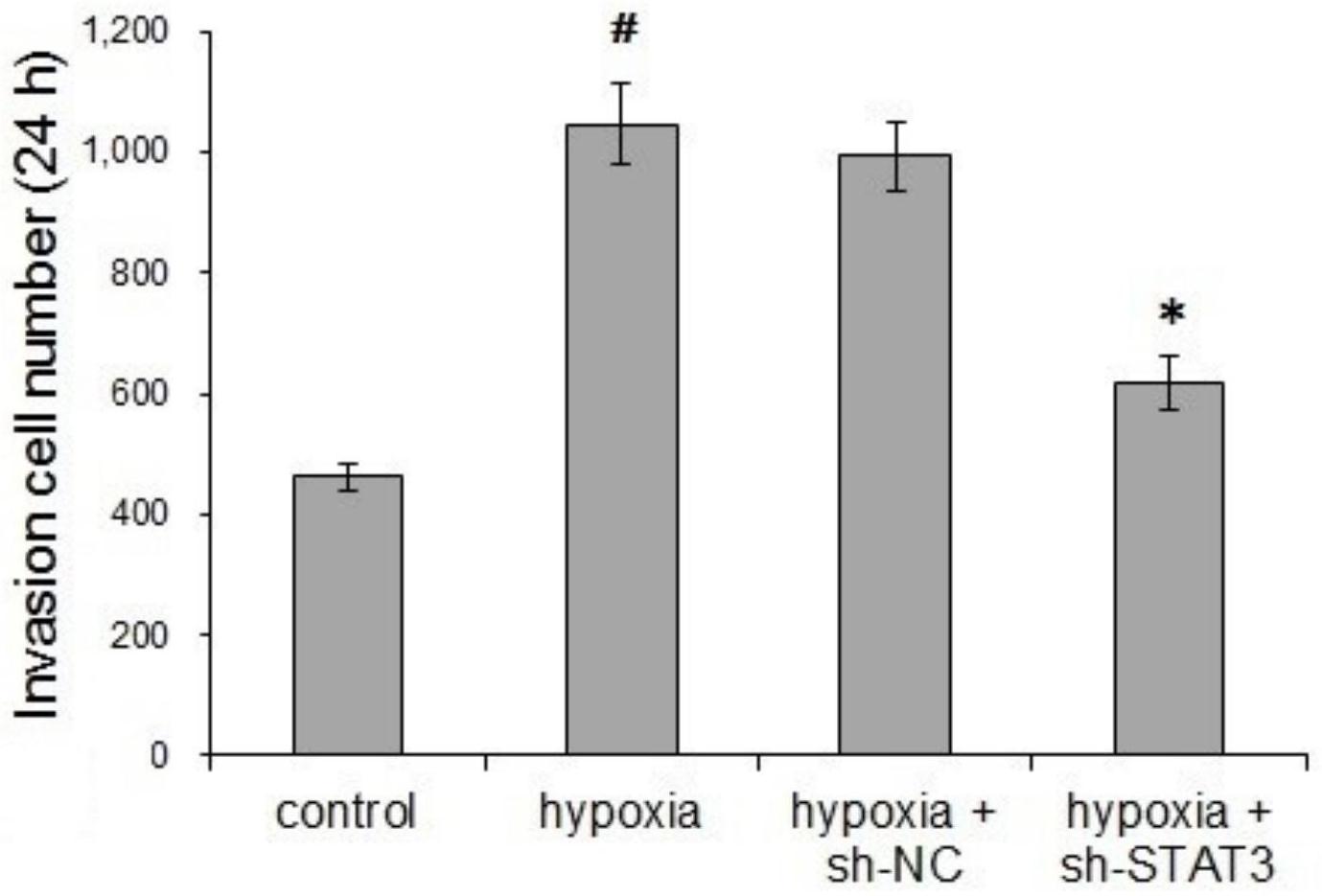
本发明的目的在于提供一种靶向沉默STAT3对人脑胶质瘤U251细胞缺氧诱导影响 的研究方法及其应用,该方法通过胶质瘤细胞系进行相关研究,进一步研究STAT3对胶质瘤 细胞在缺氧条件下血管生成拟态的作用,无疑能丰富其作为胶质瘤治疗新靶点、新机制的 实验依据和研究基础,为临床应用奠定更为坚实的基础。 其技术方案如下: 一种靶向沉默STAT3对人脑胶质瘤U251细胞缺氧诱导影响的研究方法,包括以下 步骤: 步骤1、sh-STAT3慢病毒载体的构建及鉴定 从Genbank中查找人STAT3基因(NM_003150)的序列信息,按原则设计RNA干扰序 列。通过BLAST同源性分析排除其他非特异性抑制基因序列的可能。经干扰预实验,筛选有 效靶序列,确定最终构建序列并合成。退火形成双链DNA,酶切连接,生成慢病毒载体。PCR鉴 定及DNA测序验证其正确性。以293T细胞包装生成完整病毒颗粒并测定其滴度。 步骤2、细胞培养及慢病毒感染效率的检测 人脑胶质瘤细胞U251在含10%胎牛血清、1×105U/L青霉素、100mg/L链霉素的 DMEM培养液中于37℃、5%CO2条件下培养孵育。细胞为贴壁生长。细胞分为4组:空白对照组 (control)、氯化钴(CoCl2)模拟体外缺氧组(hypoxia),sh-NC感染细胞模拟缺氧组 (hypoxia sh-NC)和sh-STAT3感染细胞模拟缺氧组(hypoxia sh-STAT3)。 收集状态良好的U251细胞,以5×104个/孔接种于6孔板,37℃、5%CO2培养至细胞 融合度达到30%,按照MOI=2.0加入0.9μL慢病毒,采用Normal Polybrene的方式感染,培 养24h后更换培养基,继续感染72h后观察慢病毒上报告基因GFP的表达情况。 步骤3、实时荧光定量PCR检测U251细胞中各基因mRNA表达水平 sh-RNA感染U251细胞48h后,收集细胞、PBS洗涤3次,按照TRIzol试剂盒操作手册 提取细胞总RNA,应用GoScriptTM Reverse Transcription System进行逆转录和PCR扩增。 STAT3基因引物序列:上游引物如SEQ:ID:NO:1所示,下游引物如SEQ:ID:NO:2所示,其扩增 产物大小为409bp。GAPDH基因引物序列:上游引物如SEQ:ID:NO:3所示,下游引物如SEQ:ID: NO:4所示,扩增片段为315bp。 步骤4、Western blotting检测各蛋白表达水平 收集融合度在70%~80%之间的各组细胞,加入预冷的细胞裂解液在冰浴中充分 裂解细胞,提取全蛋白,BCA法分析定量。 步骤5、慢病毒感染U251细胞血管生成拟态的影响 将BD基质胶置于冰水浴中过夜溶解,用预冷枪头吸取400μl Matrigel加入到水平 放置在冰盒上的24孔板内,均匀铺平后放入37℃培养箱内孵育1h使胶凝固。用胰蛋白酶消 化各组细胞,离心,弃上清后用DMEM重悬,调整细胞终浓度为1.5×105个/ml,接种于上述24 孔板内,每孔1ml,置于培养箱内继续培养24h。然后弃去培养基,PBS轻洗2次,在每孔内加入 1/10培养基体系的钙黄绿素溶液,37℃孵箱中孵育30min。荧光显微镜观察,在高倍显微镜 下随机选取5个视野拍照(200×),分别计数成管数目及管腔直径。每组实验均重复5次。 步骤6、慢病毒感染U251细胞侵袭能力的影响 将BD基质胶置于冰水浴中过夜溶解,在超净工作台中将其用无血清培养基稀释到 5 CN 111607616 A 说 明 书 3/7 页 浓度为10mg/ml(血清与BD基质胶的比例为5:1),每孔吸取100μl轻轻铺到孔径为8μm的聚碳 酸酯滤膜Transwell小室内,摇匀置于37℃孵育箱聚合5h。用胰蛋白酶消化各组细胞,离心 弃上清后用无血清DMEM重悬,调整细胞终浓度为5×105个/ml,在Transwell小室上层加入 200μl。下层加入600μl完全培养基置于37℃、5%CO2的培养箱中培养24h;4%多聚甲醛固定 细胞15min后,用棉签擦去小室上层细胞,并用0.1%结晶紫染色30min,PBS清洗,自然干燥, 在显微镜下取上、下、左、右、中五个视野拍照观察计数穿过Transwell小室聚碳酸酯膜的细 胞(200×)。每组实验均重复5次。 步骤7、统计学处理 应用SPSS 18.0软件进行统计学分析,计量资料以均数±标准差表示。组间比较采 用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。 进一步,步骤3中,PCR反应条件为95℃预变性30s,然后95℃变性30s、60℃退火 30s,72℃延伸30s,共35个循环后再72℃延伸6min。以2-ΔΔCt值(Ct代表循环阈值)表示 STAT3mRNA的相对表达量。每组实验均重复5次。 进一步,步骤4中,收集融合度为75%的各组细胞。 进一步,步骤4中,取10μg总蛋白样品,用4%~12%TrisGlycine胶进行SDS-PAGE 电泳,并转移至PVDF膜上,用TBST配制的牛奶封闭1h,加入一抗(体积稀释比为1:3000)4℃ 孵育过夜。其后用TBST洗膜5min×5次,用荧光二抗(体积稀释比为1:5000)避光室温孵育 1h,TBST洗膜5min×5次后用奥德赛(ODYSSEY CLx)曝光。扫描灰度并计算蛋白相应的表达 量。 再进一步,用8%TrisGlycine胶进行SDS-PAGE电泳。 本发明所述方法在治疗人脑胶质瘤的药物制备过程中的应用。 本发明的有益效果: 本发明成功构建靶向STAT3基因的shRNA慢病毒质粒并高效转染至U251细胞,且与 感染sh-NC慢病毒细胞相比,其STAT3mRNA的水平显著降低,提示通过RNA干扰技术沉默了胶 质瘤细胞STAT3的表达。与对照组及sh-NC感染组相比,sh-STAT3感染组细胞缺氧诱导的VM 形成能力显著下降,提示靶向沉默STAT3能够抑制U251缺氧诱导的VM。 附图说明 图1是sh-STAT3慢病毒载体结构及序列,其中,a:载体图谱及信息;b:载体PCR电泳 图;c:载体测序结果。 图2是sh-STAT3慢病毒对U251细胞的感染效率及靶向沉默效应,其中,a:显微镜下 观察sh-RNA的感染效率(A1:光学显微镜,sh-NC;A2:荧光显微镜,sh-NC;B1:光学显微镜, sh-STAT3;B2:荧光显微镜,sh-STAT3;100×);b:实时荧光定量PCR检测STAT3mRNA表达水 平,**与对照组比较P<0.01;c:Western blotting检测STAT3蛋白表达水平。 图3是体外三维培养实验检测沉默STAT3对细胞缺氧诱导的U251细胞血管生成拟 态(VM)的影响;其中,A:荧光显微镜观察对照组的VM形成情况;B:荧光显微镜观察缺氧组的 VM形成情况;C:荧光显微镜观察缺氧情况下用sh-NC感染时VM形成情况;D:荧光显微镜观察 缺氧情况下用sh-STAT3感染时VM形成情况;E:荧光显微镜高倍视野下VM定量计数,﹟﹟与对照 组比较P<0.01,**与缺氧组比较P<0.01。 6 CN 111607616 A 说 明 书 4/7 页 图4是Transwell小室侵袭实验检测沉默STAT3对缺氧诱导的U251细胞侵袭能力的 影响;其中,A:光学显微镜观察对照组U251细胞侵袭能力;B:光学显微镜观察缺氧组U251细 胞侵袭能力;C:光学显微镜观察缺氧情况下用sh-NC感染时U251细胞侵袭能力;D:光学显微 镜观察缺氧情况下用sh-STAT3感染时U251细胞侵袭能力; 图5是U251细胞侵袭能力的定量分析结果,﹟﹟与对照组比较P<0.01,**与缺氧组比 较P<0.01。 图6是Western blotting检测STAT3基因沉默后靶向蛋白表达情况;其中,a: Westernblotting检测STAT3基因沉默后MMP9、MMP14、EphA2及Laminin5γ2等蛋白表达情 况;b:Western blotting检测的统计分析结果,﹟与对照组比较P<0.05,**与缺氧组比较P< 0.01。












