技术摘要:
本发明提供了人羊膜上皮细胞外泌体在制备修复卵巢功能药物中的应用。动物实验证实,人羊膜上皮细胞外泌体能显著增加化疗损伤卵巢卵泡数量,抑制化疗药物诱导的卵巢急性血管损伤及颗粒细胞凋亡,部分抑制化疗药物诱导的原始卵泡激活,因此可用于修复化疗损伤后的卵巢功 全部
背景技术:
人羊膜属于胎儿附属物,是胎盘发育的早期产物,主要由上皮层、基底膜、致密层、 纤维母细胞层和海绵层组成。人羊膜上皮细胞(human Amniotic Epithelial Cells, hAECs)来源于上皮层,是由胚泡内细胞团发育而来。近年来研究表明,hAECs具有部分胚胎 干细胞特性,在特定条件下,可向3个胚层不同类型的细胞分化。而且,hAECs具有免疫耐受、 低免疫原性和非致瘤性等优良特点,并兼有旁分泌功能,可分泌多种生长因子、神经营养因 子和抗炎因子。因此,hAECs是干细胞治疗和再生医学领域的理想种子细胞资源。目前在 hAECs治疗神经系统疾病、心脏疾病、肝脏疾病、肺脏疾病、卵巢早衰以及修复皮肤缺损和抗 肿瘤方面均有研究。 外泌体是指包含了复杂RNA和蛋白质的小膜泡(30-150nm),现今,其特指直径在 40-100nm的盘状囊泡。外泌体的提取主要包括以下几种方式:超速离心法、过滤离心法、密 度梯度离心法、免疫磁珠法、PS亲和法和色谱法。人体内多种细胞及体液均可分泌外泌体, 包括内皮细胞、免疫细胞、血小板、平滑肌细胞等。外泌体可通过其携带的蛋白质、核酸、脂 类等来调节受体细胞的生物学活性。 期刊《中国细胞生物学学报》2018年第08期刊出的论文“人羊膜上皮干细胞来源的 外泌体促进小鼠神经干细胞向神经元方向分化”,公开了首次发现hAECs能促进小鼠NSCs向 神经元方向分化。具体地,首先采用超速离心的方法得到了纯度较高的hAECs-Exos,然后将 不同浓度的hAECs-Exos与mNSCs共培养。结果发现,与没有hAECs-Exos的对照组相比, 200ng/mL hAECs-Exos能明显促进小鼠NSCs向成熟神经元分化,主要表现在NeuN阳性细胞 所占比例明显增高。研究者推测,hAECs-Exos保留了hAECs的一些特性,其含有的神经营养 因子、生长因子、miRNAs等活性物质可能参与了微环境的调控,从而促进mNSCs向神经元方 向分化。因此,hAECs-Exos可能促进内源或外源NSCs的神经分化,从而促进损伤或退化神经 元的再生。 然而,目前还未见人羊膜上皮细胞外泌体用于修复卵巢功能的报道。
技术实现要素:
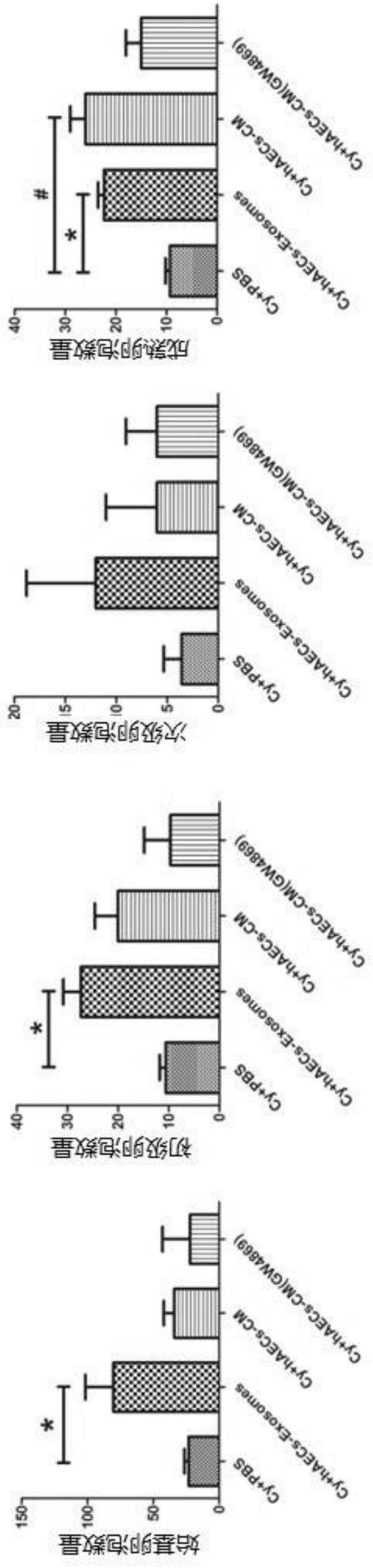
本发明针对现有技术中的不足,第一方面提供了人羊膜上皮细胞外泌体在制备修 复卵巢功能药物中的应用。 作为一个优选例,所述的修复卵巢功能指修复化疗损伤后的卵巢功能、减轻化疗 药物对卵巢的损伤、防治化疗药物引起的卵巢早衰或防治化疗引起的不孕不育。 作为另一优选例,所述的人羊膜上皮细胞外泌体制备方法为: (1)将足月健康产妇新鲜的羊膜组织经0.25%胰酶消化10-15min分离出人羊膜上 5 CN 111593017 A 说 明 书 2/7 页 皮细胞,重悬于含有胎牛血清的DMEM/F12培养基中,接种于细胞培养皿中后置于含有5% CO2的37℃细胞培养箱中进行培养;当细胞融合度达到70%-80%时,使用0.25%胰酶消化 贴壁细胞2-3min并重悬于含有胎牛血清的DMEM/F12培养基中,重新调整细胞密度并接种于 细胞培养皿中,放置于含有5%CO2的37℃细胞培养箱中进行培养;待细胞密度再次达到 70%-80%时,吸出含血清的完全培养基,用PBS缓慢洗涤2-3次后更换无血清的DMEM/F12培 养基培养;20小时后,缓慢地将培养基吸出,在1500-2500g条件下离心20-40min收集上清, 并使用孔径0.2μm的滤器将获得的培养基再次过滤去除残余细胞碎片,得到条件性培养基; (2)将上述获得的条件性培养基转入浓缩管进行体积浓缩,将浓缩后的条件性培 养基转移入新的离心管中,向其中添加外泌体抽提试剂,振荡混匀后2-8℃孵育过夜,第2 天,在4℃离心机中8000-12000g,离心0.5-1.5小时,外泌体为微小沉淀附着于管壁底部。 作为另一优选例,所述的人羊膜上皮细胞外泌体制备方法为: (1)将足月健康产妇新鲜的羊膜组织经0.25%胰酶消化12min分离出人羊膜上皮 细胞,重悬于含有胎牛血清的DMEM/F12培养基中,接种于细胞培养皿中后置于含有5%CO2 的37℃细胞培养箱中进行培养;当细胞融合度达到70%-80%时,使用0.25%胰酶消化贴壁 细胞2min并重悬于含有胎牛血清的DMEM/F12培养基中,重新调整细胞密度并接种于细胞培 养皿中,放置于含有5%CO2的37℃细胞培养箱中进行培养;待细胞密度再次达到70%-80% 时,吸出含血清的完全培养基,用PBS缓慢洗涤3次后更换无血清的DMEM/F12培养基培养;24 小时后,缓慢地将培养基吸出,在2000g条件下离心30min收集上清,并使用孔径0.2μm的滤 器将获得的培养基再次过滤去除残余细胞碎片,得到条件性培养基; (2)将上述获得的条件性培养基转入浓缩管进行体积浓缩,将浓缩后的条件性培 养基转移入新的离心管中,向其中添加外泌体抽提试剂,振荡混匀后2-8℃孵育过夜,第2 天,在4℃离心机中8000-12000g,离心0.5-1.5小时,外泌体为微小沉淀附着于管壁底部。 本发明第二方面提供了一种人羊膜上皮细胞外泌体,所述的人羊膜上皮细胞外泌 体的制备方法为: (1)将足月健康产妇新鲜的羊膜组织经0.25%胰酶消化10-15min分离出人羊膜上 皮细胞,重悬于含有胎牛血清的DMEM/F12培养基中,接种于细胞培养皿中后置于含有5% CO2的37℃细胞培养箱中进行培养;当细胞融合度达到70%-80%时,使用0.25%胰酶消化 贴壁细胞2-3min并重悬于含有胎牛血清的DMEM/F12培养基中,重新调整细胞密度并接种于 细胞培养皿中,放置于含有5%CO2的37℃细胞培养箱中进行培养;待细胞密度再次达到 70%-80%时,吸出含血清的完全培养基,用PBS缓慢洗涤2-3次后更换无血清的DMEM/F12培 养基培养;20小时后,缓慢地将培养基吸出,在1500-2500g条件下离心20-40min收集上清, 并使用孔径0.2μm的滤器将获得的培养基再次过滤去除残余细胞碎片,得到条件性培养基; (2)将上述获得的条件性培养基转入浓缩管进行体积浓缩,将浓缩后的条件性培 养基转移入新的离心管中,向其中添加外泌体抽提试剂,振荡混匀后2-8℃孵育过夜,第2 天,在4℃离心机中8000-12000g,离心0.5-1.5小时,外泌体为微小沉淀附着于管壁底部。 作为一个优选例,所述的人羊膜上皮细胞外泌体的制备方法为: (1)将足月健康产妇新鲜的羊膜组织经0.25%胰酶消化12min分离出人羊膜上皮 细胞,重悬于含有胎牛血清的DMEM/F12培养基中,接种于细胞培养皿中后置于含有5%CO2 的37℃细胞培养箱中进行培养;当细胞融合度达到70%-80%时,使用0.25%胰酶消化贴壁 6 CN 111593017 A 说 明 书 3/7 页 细胞2min并重悬于含有胎牛血清的DMEM/F12培养基中,重新调整细胞密度并接种于细胞培 养皿中,放置于含有5%CO2的37℃细胞培养箱中进行培养;待细胞密度再次达到70%-80% 时,吸出含血清的完全培养基,用PBS缓慢洗涤3次后更换无血清的DMEM/F12培养基培养;24 小时后,缓慢地将培养基吸出,在2000g条件下离心30min收集上清,并使用孔径0.2μm的滤 器将获得的培养基再次过滤去除残余细胞碎片,得到条件性培养基; (2)将上述获得的条件性培养基转入浓缩管进行体积浓缩,将浓缩后的条件性培 养基转移入新的离心管中,向其中添加外泌体抽提试剂,振荡混匀后2-8℃孵育过夜,第2 天,在4℃离心机中8000-12000g,离心0.5-1.5小时,外泌体为微小沉淀附着于管壁底部。 本发明第三方面提供了一种人羊膜上皮细胞外泌体的制备方法,所述的制备方法 包括以下步骤: (1)将足月健康产妇新鲜的羊膜组织经0.25%胰酶消化10-15min分离出人羊膜上 皮细胞,重悬于含有胎牛血清的DMEM/F12培养基中,接种于细胞培养皿中后置于含有5% CO2的37℃细胞培养箱中进行培养;当细胞融合度达到70%-80%时,使用0.25%胰酶消化 贴壁细胞2-3min并重悬于含有胎牛血清的DMEM/F12培养基中,重新调整细胞密度并接种于 细胞培养皿中,放置于含有5%CO2的37℃细胞培养箱中进行培养;待细胞密度再次达到 70%-80%时,吸出含血清的完全培养基,用PBS缓慢洗涤2-3次后更换无血清的DMEM/F12培 养基培养;20小时后,缓慢地将培养基吸出,在1500-2500g条件下离心20-40min收集上清, 并使用孔径0.2μm的滤器将获得的培养基再次过滤去除残余细胞碎片,得到条件性培养基; (2)将上述获得的条件性培养基转入浓缩管进行体积浓缩,将浓缩后的条件性培 养基转移入新的离心管中,向其中添加外泌体抽提试剂,振荡混匀后2-8℃孵育过夜,第2 天,在4℃离心机中8000-12000g,离心0.5-1.5小时,外泌体为微小沉淀附着于管壁底部。 作为一个优选例,所述的制备方法包括以下步骤: (1)将足月健康产妇新鲜的羊膜组织经0.25%胰酶消化12min分离出人羊膜上皮 细胞,重悬于含有胎牛血清的DMEM/F12培养基中,接种于细胞培养皿中后置于含有5%CO2 的37℃细胞培养箱中进行培养;当细胞融合度达到70%-80%时,使用0.25%胰酶消化贴壁 细胞2min并重悬于含有胎牛血清的DMEM/F12培养基中,重新调整细胞密度并接种于细胞培 养皿中,放置于含有5%CO2的37℃细胞培养箱中进行培养;待细胞密度再次达到70%-80% 时,吸出含血清的完全培养基,用PBS缓慢洗涤3次后更换无血清的DMEM/F12培养基培养;24 小时后,缓慢地将培养基吸出,在2000g条件下离心30min收集上清,并使用孔径0.2μm的滤 器将获得的培养基再次过滤去除残余细胞碎片,得到条件性培养基; (2)将上述获得的条件性培养基转入浓缩管进行体积浓缩,将浓缩后的条件性培 养基转移入新的离心管中,向其中添加外泌体抽提试剂,振荡混匀后2-8℃孵育过夜,第2 天,在4℃离心机中8000-12000g,离心0.5-1.5小时,外泌体为微小沉淀附着于管壁底部。 本发明第四方面提供了miR-1246在制备修复卵巢功能药物中的应用。 作为一个优选例,所述的修复卵巢功能指修复化疗损伤后的卵巢功能、减轻化疗 药物对卵巢的损伤、防治化疗药物引起的卵巢早衰或防治化疗引起的不孕不育。 本发明优点在于: 1、本发明首次证实人羊膜上皮细胞外泌体具有修复化疗损伤后卵巢功能的作用, 能减轻化疗药物对卵巢功能的损坏程度,效果优于人羊膜上皮细胞条件性培养基。 7 CN 111593017 A 说 明 书 4/7 页 2、本发明优化了人羊膜上皮细胞外泌体的制备方法,获得了显著增加各级卵泡数 量的外泌体。 3、本发明证实人羊膜上皮细胞外泌体中miR-1246能够显著抑制化疗药物诱导的 颗粒细胞凋亡,具有修复化疗损伤后卵巢功能的作用。 附图说明 图1-6.人羊膜上皮细胞条件性培养基中外泌体鉴定及动物实验设计。图1:显微镜 下人羊膜上皮细胞的形态学观察。图2:流式细胞术对人羊膜上皮细胞表面干细胞特异性蛋 白SSEA4以及上皮细胞特异性蛋白CD324的表达进行检测。图3:通过电镜对人羊膜上皮细胞 来源外泌体的形态学进行观察。图4:Western blot检测人羊膜上皮细胞外泌体中外泌体特 异性蛋白CD63及CD9的表达情况。图5:Nanosight分析人羊膜上皮细胞外泌体的粒径大小及 浓度。图6:人羊膜上皮细胞外泌体提取流程图及后续动物实验设计。 图7-8.人羊膜上皮细胞外泌体移植对化疗诱导的卵巢早衰小鼠卵泡发育及卵巢 功能的影响。图7:在移植后第4周,通过苏木素-伊红染色对不同处理组中的卵泡形态学进 行观察。图8:不同处理组中各级卵泡计数情况(包括始基卵泡、初级卵泡、次级卵泡、成熟卵 泡)。 图9-13.人羊膜上皮细胞外泌体对化疗后卵巢血管及颗粒细胞功能的影响。图9: 卵巢切片上细胞增殖标记物EdU以及血管内皮特异性标记CD34的免疫荧光染色。图10:不同 处理组中EdU以及CD34阳性细胞计数。图11:TUNEL染色检测凋亡细胞的组织定位情况。图 12:qRT-PCR检测卵丘扩张基因HAS2以及PTX3表达水平。图13:Western blot检测损伤卵巢 组织中凋亡特异性蛋白Caspase3的表达情况。 图14-16.人羊膜上皮细胞外泌体对化疗诱导原始卵泡激活的影响。图14:在人羊 膜上皮细胞外泌体移植后第7天,通过苏木素-伊红染色对损伤卵巢切片中的卵泡形态学进 行观察。图15:不同处理组中各级卵泡包括原始卵泡、初级卵泡、次级卵泡以及成熟卵泡的 计数分析。图16:Western Blot检测不同处理组中PI3K/Akt/mTOR信号通路中关键蛋白的表 达情况。 图17-18.人羊膜上皮细胞外泌体中microRNA检测。图17:在5例健康足月产妇人羊 膜细胞来源外泌体中,表达丰度较高的前50种microRNA名称。 图18:qRT-PCR检测人羊膜上皮细胞外泌体中microRNA的表达情况。 图19-24.人羊膜上皮细胞外泌体对颗粒细胞凋亡的体外分析。图19:PKH26荧光染 料对人羊膜上皮细胞进行标记。图20:提取PKH26标记的人羊膜上皮细胞外泌体,并将其添 加到颗粒细胞的培养基中24小时后,颗粒细胞进行Actin-Tracker及DAPI免疫荧光染色,通 过激光共聚焦显微镜在颗粒细胞中观察PKH26红色荧光信号。图21:Western blot检测不同 处理组中颗粒细胞的增殖蛋白PCNA以及凋亡相关蛋白的表达情况。图22:qRT-PCR检测共培 养体积中颗粒细胞的miR-1246、miR-197-5p、miR-1290、miR-4516、miR-4281以及miR-21-5p 的表达情况。图23:将miR-1246以及miR-21-5p拟似物及抑制剂转染颗粒细胞,通过qRT-PCR 对其表达水平进行检测。图24:Western Blot方法检测miR-1246或miR-21-5p过表达对颗粒 细胞中PCNA以及Caspase-3蛋白表达的影响。 8 CN 111593017 A 说 明 书 5/7 页












